珍稀濒危树种金钱槭的基因组DNA提取方法研究
吴晟昊 杨丽 向松竹 胡茜茜 周志翔 郑波 施雪萍 刘梅

摘要 [目的]明确高效提取金钱槭基因组DNA的方法。[方法]以金钱槭幼嫩叶片为材料,采用4种不同方法提取金钱槭基因组DNA,并通过紫外分光光度计法、琼脂糖凝胶电泳检测、限制性内切酶酶切和扩增保守基因片段等方法比较不同DNA的提取效率。[结果]高盐低pH法因操作时间较长导致DNA损失较多,提取到的DNA虽然杂质含量较低,但浓度也较低。SDS法提取效果不佳,提取到的DNA含量少且完整性差。尿素法提取的DNA质量最差,降解严重,难以用于后续分子生物学研究。改良CTAB法可以大量提取能够用于酶切及PCR扩增的DNA。[结论]金钱槭DNA高效提取方法的确定可以为相关的分子生物学研究提供科学依据和技术参考。
关键词 金钱槭;DNA提取;CTAB法
中图分类号 S792.35 文献标识码 A 文章编号 0517-6611(2024)03-0091-04
doi:10.3969/j.issn.0517-6611.2024.03.021
Study on Genomic DNA Extraction Methods for the Rare and Endangered Tree Species Dipteronia sinensis Oliv.
Abstract [Objective]To determine efficient method for extracting genomic DNA from D. sinensis.[Method]Four methods were used to extract genomic DNA from young leaves of D.sinensis.The efficiency of genomic DNA extraction was assessed by ultraviolet spectrophotometer, agarose gel electrophoresis, restriction enzyme digestion, and amplification of conserved gene fragments.[Result]The results showed that the high-salt, low-pH method led to more DNA loss due to the extended operation time, resulting in low concentration of DNA with low impurity content. The SDS method had a poor extraction efficiency, yielding DNA with low content and poor integrity. The urea method produced the worst DNA extraction, with severe degradation that renders it unsuitable for molecular biology research. The improved CTAB method successfully extracted a large amount of DNA suitable for enzyme digestion and PCR amplification. [Conclusion]The determination of an efficient DNA extraction method will provide scientific basis and technical references for related molecular biology research of D. sinensis.
Key words Dipteronia sinensis Oliv.;DNA extraction;CTAB method
金钱槭(Dipteronia sinensis Oliv.)是无患子科(Sapindaceae Juss.)金钱槭属(Diteronia Oliv.)落叶小乔木,高5~10 m,是我国特有的濒危树种,主要分布在我国西南地区。金钱槭树形优美,树干挺直,纹理清晰,材质细密,兼具观赏价值与经济价值[1]。目前,对金钱槭的研究主要集中在保护策略[2]、种群分布[3]和保护基因组学[4]上,但缺乏针对金钱槭基因组DNA提取方法的比较研究,目前有关高效提取金钱槭基因组DNA的方法鲜见报道。由于DNA的质量对其下游的分子生物学研究至关重要,因此找到高效提取金钱槭DNA的方法具有重要意义。笔者以金钱槭新鲜叶片为材料,采用改良CTAB法、SDS法、高盐低pH法和尿素法4种常用的提取方法,通过比较分析,找到最适合提取高品质金钱槭DNA的方法,旨在为后续有关金钱槭的分子生物学研究提供试验依据。
1 材料与方法
1.1 试验材料
2022年3月下旬将采于湖北省神农架林区的金錢槭新鲜枝条修剪为10 cm长的插穗,每根插穗保留2~3个嫩芽,将基部浸泡于含有0.01%(W/V)NAA的基质中处理20 h[5]后,扦插于蛭石与泥炭土等体积混合的土壤基质中。扦插材料放置于华中农业大学植物生长室培养,培养条件为16 h光照,8 h黑暗,温度为23 ℃。在生长室培养30 d后,用剪刀剪下萌发的新鲜叶片,迅速用液氮冷冻,并放置于-80 ℃超低温冰箱保存备用。
1.2 DNA提取方法
共采用改良CTAB法、SDS法、高盐低pH法和尿素法4种常用方法,用于提取金钱槭嫩叶的基因组DNA。每种方法3次重复。
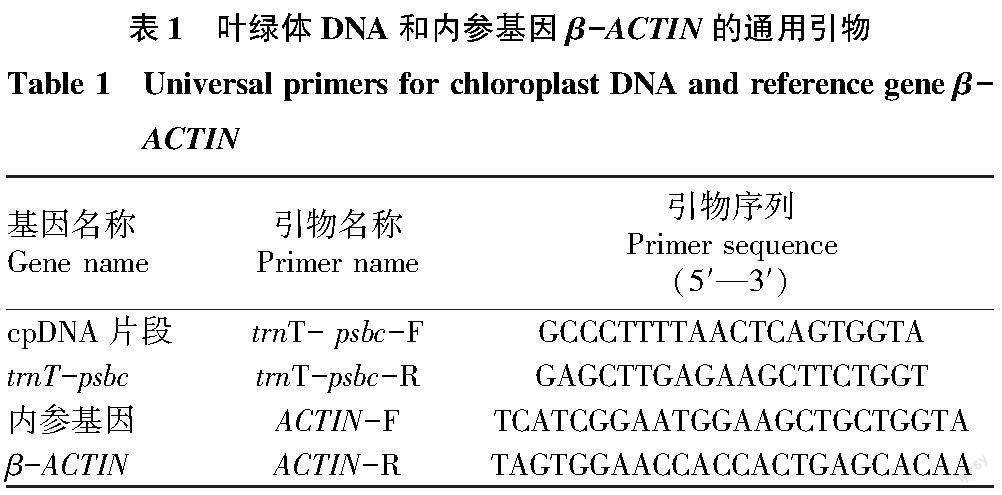
1.2.1 改良CTAB提取方法。试验步骤根据传统CTAB法并稍作修改,在原CTAB提取液中加入2% β-巯基乙醇和4%聚乙烯吡咯烷酮K40,具体为:①取-80 ℃超低温冰箱保存的叶片在液氮中充分研磨,称取约50 mg粉末并迅速转移到用液氮预冷的2 mL离心管中;②加入400 μL于65 ℃预热的CTAB提取液,在恒温混匀仪(Eppendorf,ThermoMixer C)中65 ℃摇晃混匀30 min;③加入等体积氯仿∶异戊醇溶液 (24∶1), 颠倒混匀后11 000 r/min离心10 min,吸取上清液;④加入等体积异丙醇,11 000 r/min离心10 min,弃掉上清液,并用75%(V/V)乙醇洗涤沉淀3次;⑤11 000 r/min离心2 min,将残留的乙醇吸净并吹干;⑥加入200 μL含0.1 mg RNase的TE缓冲液充分溶解DNA,在恒温混匀仪中37 ℃孵育30 min,然后将DNA样品保存于-20 ℃冰箱中备用。
1.2.2 SDS提取方法。参考王书珍等[6]使用的方法并稍作修改,具体为:①取-80 ℃超低温冰箱保存的叶片在液氮中充分研磨,称取约50 mg粉末并迅速转移到用液氮预冷的2 mL离心管中;②加入400 μL于65 ℃预热的SDS提取液,在恒温混匀仪中65 ℃摇晃混匀30 min;③加入200 μL 5 mol/L KAc,充分混匀后冰浴20 min,然后11 000 r/min离心10 min,吸取上清液,转移到新的1.5 mL离心管中;④加入等体积氯仿∶异戊醇溶液(24∶1),颠倒混匀后11 000 r/min离心10 min,吸取上清液;⑤加入2倍体积的无水乙醇,-20 ℃沉淀2 h;⑥11 000 r/min离心10 min,弃掉上清液,并用70%(V/V)乙醇洗涤沉淀3次;⑦11 000 r/min离心2 min,将残留的乙醇吸净并吹干;⑧加入200 μL含0.1 mg RNase的TE缓冲液充分溶解DNA,在恒温混匀仪中37 ℃孵育30 min,然后将DNA样品保存于-20 ℃冰箱中备用。
1.2.3 高盐低pH提取方法。参考邵亚林等[7]使用的方法并稍作修改,具体为:①取-80 ℃超低温冰箱保存的叶片在液氮中充分研磨,称取约50 mg粉末并迅速转移到用液氮预冷的2 mL离心管中;②加入400 μL于65 ℃预热的DNA提取液,在恒温混匀仪中65 ℃摇晃混匀30 min;③11 000 r/min离心10 min,吸取上清液;④加入2/3体积的2.5 mol/L KAc(pH=4.8),充分混匀后冰浴30 min,然后11 000 r/min离心10 min,吸取上清液,转移到新的1.5 mL离心管中;⑤加入等体积异丙醇,-20 ℃沉淀30 min;⑥11 000 r/min离心10 min,弃掉上清液,并用70%(V/V)乙醇洗涤沉淀3次;⑦11 000 r/min离心2 min,将残留的乙醇吸净并吹干;⑧加入200 μL含0.1 mg RNase的TE缓冲液充分溶解DNA,在恒温混匀仪中37 ℃孵育30 min,然后将DNA样品保存于-20 ℃冰箱中备用。
1.2.4 尿素提取方法。参考韩玉杰等[8]使用的方法并稍作修改,具体为:①取-80 ℃超低温冰箱保存的叶片在液氮中充分研磨,称取约50 mg粉末并迅速转移到用液氮预冷的2 mL离心管中;②加入400 μL于65 ℃预热的尿素提取液,在恒温混匀仪中65 ℃摇晃混匀30 min;③加入等体积氯仿∶异戊醇溶液(24∶1),颠倒混匀后11 000 r/min离心10 min,吸取上清液;④加入等体积异丙醇,11 000 r/min离心10 min,弃掉上清液,并用70%(V/V)乙醇洗涤沉淀3次;⑤11 000 r/min离心2 min,将残留的乙醇吸净并吹干;⑥加入200 μL含0.1 mg RNase的TE缓冲液充分溶解DNA,在恒温混匀仪中37 ℃孵育30 min,然后将DNA样品保存于-20 ℃冰箱中备用。
1.3 紫外分光光度计检测
取2 μL DNA提取液,以含0.1 mg RNase的TE缓溶液为对照,使用紫外分光光度计(Thermo,NanoDrop 2 000)检测DNA的纯度和浓度,用A260/A280表示DNA的相对纯度,用DNA产量(μg)与叶片鲜重FW(g)的比值表示DNA得率(μg/g)。
1.4 琼脂糖凝胶电泳检测
取5 μL DNA样品,以DL 15 000 DNA Marker(Takara)为对照,经0.8%琼脂糖凝胶(Coolaber)电泳后用凝胶成像系统(NEWBIO INDUSTRY,Molecular Imager Gel Doc EX System)观察拍照。
1.5 PCR扩增检测
选用叶绿体DNA(cpDNA)片段trnT-psbc[9]和内参基因β-ACTIN[10]设计通用引物(表1),引物由上海生工生物工程股份有限公司合成。以4种方法提取到的DNA为模板,使用PCR 仪(Eppendorf,Master-cycler nexus eco)进行产物扩增。cpDNA片段trnT-psbc的PCR反应条件: 95 ℃ 5 min,95 ℃ 15 s,60 ℃ 20 s, 72 ℃ 3 min,20个循环,72 ℃ 10 min;内参基因β-actin的PCR反应条件:95 ℃ 5 min,95 ℃ 15 s,60 ℃ 20 s,72 ℃ 15 s,30个循环,72 ℃ 10 min。PCR反应体系(10 μL)为:5 μL 2× Taq Plus Master Mix Ⅱ(Vazyme),上、下游引物(各10 μmol/L),20 ng模板DNA,超純水补足剩余体系。
取2个片段的扩增产物,分别以DL 5 000、DL 500 DNA Marker(Takara)为对照,经1.5%和3.0%琼脂糖凝胶(Coolaber)电泳后用凝胶成像系统观察拍照。
1.6 EcoRI酶切检测
酶切反应体系(20 μL):2 μL 10 × Buffer EcoRI(Thermo),1 μL EcoRI(Thermo),3 μg DNA,使用超纯水补足剩余体系。37 ℃水浴过夜后,终产物以DL 5 000 DNA Marker(Takara)为对照,进行0.8%琼脂糖凝胶(Coolaber)电泳,电泳结束后用凝胶成像系统观察拍照。
2 结果与分析
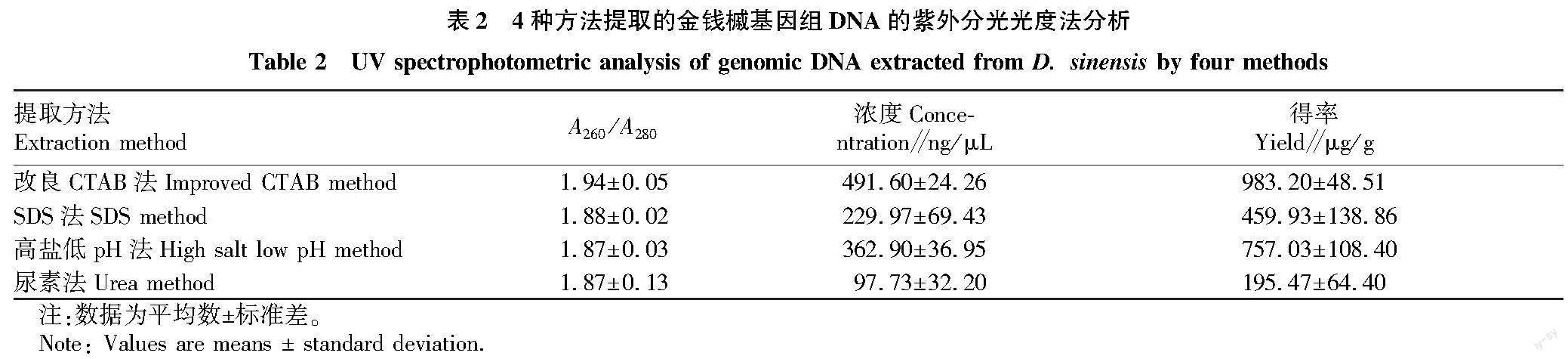
2.1 紫外分光结果
紫外分光光度计可对4种方法获得的金钱槭DNA纯度和浓度进行检测:A260/A280在1.8~2.0时,一般可以认为DNA纯度较高;A260/A280在1.8以下时,认为DNA纯度较低,可能含有蛋白质或酚类物质等杂质;当A260/A280为2.0以上时,认为RNA是DNA中主要的污染物质。检测结果见表2,4种方法提取的DNA,A260/A280为1.8~2.0,表明DNA纯度较高,4种方法都能去除大部分杂质污染。浓度和得率的计算结果表明,改良CTAB法提取到的DNA量最多,其次是高盐低pH法,SDS法第3,尿素法提取到的DNA量最少。
2.2 琼脂糖凝胶电泳结果
取4种方法提取的基因组DNA进行凝胶电泳,结果如图1a所示。从图1a可以看出,除尿素法外,其余3种方法提取的DNA都能观察到单一电泳条带,其中改良CTAB法的电泳条带最为明亮,高盐低pH法的电泳条带亮度相对较暗,SDS法的电泳条带最弱。并且SDS法提取获得的DNA片段长度相比于改良CTAB法和高盐低pH法有所减小,表明DNA的完整性较差,推测存在降解。尿素法未见条带,与NanoDrop测定的浓度结果不一致,推测可能是由于DNA降解严重,使样品A260值上升,因此检测到的浓度偏高。4种方法综合比较,改良CTAB法的提取效果最好。
2.3 酶切结果
使用限制性內切酶EcoRI对4种方法提取的DNA进行酶切,酶切产物的电泳结果如图1b所示。结果显示,除了尿素法提取的DNA可能由于降解严重,观察不到DNA条带,其他3种方法提取得到的DNA都能被EcoRI酶切,电泳条带呈抹带状,说明没有蛋白质等杂质干扰限制性内切酶工作,EcoRI能够以正常效率酶切,表明提取得到的DNA杂质少,符合进行下游分子生物学研究要求。
2.4 扩增结果
为了检测4种方法所提取的基因组DNA是否适用于PCR扩增,分别设计内参基因β-ACTIN和cpDNA片段trnT-psbc的通用引物,并对4种方法提取的DNA进行PCR扩增反应,扩增产物的电泳结果分别如图1c、图1d所示。结果显示,2次PCR反应得到的结果一致,4种方法提取的基因组DNA均可扩增出目的条带,其中尿素法提取得到的DNA扩增效率最差,条带最暗,表明DNA质量较差;SDS法对应的条带亮度较暗,仅优于尿素法,可能是由于DNA完整性不好导致扩增效率变低。改良CTAB法与高盐低pH法对应的条带清晰明亮,表明DNA质量好,可用于后续分子生物学研究。
3 讨论
对于不同植物,提取其基因组DNA的最佳方法通常也不同。SDS法被证明能高效提取醉马草[11]和川贝母[12]等植物的DNA,尿素法可从大蒜[13]中提取获得高浓度、高纯度的DNA,高盐低pH法成本低,能从白草种子[14]中获得高质量DNA。但SDS和尿素对多糖多酚类杂质的去除效果差,因此在槭属树种[15]和杜鹃[6]等富含多糖、色素、单宁以及多种酚类物质的植物DNA提取中,往往提取效果不佳。高盐低pH法操作流程时间较长,提取过程中DNA易出现损耗。在该试验中,尿素法提取的金钱槭DNA使用NanoDrop能够测出浓度,但凝胶电泳时未见条带,推测是DNA降解严重,难以进行下游分子生物学研究。SDS法提取效果不佳,凝胶电泳条带较暗,说明DNA浓度较低;PCR扩增效率较低,说明DNA可能纯度较差或完整性较差。高盐低pH法提取到的金钱槭DNA虽然品质较好,但耗时较长,且得率相对较低。上述3种方法均不是提取金钱槭DNA的最佳选择。
CTAB法被广泛用于各种植物基因组DNA的提取,利用CTAB去污剂的特性,能有效去除包括多糖多酚在内的多种杂质[16],从而得到高质量、高浓度的DNA。该研究采用的改良CTAB法是在曲士松等[17]总结的CTAB法的基础上增加使用了聚乙烯吡咯烷酮K40及β-巯基乙醇。聚乙烯吡咯烷酮K40和β-巯基乙醇能够结合酚类物质,抑制酚被氧化,有利于DNA的提取。在该试验中,使用改良CTAB法提取到的金钱槭基因组DNA兼具高浓度与高纯度,且DNA完整性好,能够用于下游分子生物学研究。说明改良CTAB法是4种方法中最适合提取金钱槭基因组DNA的方法。刘亭等[18]为了更有效地去除杂质,在提取过程中使用氯仿/异戊醇进行了二次抽提。该研究在前期进行二次抽提时发现,DNA的纯度没有明显提高,但是浓度显著下降,因此在后续试验中放弃使用二次抽提的改进方法。
综上所述,该研究通过对4种常用DNA提取方法的比较,确定了改良CTAB法是最适合提取金钱槭基因组DNA的方法,为后续金钱槭相关的分子生物学研究提供了参考。
参考文献
[1]丁新惠.金钱槭、金钱松在小陇山植物园引种栽培技术[J].中国农业信息,2014(23):10.
[2] 刘梦婷.七种珍稀濒危木本植物迁地保护的适应性评价[D].武汉:中国科学院大学(中国科学院武汉植物园),2018.
[3] 汪伟,周胜伦,安明态,等.贵州佛顶山国家级自然保护区金钱槭种群结构与空间分布格局[J].中国野生植物资源,2021,40(11):89-94.
[4] 冯钰.金钱槭属的系统发育与保护基因组学研究[D].杭州:浙江大学,2021.
[5] 雷颖,任继文.金钱槭繁育试验研究[J].林业实用技术,2014(3):62-63.
[6] 王书珍,张传进,查三省,等.杜鹃基因组DNA提取方法的研究及应用[J].林业科技通讯,2015(2):5-8.
[7] 邵亚林,司俊波,常玮,等.五种兜兰属植物基因组DNA提取方法比较[J].分子植物育种,2020,18(15):4965-4974.
[8] 韩玉杰,贾炜珑,王自霞,等.几种提取植物DNA方法的比较[J].山西农业科学,2008,36(7):17-19.
[9] 李珊.金钱槭属植物保护遗传学与分子亲缘地理学研究[D].西安:西北大学,2004.
[10] 储文渊,王玉娇,朱东悦,等.盐和干旱胁迫下杨树新内参基因的筛选[J].林业科学,2017,53(10):70-79.
[11] 陈雅琦,苏楷淇,李春杰.醉马草DNA提取方法的对比与优化[J].草学,2020(5):32-38.
[12] 刘亭,杨友辉,陆定艳,等.川贝母基因组DNA提取方法的研究[J].贵州医药,2018,42(10):1166-1169.
[13] 李姗姗,赵民楷,冯丹彦,等.五种大蒜DNA提取方法的比较研究[J].岳阳职业技术学院学报,2022,37(1):67-70.
[14] 郝豆豆,田志华,雷鸣,等.白草种子基因组DNA五种提取方法的比较[J].西部林业科学,2016,45(3):81-84,95.
[15] 马冬菁.槭属树种DNA提取方法比较研究[J].辽宁林业科技,2018(2):37-39.
[16] 李春霞,李宏飞.CTAB法高效提取苹果叶片DNA的研究[J].北方园艺,2009(2):49-52.
[17] 曲士松,刘宪华,黄宝勇,等.CTAB法提取大蒜、白菜基因组DNA[J].山东农业大学学报(自然科学版),2000,31(4):427-429.
[18] 刘亭,雷諝婷,罗阿东,等.白及DNA提取方法研究[J].中国实验方剂学杂志,2014,20(12):119-123.

