基于转录组学分析1-MCP与EBR联合处理对鲜黄花菜采后衰老的影响
李可昕,韩晨瑞,孙敏敏,曹建康,
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京市延庆区市场监督管理局,北京 102199)
黄花菜(Hemerocallis citrinaBaroni)又称“金针菜”“忘忧草”,是阿福花科萱草属的多年生草本植物。黄花菜营养丰富,富含多种生物活性化合物,深受消费者的喜爱[1]。然而,鲜黄花菜采后极易开花和衰老,出现变黄、失水、萎蔫、甚至腐烂等现象,在常温24 h后就失去了商品价值,极大地限制了鲜黄花菜贮藏、运输和消费[2]。采后使用2,4-表油菜素内酯(2,4-epibrassionolide,EBR)[3]、去甲二氢愈创木酸[4]以及低温和热处理[5]等保鲜措施,可以在一定程度上减少鲜黄花菜的采后损失。近年来,随着新鲜黄花菜种植规模的快速增长,延缓鲜黄花菜采后衰老和延长贮藏保鲜期的技术需求仍在不断增加。
外源植物激素处理是缓解果蔬品质劣变的有效措施。乙烯是一种能促进果蔬成熟衰老、黄化脱落的关键植物激素。而1-甲基环丙烯(1-methylcyclopropene,1-MCP)是一种竞争性乙烯受体抑制剂,由于1-MCP与乙烯受体(ethylene receptor,ETR)的结合能力是乙烯的10 倍,一旦ETR被1-MCP分子结合,果蔬内源性和外源性乙烯反应都会受到抑制[6]。目前,1-MCP已被用于延缓兰花、康乃馨、玫瑰、菊花、天竺葵等许多鲜花的采后寿命[7]。EBR是一种具有良好安全性和商业应用价值,广泛存在于植物体的新型激素。研究表明,EBR处理可以激活葡萄抗氧化系统,延缓成熟、衰老进程[8];还能通过抑制乙烯合成和叶绿素降解,有效延缓西兰花变黄[9]。目前的研究表明,1-MCP处理[10]和EBR处理[3]都能提高黄花菜抗氧化活性,延缓衰老进程。但是,两者单独处理鲜黄花菜的保鲜效果有限,对于二者协同增效应用的研究、应用条件及作用机制仍缺乏深入探讨。
因此,拟分析不同剂量1-MCP和EBR处理对鲜黄花菜的贮藏保鲜效果,筛选最优处理条件,确定适宜的1-MCP与EBR联合处理的方式,研究其对鲜黄花菜采后衰老进程的影响。利用转录组学分析方法,从转录水平上分析采后1-MCP与EBR单独及其联合处理对鲜黄花菜基因转录表达的影响,探讨差异表达基因(differentially expressed gene,DEG)涉及的分子功能和代谢途径,旨在深入揭示1-MCP与EBR联合处理延缓鲜黄花菜采后衰老的作用机制。
1 材料与方法
1.1 材料与试剂
黄花菜采摘于山西大同云洲区一家农场。花蕾在凌晨开花前采摘,选取色泽、形状、成熟期一致的黄花菜。采摘后在6 h内通过机械冷藏车运至实验室。
1-MCP(有效物质质量分数为3.3%)咸阳西秦生物科技有限公司;EBR 上海源叶生物科技有限公司。
1.2 仪器与设备
SE1501F电子天平 奥豪斯仪器(上海)有限公司;TGL-16C高速台式离心机 上海安亭科学仪器厂;NanoDrop 2000c微量分光光度计 美国Thermo Fisher Scientific公司;ESJ200-4万分之一分析天平 沈阳龙腾电子仪器有限公司;MNT-150电子游标卡尺 上海美耐特实业有限公司;NR11QC色差仪 深圳市三恩时科技有限公司;GC7890F气相色谱仪 上海天美科学仪器有限公司。
1.3 方法
1.3.1 样品处理与贮藏
1-MCP剂量筛选:黄花菜花蕾放置于塑料框(40 cm×30 cm×17 cm)中,塑料框用15 μm厚的聚乙烯(polyethylene,PE)薄膜包装,在-1~1 ℃冷库贮藏。分别用0(作为对照)、0.2、1、5 μL/L的1-MCP熏蒸黄花菜24 h(根据商品使用说明,将不同数量小袋包装的1-MCP喷洒少量蒸馏水后置于塑料框中密封),敞口0.5 h。所有处理均重复3 次。
EBR质量浓度筛选:用体积分数0.5%乙醇溶液溶解配制质量浓度分别为0(作为对照)、0.2、1、5 mg/L的EBR溶液,将鲜黄花菜分别放入不同质量浓度EBR溶液中浸泡10 min,自然晾干表面水分。处理后的花蕾放置于塑料框中,PE薄膜包装。所有处理均重复3 次。
1-MCP与EBR联合处理:将黄花菜花蕾用1 mg/L的EBR浸泡10 min,自然晾干表面水分后,将花蕾放置于塑料框中,用PE薄膜包装。再按照商品使用说明,用1 μL/L的1-MCP熏蒸黄花菜24 h,敞口0.5 h。所有处理均重复3 次。对照组、1 μL/L的1-MCP处理组和1 mg/L的EBR处理组的处理方法与上述方法一致。
各处理的黄花菜花蕾置于-1~1 ℃的冷库中贮藏15 d,定期观察和取样测定。进行转录组学分析的样品为低温贮藏0 d和12 d的黄花菜。其中,0 d为贮藏0 d的黄花菜,12 d-对照为贮藏12 d的对照组,MCP为贮藏12 d的1-MCP处理组,EBR为贮藏12 d的EBR处理组,ME为贮藏12 d的1-MCP与EBR联合处理组。
1.3.2 质量损失率、伸长率、开散率的测定
参考Li Kexin等[4]方法。每处理取100 根黄花菜,测定质量,以采收时的质量为初始值,计算贮藏过程中鲜黄花菜质量损失率。用电子游标卡尺测定黄花菜长度,以采收时的长度为初始值,计算贮藏过程中鲜黄花菜伸长率。以黄花菜花蕾顶端裂开0.5 cm以上或外花瓣连接处任一部位裂开的花蕾记为开散花,开散率以开散花蕾的数量占总数量的百分比计算。各指标均重复测定3 次。
1.3.3 色差的测定
参考Li Kexin等[4]方法。每处理取30 根黄花菜,采用色差仪测定黄花菜外花瓣中部固定位置的色差值,a*值表示绿红度,L*值表示亮度。重复3 次。
1.3.4 呼吸强度的测定
参考袁树枝[11]的方法。将50 g鲜黄花菜放置于1.1 L的盒中,密封,封闭2 h后,用10 mL注射器插入顶部橡胶塞中反复抽取平衡盒内气体,再用1 mL注射器抽取1 mL气体,用气相色谱测定顶空气体中CO2浓度,计算呼吸强度,单位为(mg/(kg·h))。重复3 次。
1.3.5 叶绿素含量的测定
参考曹建康[12]和Gu Shuang[13]等的方法。称取0.1 g黄花菜外花瓣中部组织样品与2 mL经预冷体积分数为90%的丙酮溶液混合,冰浴研磨至匀浆,在4 ℃、12000×g条件下离心25 min,收集上清液,用丙酮溶液定容至5 mL后,分别测定溶液在645 nm和663 nm波长处的吸光度,计算叶绿素a、叶绿素b、总叶绿素含量,单位为mg/kg。重复3 次。
1.3.6 RNA提取、测序、de novo转录组组装和Unigene注释
参考Li Kexin等[4]方法。称取100 mg黄花菜外花瓣中部组织样品,采用RNAprep Pure Plant Plus提取试剂盒提取RNA,重复3 次。构建cDNA文库后,使用Illumina NovaSeq高通量测序平台,基于边合成边测序技术,对cDNA文库进行测序。获得高质量Reads后,使用Trinity软件,识别每个样品中的转录本序列。对于各个样品的Clean Data,进行序列比对,将比对到Transcript或Unigene库的reads称为Mapped Reads,用于后续的分析。使用DIAMOND软件进行序列比对,将Unigene序列与各种数据库比对,以获得Unigene序列的注释信息。采用Bowtie将测序得到的Reads与Unigene库进行比对,根据比对结果,结合RSEM(RNA-Seq by Expectation Maximization)进行表达量水平估计。利用FPKM(fragments per kilobase of transcript per million mapped reads)值表示对应Unigene的表达丰度。使用DESeq2(v1.20.0)软件根据基因表达水平分析的read count值进行差异表达分析,以校正后的P<0.05作为DEG的筛选标准。根据京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路构建黄花菜激素合成、信号转导和叶绿素降解的途径。
1.4 数据统计与分析
使用Microsoft Excel 2019软件统计处理数据,结果以表示。用统计软件SPSS 25.0软件进行单因素方差分析(ANOVA),采用Duncan多重比较法进行显著性分析,P<0.05,差异显著。使用Origin 2021、TBtools软件分别绘制折线图、热图。
2 结果与分析
2.1 不同剂量1-MCP和EBR处理对黄花菜贮藏品质的影响
鲜黄花菜花蕾结构组成复杂,而外花瓣颜色由绿色转变为黄色是衰老的重要标志[14]。随着贮藏时间的延长,对照外花瓣的a*值持续增加,不同剂量1-MCP和EBR处理均能抑制a*值的增加(图1A)。贮藏15 d时,1 μL/L 1-MCP处理和1 mg/L EBR处理的黄花菜a*值分别比对照降低了21.96%和55.44%。黄花菜在贮藏10 d后L*值迅速降低,不同剂量1-MCP和EBR处理均能抑制L*值的降低(图1B)。在贮藏15 d时,1 μL/L 1-MCP处理和1 mg/L EBR处理的黄花菜L*值分别比对照提高了11.36%和13.95%。结果表明,1-MCP和EBR处理能有效抑制黄花菜的黄化,但处理间差异不显著。前人研究发现,EBR处理能够保持鲜黄花菜品质[3],可以抑制西兰花黄化指数[15],这与本研究的结果类似。


图1 不同剂量1-MCP和EBR处理对贮藏过程中黄花菜品质的影响Fig.1 Effects of different doses of 1-MCP and EBR treatments on the quality of daylily flower buds during postharvest storage
黄花菜在采后贮藏过程中出现明显的伸长现象,在贮藏5 d后伸长率迅速上升(图1C)。1 μL/L和5 μL/L 1-MCP处理能够在贮藏前10 d抑制黄花菜的伸长,分别比对照降低了20.49%和39.76%。EBR处理能够有效地抑制黄花菜的伸长,其中1 mg/L EBR处理的黄花菜在贮藏10 d和15 d时伸长率分别比对照降低了13.60%和10.47%。贮藏15 d时,黄花菜由于衰老皱缩,其伸长率下降。随着贮藏时间的延长,对照组黄花菜质量不断降低,质量损失率持续增加(图1D)。5 μL/L 1-MCP处理和EBR处理均能够抑制黄花菜质量损失率的增加。其中5 μL/L 1-MCP和1 mg/L EBR处理的黄花菜在贮藏15 d时,质量损失率分别比对照降低了28.19%和30.40%。Yuan Lingyun等[16]研究发现,EBR处理能够增强小白菜的抗氧化能力,保持叶片正常的颜色和形状。Liu Qing等[17]研究发现,利用EBR处理葡萄能够维持葡萄果实的硬度,抑制质量损失率、腐烂率和脱梗率。本实验的研究结果与前人的研究结果一致。鲜黄花菜各组织采后代谢水平差异大,主要受植物激素调控[14],而外源激素处理为调控鲜黄花菜体内激素代谢平衡和采后衰老生理进程提供了有效途径。
2.2 不同剂量1-MCP和EBR处理对黄花菜呼吸强度的影响
黄花菜花蕾采后生理代谢旺盛,低温贮藏过程中仍进行着强烈的呼吸作用[2],在贮藏9 d时均出现一个明显的呼吸高峰(图2)。1 μL/L 1-MCP处理显著抑制了黄花菜的呼吸强度,贮藏9 d时,其呼吸强度比对照降低了9.75%。EBR处理在一定程度上能够抑制黄花菜呼吸高峰出现前的呼吸作用,但差异不明显。前人研究表明,EBR处理能保持黄花菜采后品质,延缓质量损失,抑制呼吸作用[3],也可以抑制西兰花黄化指数和L*值的增加,抑制叶绿素含量的降低[17]。1-MCP处理能够抑制鲜黄花菜在贮藏期间的质量损失、黄化和呼吸强度,延缓黄花菜的衰老[10]。因此,综合各处理对鲜黄花菜的保鲜效果以及对不同指标的影响程度,选择1 μL/L 1-MCP与1 mg/L EBR联合处理黄花菜,进行后续实验研究。

图2 不同剂量1-MCP和EBR处理对贮藏过程中黄花菜呼吸强度的影响Fig.2 Effects of different doses of 1-MCP and EBR treatments on the respiratory intensity of daylily flower buds during postharvest storage
2.3 1-MCP与EBR联合处理对黄花菜贮藏品质的影响
对照鲜黄花菜在低温贮藏9 d时出现明显黄化,12 d时开始皱缩,15 d时顶部出现褐变,严重软烂;1-MCP与EBR单独及其联合处理能够延缓鲜黄花菜品质的劣变(图3A)。1-MCP与EBR联合处理能够抑制黄花菜a*值的增加和L*值的降低,贮藏15 d时,与对照相比a*值减少了92.57%(图3B),但L*值增加了26.38%(图3C)。1-MCP与EBR联合处理能够有效抑制鲜黄花菜伸长率的增加,贮藏10 d时,伸长率与对照相比减少了47.61%(图3D)。1-MCP与EBR联合处理能够有效抑制鲜黄花菜质量损失率和开散率的增加,在贮藏15 d时,质量损失率和开散率分别比对照减少了24.23%和34.96%(图3E、F)。1-MCP与EBR联合处理能够有效抑制鲜黄花菜的呼吸作用,在贮藏9 d时呼吸强度与对照相比降低了29.76%(图3G)。由此可见,1-MCP与EBR联合处理可能综合调控鲜黄花菜采后生理代谢,这与前人利用水杨酸和1-MCP联合处理进行果实保鲜的研究结果[6]类似。
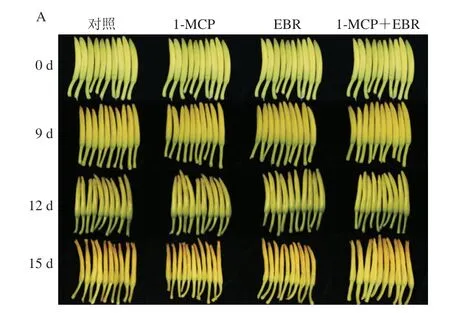

图3 1-MCP与EBR联合处理对贮藏过程中黄花菜品质的影响Fig.3 Effect of combined treatment with 1-MCP and EBR on the quality of daylily flower buds during postharvest storage
2.4 1-MCP与EBR联合处理对黄花菜叶绿素的影响
黄花菜外花瓣由绿转黄与叶绿素的降解密切相关[14],黄花菜在采后贮藏期间叶绿素含量不断降低,1-MCP与EBR单独及联合处理抑制了叶绿素a、叶绿素b和总叶绿素含量的下降(图4)。结果表明,1-MCP与EBR联合处理可进一步延缓叶绿素含量的降低,有利于保持黄花菜采后品质。

图4 1-MCP与EBR联合处理对黄花菜叶绿素a(A)、叶绿素b(B)和总叶绿素(C)含量的影响Fig.4 Effect of combined treatment with 1-MCP and EBR on chlorophyll a (A),chlorophyll b (B) and total chlorophyll (C) contents of daylily flower buds during postharvest storage
2.5 1-MCP与EBR联合处理对黄花菜叶绿素降解的转录调控
黄花菜衰老的重要标志之一是黄化,而黄化主要受叶绿素降解的影响。转录组学结果表明,在贮藏期间,鲜黄花菜许多参与叶绿素降解的基因表达量上调(图5、表1),例如c85040.graph_c2(编码脱镁螯合酶(magnesium dechelatase,MDcase))、c87254.graph_c0和c92271.graph_c1(编码红色叶绿素降解产物还原酶(red chlorophyll catabolite reductase,RCCR))基因表达量在12 d上调,而c77475.graph_c1(编码叶绿素酶(chlorophyllase,chl))和c78951.graph_c0(编码脱镁叶绿酸a单加氧酶(pheophorbide a oxygenase,PAO))基因表达量在12 d下调。经过1-MCP与EBR联合处理后,叶绿素降解基因的表达量低于对照,尤其是c87254.graph_c0和c92271.graph_c1(编码RCCR)基因。相关研究表明,乙烯不敏感3(ethylene insensitive 3,EIN3)通过直接激活拟南芥chl途径中的关键基因NYC1(nonyellow coloring 1)和PAO加速褪绿[18]。乙烯反应因子13(ethylene response factor 13,ERF13)在柑橘果实褪绿过程中调控PPH基因启动子活性,促进叶绿素降解[19]。Song Zunyang等[20]用1-MCP处理香蕉,发现叶绿素降解途径基因的表达量随着成熟度的增加而增加,1-MCP处理降低了它们的表达水平。1-MCP处理抑制了梨果实中的PAO和NYC等叶绿素降解相关基因的表达[21]。与对照相比,黄花菜经过1-MCP与EBR联合处理后抑制了叶绿素降解途径中MDcase、PAO、RCCR基因的表达,该结果与1-MCP和EBR联合处理抑制叶绿素含量的减少结果相印证。

表1 1-MCP与EBR联合处理后黄花菜DEG分析Table 1 Analysis of differentially expressed genes in daylily after combined treatment with 1-MCP and EBR

图5 1-MCP与EBR联合处理对叶绿素降解途径相关基因的转录调控作用Fig.5 Transcriptional regulation of genes related to chlorophyl degradation by combined treatment with 1-MCP and EBR
2.6 1-MCP与EBR联合处理对黄花菜乙烯和BR合成与信号转导的调控
1-MCP与EBR作用与植物激素合成和信号转导途径密切相关[3,22]。乙烯促进果蔬的衰老,而油菜素内酯(brassinosteroid,BR)往往抑制果蔬的衰老进程[23-24]。KEGG富集结果表明,1-MCP与EBR联合处理后黄花菜乙烯生物合成和信号转导途径与对照相比被抑制(图6A、表1)。乙烯信号转导途径中,与对照组相比,经过1-MCP与EBR联合处理后黄花菜c80581.graph_c0和c82678.graph_c0(编码本构三重响应1(constitutive triple response 1,CTR1))、c90070.graph_c0(编码EIN3结合F结构域蛋白(EIN3-binding F-box 1/2,EBF1/2))基因表达量增加,c27187.graph_c0和c83401.graph_c1(编码丝裂原活化蛋白激酶激酶(stress-induced mitogenactivated protein kinases kinases,SIMKK))基因表达量降低,从而抑制乙烯信号转导途径。1-氨基环丙烷羧酸合成酶(1-aminocyclopropane-1-carboxylate synthase,ACS)和乙烯氧化酶(ethylene oxidase,ACO)是乙烯生物合成途径中的限速酶,它们的表达会促进大量乙烯合成。1-MCP不仅能阻断花组织中的乙烯结合位点,还能抑制响应基因的表达,从而减少花组织对乙烯的响应[7]。在玫瑰中,1-MCP通过阻断乙烯结合位点抑制花衰老,但未能抑制ACS和ACO的表达[25]。Ha等[26]研究表明,1-MCP可下调切花玫瑰ETR基因的表达水平,从而延长切花寿命。Song Zunyang等[20]用1-MCP处理香蕉,发现1-MCP抑制了MaACS1、MaACO1、MaETR2-like、MaERF012基因的表达。在本研究中,1-MCP与EBR联合处理激活了CTR1、EBF1/2基因的表达,抑制了SIMKK基因的表达,从而抑制乙烯合成和信号转导途径。

鲜黄花菜在贮藏期间许多参与BR合成和信号通路的基因的表达量上调(图6B、表1)。经过1-MCP与EBR联合处理后,与对照相比,编码BR信号转导元件的基因表达量在贮藏12 d时显著上调,包括c77902.graph_c0、c91197.graph_c0和c85774.graph_c1(编码油菜素类固醇不敏感1相关激酶受体1(brassinosteroid insensitive 1 associated kinase receptor 1,BAK1)),c87235.graph_c0和c88331.graph_c1(编码油菜素类固醇不敏感1(brassinosteroid insensitive 1,BRI1)),c64032.graph_c0和c85251.graph_c4(编码木葡聚糖内糖基转移酶(xyloglucan endotransglucosylase,TCH4))。这一结果与Yang Qingxi等[27]研究结果一致,在EBR处理下,参与BR信号转导通路的BoBRI1基因及关键转录因子BoBZR1的表达被激活,增强了BR信号转导,BZR1已被证实可调节内源乙烯的生物合成,延缓果蔬的成熟衰老。在本研究中,1-MCP与EBR联合处理依次激活BRI1、TCH4基因的表达,激活BR信号转导,从而延缓黄花菜采后衰老过程。
2.7 1-MCP与EBR联合处理对黄花菜E3泛素连接酶基因的转录调控
泛素化的主要功能是通过精确降解错误折叠的蛋白和寿命短暂的蛋白,维持底物蛋白的稳定状态,为植物衰老生理提供内部环境[28]。E3泛素连接酶是泛素化反应的关键酶,它能够特异地识别底物蛋白并促进泛素向底物蛋白转移[29]。靶蛋白泛素化后可能被降解或转移到细胞中的特定部位,这一途径对蛋白质的质量控制起着重要作用[28]。在黄花菜衰老过程中,c77396.graph_c0(编码E3 ubiquitin-protein ligase RING1-like)、c92579.graph_c0(编码E3 ubiquitin protein ligase RIN2-like isoform X1)和c89234.graph_c0(编码E3 ubiquitin-protein ligase WAV3-like)基因表达量在贮藏12 d后下调,其余18 种E3泛素连接酶基因表达量均上调(图7、表1)。经过1-MCP与EBR联合处理后,E3泛素连接酶基因的表达量低于对照组,尤其是c88234.graph_c0(编码E3 ubiquitin-protein ligase SINAT2-like protein)、c74872.graph_c0(编码E3 ubiquitin-protein ligase MPSR1)、c80456.graph_c0(编码E3 ubiquitin-protein ligase RGLG3)、c91270.graph_c0(编码E3 ubiquitin-protein ligase MIEL1-like)、c90656.graph_c0(编码E3 ubiquitin-protein ligase LOG2)、c80794.graph_c0(编码E3 ubiquitin-protein ligase hel2-like)基因。前人研究表明,在拟南芥中E3泛素连接酶SINAT(SINA of arabidopsis thaliana,是一类RING(really interesting new gene)型E3泛素连接酶)过表达会出现ABA响应基因表达水平的增加,通过增加脱落酸(abscisic acid,ABA)受体的稳定性增强ABA响应[30]。E3泛素连接酶RGLG3是JA信号响应各种信号的上游调节剂[31]。E3泛素连接酶MIEL1可能促进ABA和生物胁迫信号之间的串联作用[32]。E3泛素连接酶LOG2受到干旱、高盐和ABA等胁迫后转录水平上调[33]。这些研究也进一步支持了本研究的结果,在本研究中,经过1-MCP与EBR联合处理后,编码E3泛素连接酶SINAT2-like、MPSR1、RGLG3、MIEL1-like、LOG2、hel2-like基因的表达与对照黄花菜相比处于较低水平,蛋白降解受到抑制。因此,1-MCP与EBR联合处理可能使黄花菜泛素化程度降低,使得细胞内部处于较稳定的水平,从而延缓黄花菜采后衰老。

图7 1-MCP与EBR联合处理对黄花菜E3泛素连接酶基因表达的转录调控作用Fig.7 Transcriptional regulation of E3 ubiquitin ligase gene expression by combined treatment with 1-MCP and EBR
3 结论
通过研究不同剂量1-MCP和EBR处理对鲜黄花菜贮藏品质和采后衰老进程的影响,发现1 μL/L 1-MCP和1 mg/L EBR联合处理能够有效抑制其黄化、伸长、软化、开散、质量损失、叶绿素降解,延缓采后黄花菜衰老,从而维持了黄花菜花蕾的品质。基于转录组学分析发现,1-MCP与EBR处理调控了黄花菜基因的转录水平,通过激活CTR1、EBF1/2基因、抑制SIMKK基因的表达,抑制乙烯信号转导途径;通过激活BRI1、TCH4基因的表达,激活了BR信号转导,从而改变了黄花菜体内衰老类和生长类植物激素的代谢平衡。1-MCP与EBR联合处理抑制了MDcase、PAO、RCCR基因的表达,从而抑制叶绿素的降解;抑制编码E3泛素连接酶基因表达,从而延缓了黄花菜采后衰老相关蛋白的作用。因此,1-MCP与EBR联合处理是一种有效延缓黄花菜采后衰老的方法,本研究可为提高鲜黄花菜采后贮藏品质提供理论依据。

