草菇子实体多肽对小鼠急性酒精肝的预防作用及肠道菌群的影响
张芳艺,林海潞,陈莉莉,罗小芳,褚路路,江玉姬,2,3,陈炳智,2,3,
(1.福建农林大学食品科学学院,福建 福州 350002;2.福建农林大学菌物研究中心,福建 福州 350002;3.农业农村部亚热带特色果蔬菌加工重点实验室(部省共建),福建 福州 350002)
酒精性肝病(alcoholic liver disease,ALD)是由于大量饮酒导致的中毒性肝损伤,其表现多样,初期通常表现为脂肪肝,进而可发展成酒精性肝炎、酒精性肝纤维化和酒精性肝硬化[1-3]。严重酗酒时可诱发广泛肝细胞坏死甚至肝功能衰竭[4]。全球肝病病因学研究显示,世界范围内有超过1.5亿 人的肝病是饮酒所导致,ALD的发病率在不断增加[5-6]。在中国,酒精引起的肝病也在逐年增加,是仅次于肝炎的第二大肝病,严重威胁到了人们的健康[7]。酒精是全球引发肝癌的主要因素,且随着酒精消费的增加,预计未来肝癌患者数量也会随之增加。
肝脏是人体最大的腺体,是解毒和代谢的重要器官[8],拥有体内最大的网状内皮细胞吞噬系统,可吞噬血液中各种病原菌及其他颗粒物质,具有免疫防御和免疫调节功能[9]。若出现代谢紊乱,会造成脂肪肝、酒精肝等多种肝疾病,同时会造成免疫系统和肠道菌群失调,影响肝细胞代谢和脂质氧化系统[10]。研究表明,乙醇在摄入机体后经过肝脏代谢生成乙醛,再被乙醛脱氢酶氧化生成乙酸,最后氧化成水和二氧化碳。但乙醛转化成乙酸的速度很慢,导致乙醛在体内堆积,从而破坏氧化还原平衡状态,造成肝脏氧化应激损伤[11-12]。现今市售保肝药物,如糖皮质类固醇、多烯磷脂酰胆碱和水飞蓟素等,绝大多数对人体有毒副作用[13-14]。因此,从药食同源植物中寻找有效预防酒精性肝损伤的功效成分,并将其开发为抗酒精性肝损伤的保健食品,是有效预防酒精性肝损伤的重要途径[15]。
肠道菌群是人体肠道的正常微生物,与人类共生[16]。近年来,肠道健康受到越来越多的关注。研究发现,肠道菌群在酒精性肝损伤、肝硬化和肝细胞坏死等疾病的发生过程中起重要作用[17-18]。机体长期摄入酒精后,酒精及其代谢物会使肠道菌群紊乱、通透性增加,造成肠道屏障功能障碍,影响机体的正常功能,加重ALD[19]。目前,利用肠道菌群DNA序列分析肠道菌群与酒精性肝损伤的关系已成为日益受到关注的研究方向。
草菇(Volvariella volvacea(Bull.) Singer)又名兰花菇[20],隶属光柄菇科(Pluteaceae)、小苞脚菇属(Volvariella),被誉为“素中之荤”[21]。草菇含有多肽、三萜、黄酮、甾醇类物质等多种活性物质[22]。生物活性肽是一种具强抗氧化性的多肽,可以抑制大分子的氧化应激反应[23]。研究表明,生物活性肽可以改善肝脏功能和乙醇代谢,具有抗炎护肝作用[24]。本实验以分子质量为1~3 kDa的草菇子实体多肽(Volvariella volvaceafruit body polypeptides,VVFP)为研究材料,建立小鼠急性ALD模型,通过血清和肝脏多项指标检测,结合肝组织病理切片分析,探究VVFP对急性ALD的预防作用;同时利用16S rDNA基因高通量测序分析各样品中微生物菌群的生物多样性以及门和属水平的相对丰度,探究VVFP对ALD模型小鼠肠道菌群结构的影响,从而为揭示VVFP对小鼠肝脏的保护作用机制提供参考。
1 材料与方法
1.1 动物、材料与试剂
ICR雄性小鼠(SPF级),3~4 周龄,体质量(25±2)g,动物生产许可证:SCXK(京)2019-0008,由吴氏小鼠动物有限责任公司提供。
动物饲料(含有玉米、豆粕、小麦麸、小麦次粉、鱼粉、大豆油、石粉、碳酸氢钙、盐、氮化胆碱、赖氨酸、多种维生素、多种矿物元素)由闽侯县吴氏实验动物贸易有限责任公司提供。
无水乙醇、冰乙酸、福尔马林(均为分析纯)国药集团化学试剂有限公司;联苯双酯滴丸 浙江医药有限公司;56°红星二锅头 北京红星股份有限公司;甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、乙醇脱氢酶(alcohol dehydrogenase,ADH)、丙二醛(malondialdehyde,M D A)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)测定试剂盒 南京建成生物工程研究所;E.Z.N.A.Stool DNA Kit试剂盒 美国Omega BioTek公司;NovaSeq 6000SP Reagent Kit、TruSeq Nano DNA LT Library Prep Kit 美国Illumina公司。
1.2 仪器与设备
Hannuo-192组织研磨仪 上海汉诺仪器有限公司;LGJ-12真空冷冻干燥机 北京松源华兴科技发展有限公司;UV-5100B紫外-可见分光光度计 上海元析仪器有限公司;SpectraMaxi3X多功能酶标仪 美国Molecular Devices公司;L-550台式离心机 湖南湘仪实验室仪器开发有限公司;BA210T显微镜 麦克奥迪实业集团有限公司;S1000聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;NovaSeq 6000高通量测序仪 美国Illumina公司;PacBio RS II分子测序仪 美国Pacific Biosciences公司。
1.3 方法
1.3.1 VVFP的制备
参照张芳艺等[25]的研究,草菇干品采用碱提酸沉的方法提取草菇蛋白,用碱性蛋白酶酶解草菇蛋白得到VVFP。经检测VVFP的8 种必需氨基酸(essential amino acid,EAA)含量占总氨基酸含量的41.71%,VVFP的EAA与非必须氨基酸的百分比为71.56%,符合联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)/世界卫生组织(World Health Organization,WHO)对优质蛋白质的要求。采用透析法进行分离纯化,获得分子质量为1~3 kDa的VVFP。冷冻干燥制得VVFP粉,置于干燥皿中保存,以进行小鼠体内实验。
1.3.2 小鼠分组
将72 只健康雄性小鼠随机分成6 组,分别命名为空白组(CK)、模型组(MK)、阳性对照组(P)、VVFP低剂量组(L-VVFP)、VVFP中剂量组(M-VVFP)、VVFP高剂量组(H-VVFP),每组12 只。
1.3.3 急性酒精肝损伤小鼠模型的建立
小鼠适应性喂养1 周后,开始灌胃处理,多肽组按不同剂量灌胃等体积多肽溶液(100、200、400 mg/kgmb),阳性对照组将联苯双酯滴丸溶于蒸馏水灌胃(200 mg/kgmb),其余各组灌胃等体积的蒸馏水(10 mL/kgmb)。每5 d称质量,每只小鼠根据体质量调整剂量,连续灌胃30 d。末次给药处理后,间隔5 h,除了空白组外,都给予灌胃12 mL/kgmb红星二锅头,建立急性ALD模型。建模时间为12 h,禁食不禁水,眼球取血,离心取上清液,再颈椎脱臼处死后解剖,迅速取出肝脏、盲肠置于液氮内,并存放在-80 ℃冰箱,用于后续指标测定。
1.3.4 血清肝功能和血清炎症因子指标检测
小鼠血清中肝功能指标(TG、TC、ALT和AST)和血清炎症因子(TNF-α和IL-6)的测定分别按照对应试剂盒说明方法进行。
1.3.5 肝功能过氧化指标检测
快速称取0.1 g肝脏,按1∶9体积比添加0.9%生理盐水,并在冰水浴中将其完全研磨,匀浆结束后离心吸取上清液(4 ℃、5000 r/min,10 min)。根据试剂盒说明测定小鼠肝脏中ADH、MDA、T-SOD和GSH-PX的水平。
1.3.6 肝组织病理切片染色分析
将肝脏组织用10%福尔马林溶液固定24 h以上,置于脱水盒中,用70%~100%乙醇溶液进行脱水处理,然后用二甲苯洗脱、石蜡包埋、切片。最后,用苏木精和伊红染色肝组织切片、封片,进行显微结构观察。
1.3.7 16S rDNA测序鉴定小鼠肠道菌群及功能分析
盲肠委托北京奥维森有限公司进行16S rDNA测序,使用Qiime和SPSS Statistics 25.0软件对测序数据进行分析处理,使用Mothur软件计算α多样性,使用R语言软件绘制物种累积图和α多样性指数箱形图。对不同组的肠道菌群进行门和属水平分析,通过LEfSe(linear discriminant analysis effect size)分析,找出具有显著差异的物种。
1.4 数据统计与分析
2 结果与分析
2.1 VVFP对小鼠体质量的影响
由表1可知,实验期间空白组、模型组、阳性对照组以及不同剂量VVFP组的小鼠体质量均无显著差异(P>0.05)。实验中小鼠毛色光亮,大小便正常,未出现食欲不振、消瘦等症状,说明本实验所用的联苯双酯滴丸和VVFP对小鼠无毒害作用。

表1 VVFP对小鼠体质量的影响Table 1 Effect of VVFP on body mass of mice g
2.2 VVFP对肝损伤小鼠血清TG、TC浓度及ALT、AST活性的影响
小鼠血清TG、TC含量及ALT、AST活性都是反映肝损伤情况的重要指标,当肝细胞损伤时,这些指标在血清中的含量会异常升高。如图1所示,与空白组相比,模型组小鼠血清的TG、TC浓度及ALT、AST活性均极显著升高(P<0.01),说明建模成功。灌胃大量酒精后,小鼠体内的代谢平衡被破坏,上述物质大量进入血液中使得血液中的含量升高。与模型组相比,阳性对照组以及不同剂量VVFP组小鼠血清的TG、TC浓度及ALT、AST活性均极显著降低(P<0.01),说明VVFP可以缓解酒精引起的代谢平衡。
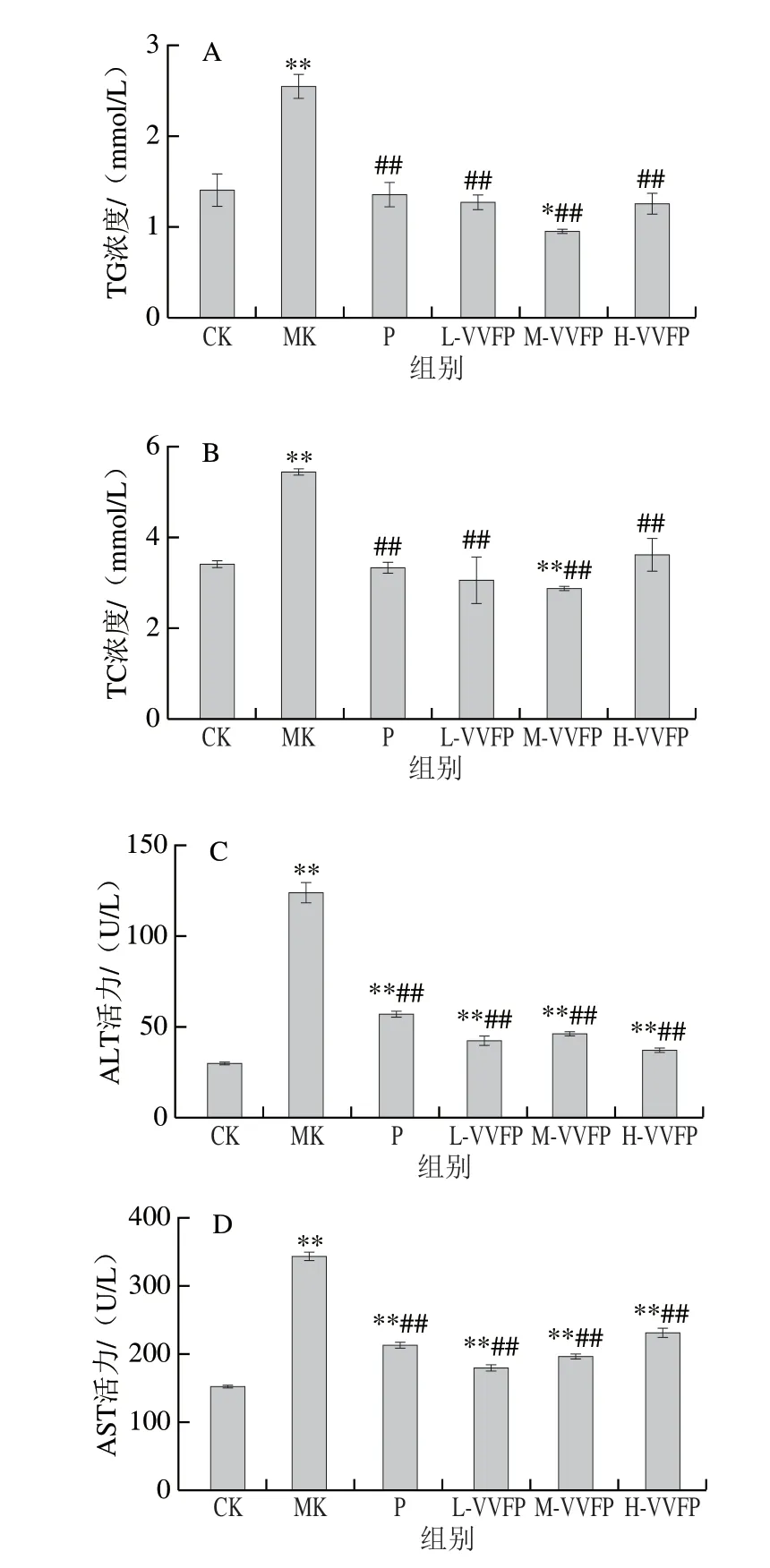
图1 VVFP对肝损伤小鼠血清TG、TC含量及ALT、AST活性的影响Fig.1 Effect of VVFP on serum TG,TC,ALT and AST levels in mice with liver injury
2.3 VVFP对肝损伤小鼠炎症因子TNF-α和IL-6的影响
通过测定血清中炎症因子的水平可确认VVFP是否具有保肝作用。如图2所示,与空白组相比,模型组的小鼠血清炎症因子TNF-α和IL-6水平均极显著升高(P<0.01),说明酒精肝损伤会引发小鼠肝脏炎症反应。与模型组相比,阳性对照组以及不同剂量VVFP组小鼠血清炎症因子TNF-α和IL-6水平均极显著降低(P<0.01),说明VVFP可以改善肝细胞的损伤程度。

图2 VVFP对肝损伤小鼠炎症因子TNF-α和IL-6的影响Fig.2 Effect of VVFP on TNF-α and IL-6 levels in mice with liver injury
2.4 VVFP对肝损伤小鼠肝脏ADH、MDA、T-SOD及GSH-PX水平的影响
如图3所示,与空白组相比,模型组小鼠肝脏组织的ADH、T-SOD活力及GSH-PX含量极显著降低(P<0.01),MDA含量极显著升高(P<0.01)。与模型组相比,VVFP处理组肝脏组织的ADH、T-SOD活力及GSH-PX含量均显著升高,说明VVFP可以通过提高ADH、T-SOD活力及GSH-PX含量修复受损的肝脏。与模型组相比,VVFP处理组的肝脏组织的MDA含量极显著降低,说明VVFP可以缓解脂质过氧化。以上结果进一步说明VVFP可以减轻酒精引起的肝损伤。

图3 VVFP对肝损伤小鼠肝脏ADH、MDA、T-SOD及GSH-PX水平的影响Fig.3 Effect of VVFP on liver ADH,MDA,GSH-PX and T-SOD levels in mice with liver injury
2.5 VVFP对小鼠肝组织病理切片的影响
对小鼠肝组织病理切片和苏木精-伊红染色观察,结果如图4所示。空白组小鼠肝小叶及细胞核结构清晰,肝窦无明显充血,无显著病变状况(图4A);模型组小鼠肝小叶及细胞核结构被破坏,排列紊乱,出现水肿现象(图4B),这与Parikh等[26]描述的肝损伤时出现的症状相似,具有典型的病理特征,表明急性ALD建模成功。给药后,与模型组相比,多肽低剂量组(图4D)和高剂量组(图4F)在不同程度上有所改善,肝小叶及细胞核结构较清晰、肿胀范围减小,肝细胞排列紊乱现象减轻;阳性对照组(图4C)和多肽中剂量组(图4E)肝细胞形态趋于正常,排列整齐,呈放射状分布,细胞损伤状况明显改善。肝组织病理学分析结果进一步证实VVFP对ALD小鼠肝脏细胞损伤有明显的改善作用。


图4 VVFP对小鼠肝组织病理切片的影响(×100)Fig.4 Effect of VVFP on histopathological sections of liver tissues in mice (× 100)
2.6 小鼠肠道菌群有效数据统计
对小鼠盲肠内容物肠道菌群测序进行数据分析,有效数据统计结果如表2所示。样本的平均有效数据率为98.44%,说明肠道菌群测序的数据可靠,满足后续分析要求。
2.7 小鼠肠道菌群α多样性分析
α多样性是通过单样品的多样性分析反映物种的丰度及多样性。为了探究VVFP对ALD小鼠肠道菌群结构和组成的差异,通过Chao1、Observed_species、Shannon以及Simpson 4 个指标分析6 组之间的物种多样性差异。
由图5可知,模型组的Chao1和Observed_species指数均高于其他组,说明小鼠在短时间内大量饮酒会造成肠道菌群紊乱。在中剂量VVFP的干预下,ALD小鼠盲肠菌群丰度降低,更接近于正常水平,改善了ALD小鼠的肠道紊乱;模型组的Shannon指数均低于其他组,说明模型组的物种均匀度较低,在中剂量VVFP的干预下,ALD小鼠盲肠菌群的均匀度提高。由上述结果可知,VVFP的干预能够改善因酒精影响而发生变化的肠道菌群多样性。

图5 肠道菌群α多样性指数箱形图Fig.5 α-Diversity indexes of intestinal microbiota
2.8 小鼠肠道菌群物种组成分析
如图6所示,按门水平分类,小鼠肠道菌群主要由拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)和脱硫弧菌门(Desulfobacterota)组成。空白组的肠道菌群中拟杆菌门占50.83%,厚壁菌门占34.19%,脱硫弧菌门占7.34%;模型组肠道菌群中拟杆菌门占71.98%,厚壁菌门占21.24%,脱硫弧菌门占2.56%。与空白组相比,模型组的拟杆菌门菌群丰度上升,厚壁菌门和脱硫弧菌门的菌群丰度下降,说明小鼠经过酒精灌胃后,造成了肠道紊乱,与正常小鼠的差异较大。与模型组相比,阳性对照组与中剂量组的拟杆菌门菌群丰度下降,分别达到51.54%和57.26%;厚壁菌门的菌群丰度上升,分别为38.63%和31.73%,均接近正常的小鼠,说明中剂量的VVFP可以达到联苯双酯滴丸的干预效果,有效缓解ALD导致的肠道菌群紊乱。

图6 门水平上微生物菌群的变化Fig.6 Changes in intestinal microbiota composition at the phylum level
小鼠肠道菌群在属水平上主要由链霉菌属(Streptomyces)、乳酸杆菌属(Lactobacillus)和弧菌属(Vibrio)组成(图7)。空白组、模型组、阳性对照组、低剂量组、中剂量组和高剂量组链霉菌属占比分别为26.88%、40.81%、20.54%、23.90%、27.69%和23.46%;乳酸杆菌属占比分别为22.39%、12.60%、28.02%、14.33%、14.50%和15.55%;弧菌属占比分别为15.29%、13.14%、20.28%、21.93%、16.75%和12.89%;与空白组相比,模型组链霉菌属菌群丰度上升,乳酸杆菌属和弧菌属菌群丰度下降,说明模型组小鼠的肠道菌群失调。经过中剂量VVFP的干预后,与模型组相比,链霉菌属的菌群丰度下降,与空白组接近;乳酸杆菌属和弧菌属的菌群丰度在一定程度上有所上升,说明VVFP对患有急性ALD小鼠的肠道菌群有一定的调节功效。

图7 属水平上微生物菌群的变化Fig.7 Changes in intestinal microbiota composition at the genus level
2.9 小鼠肠道菌群LEfSe分析
LEfSe分析是一种通过多个分组之间的比较,从而找到组间在丰度上有显著差异物种的方式,图8展示了LDA score大于设定值3的差异菌属,空白组中,有20 个差异菌种对菌群结构影响较大,主要是脱硫弧菌属(Desulfovibrio)、脱疏弧菌科(Desulfovibrionaceae)、脱氧球菌纲(Desulfovibrionia)、脱硫弧菌目(Desulfovibrionales)和脱硫杆菌门(Desulfobacterota)等;模型组中主要是木杆菌科(Muribaculaceae)、拟杆菌门(Bacteroidota)和拟杆菌纲(Bacteroidia)等5 个差异菌种对菌群结构影响较大;在阳性对照组中,理研菌科(Rikenellaceae)对菌群结构影响最大,其次还有另枝菌属(Alistipes)等11 个差异菌种具有影响;颤螺旋菌科(Oscillospiraceae)和普雷沃氏菌属(Prevotellaceae_NK3B31_group)是低剂量组中的重要菌种;中剂量组中变形菌纲(Gammaproteobacteria)是最显著的差异菌种,其次是肠杆菌科(Enterobacteriaceae)、大肠杆菌种(Escherichia_coli)和埃希氏菌-志贺氏菌属(E._Shigella)等21 个差异菌种;高剂量组中主要有拟杆菌属(Bacteroides)和类杆菌科(Bacteroidaceae)等11 个差异菌种对菌群结构影响较大。可以看出,在中剂量VVFP的干预下,小鼠肠道菌群的差异性相比于模型组明显增加,基本恢复至空白组水平,表明VVFP在一定程度上可以修复酒精对肠道的损伤。

图8 不同处理组菌群差异LEfSe分析柱状图Fig.8 LEfSe analysis of differential intestinal microbiota among different treatment groups
3 讨论
现代医学对ALD发病机制的研究已取得较大进步,脂质代谢异常、氧化应激、炎症反应等被公认为ALD的重要影响因素[27]。ALD在代谢过程中引起的直接或间接的氧化应激、脂质过氧化作用以及多种因素(如肠道菌群失调)相互作用导致的肠道通透性增加[28-29],对肠道黏膜造成损伤,影响肠道菌群数量,引起细菌和细菌内毒素的位移(经过肠道组织到达肝脏),最终导致肝脏炎症。虽然通过服用药物可以起到治疗效果,但其毒副作用较大。大量的研究表明,食用菌肽具有丰富的药理价值,对肝损伤有很好的保护和缓解功效,但对于VVFP的研究仍存在较多的空白。本研究以56°红星二锅头灌胃小鼠建立急性ALD模型,探究VVFP对ALD的预防作用。结果显示,模型组、阳性对照组以及不同剂量VVFP组小鼠与空白组小鼠体质量均无显著性差异,说明VVFP无毒副作用。
肝脏是人体中唯一一个没有痛感神经的器官,极易受有毒化学物质损伤,造成肝脏代谢功能紊乱[2]。在酒精代谢刺激下,肝脏出现氧化应激反应,肝细胞受损。ALT、AST水平是反映肝细胞损伤最直接和最敏感的指标,Dong Qingqing等[30]发现在健康肝脏中ALT、AST很高,而血液中含量很低,一旦肝脏细胞受损,大量ALT和AST会释放到血清中使血清中含量升高,ALT与AST的水平在一定范围内反映机体肝细胞的损伤程度。Reddy等[31]通过研究指出,当肝脏脂肪代谢出现能力出现障碍时,血清中TC和TG两种代谢物含量会升高。湛莉等[32]认为,当肝脏受损时,会分泌大量的炎性细胞因子,尤其是TNF-α、IL-6,二者水平能反映肝细胞炎症程度。本研究结果显示,VVPF能极显著降低血清中TG、TC、ALT和AST水平(P<0.01),并能降低TNF-α、IL-6炎症因子水平,说明VVFP可以减缓酒精引起的代谢紊乱。
在大量酒精的干预下,肝脏中脂肪酸的合成和代谢失去稳态平衡[33]。ADH、MDA、T-SOD和GSH-PX水平能够较好地反映肝脏氧化程度[34]。韩光顺等[35]探究茴香提取液对小鼠酒精性肝损伤的保护作用时发现,ADH活力能灵敏地提示肝细胞的损伤及损伤的程度;MDA含量可反映出机体脂质氧化水平,间接表明肝细胞的损伤程度[36];Forrester等[37]研究发现T-SOD能够清除过氧化产生的自由基从而调节代谢平衡;GSH-PX作为体内重要的抗氧化剂,可以清除活性氧[38]。本研究结果显示,与模型组相比,VVFP能够极显著降低MDA含量(P<0.01),明显提高肝脏中ADH、T-SOD和GSH-PX水平,证实VVFP可以减轻酒精引起的肝损伤,提高人体防御系统的抗氧化活性,从而防止慢性酒精中毒对肝脏的损害。肝组织病理切片也进一步证实了VVFP的保肝活性。
基于16S rDNA高通量测序分析VVFP对ALD小鼠肠道菌群的影响。在VVFP的干预下,门水平上拟杆菌门菌群丰度下降,厚壁菌门的菌群丰度上升,这与韩琳[39]的研究结果一致。Li Koukou等[40]通过高通量测序分析发现,灵芝多糖S3降低了拟杆菌门的相对丰度,提升了厚壁菌门的相对丰度,显著减轻了小鼠胰腺炎症状;在属水平,VVFP降低了链霉菌属的菌群丰度,增加了乳酸杆菌属和弧菌属的菌群丰度。乳酸杆菌是人体肠道内重要的益生菌,不仅可以分解代谢肠道内的益生元,还能维持免疫平衡,增强肠道屏障。范颖等[41]研究了大蒜多糖对ALD小鼠肠道菌群失调的影响,结果表明大蒜多糖组的多样性指数和均匀度指数最高,优杆菌属和乳酸杆菌属细菌增多。上述结果表明,VVFP能够改善ALD小鼠肠道菌群。
综上所述,VVFP能极显著降低血清中TG、TC、ALT、AST和肝脏中MDA水平,并且降低TNF-α与IL-6炎症因子水平,同时明显提高肝脏中ADH、T-SOD和GSHPX水平。此外,VVFP可通过调节拟杆菌门、厚壁菌门、链霉菌属乳酸杆菌属和弧菌属的丰度减轻小鼠肝脏的损伤程度。本研究结果可为多肽在功能食品领域的应用提供药效基础。

