肥胖与非肥胖PCOS患者的肠道微生物群结构及代谢功能的关系
徐腊梅, 高洁, 李英, 刘立栋
1中国人民解放军空军第九八六医院内分泌科(陕西西安 710054); 2西安市工会医院内分泌科(陕西西安 710199)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)以持续无排卵、高雄激素血症和胰岛素抵抗为特征,涉及一组生殖、内分泌和代谢疾病[1]。PCOS的临床表现高度异质,肥胖是PCOS患者常见的临床表型[2]。肥胖患者过多的脂肪储存会增加血液中的胰岛素浓度并触发和加重胰岛素抵抗,促进PCOS的发展[3]。近年来,肠道菌群与PCOS之间的相互关系越来越受到关注。Lindheim等[4]发现,与健康女性相比,PCOS患者肠道中来自Tenericutes门的ML615J-28和124-7的丰度相当低。根据Mammadova等[5]说法,PCOS患者肠道中埃希菌/志贺菌的比例和链球菌的丰度增加,而阿克曼菌和瘤胃球菌科的丰度降低。尽管这些研究揭示PCOS患者肠道菌群多样性与高雄激素血症密切相关,他们没有进一步研究PCOS患者肥胖与肠道菌群的相关性,也没有发现任何与PCOS发病密切相关的特定属。因此,本研究的目的是调查肥胖、非肥胖PCOS女性和健康女性的肠道菌群组成,揭示肠道菌群特征及代谢功能。
1 资料与方法
1.1 一般资料 共招募了2020年6月至2022年6月在本院妇科就诊的28例16~35岁的PCOS女性。这些PCOS患者包括16例肥胖女性(BMI≥28 kg/m2,肥胖PCOS组)和12例非肥胖女性(BMI为18.5~23.9 kg/m2,非肥胖PCOS组)。本研究中的PCOS诊断基于2003年荷兰会议修订的鹿特丹标准[4]。此外,选择本院体检科14例健康年轻女性(BMI 18.5~23.9 kg/m2)作为非肥胖正常组,以及6例健康但肥胖女性(BMI≥28 kg/m2)作为肥胖正常组。排除具有以下情况之一的个体:怀孕、吸烟、肿瘤、慢性腹泻、自身免疫性疾病、胃肠手术史和其他内分泌疾病。没有人接受口服避孕药、抗雄激素、胰岛素增敏剂、抗生素和益生菌治疗。正常组的女性没有月经不调、不孕症、内分泌疾病或根据鹿特丹标准诊断为PCOS的病史。所有参与者均知情同意。本研究经我院伦理委员会批准[审查批号:2020第(08)号]。
1.2 采样 本次研究的所有受试者均需完成以下项目:(1)人体测量指标,包括身高、体重、腰围和臀围,以及体毛(对全身9个部位进行评分,每个部位0~4分,9个部位得分综合≥8为多毛症)和痤疮(分为4个等级:一级症状较轻,数量<30个;二级数量在30~50之间;三级数量在50~100之间;四级数量>100)评分;(2)在月经周期的第3天检测生化指标,如性激素水平,包括黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle-stimulating hormone,FSH)、睾酮、雌二醇(E2)和脱氢表雄酮,以及口服葡萄糖耐量试验期间的葡萄糖和胰岛素水平;(3)粪便样本的采集说明如下:在非月经期间从每个参与者收集3~5 g新鲜粪便,并在2 h内转移到实验室的冰盒中。然后将每个粪便样本分别装入4个EP管中,并在-80 ℃下冷冻直至使用。
1.3 DNA提取和PCR扩增 使用EZNA®土壤DNA试剂盒(美国Omega Bio-tek公司)获得肠道微生物群的总DNA。使用NanoDrop2000分析提取的DNA的浓度和纯度。DNA提取质量通过1%琼脂糖凝胶电泳检测。使用338F(5′-ACTCCTAC-GGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物通过PCR扩增细菌16S rDNA的V3-V4可变区。使用ABI GeneAmp® 9700进行扩增,设置如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,延伸72 ℃ 30 s)并在72 ℃延伸10 min。扩增混合物体积为20 μL,包括4 μL 5×FastPfu缓冲液、2 μL 2.5 mmol/L dNTPs、0.8 μL引物(5 μmol/L)、0.4 μL FastPfu聚合酶和10 ng DNA模板。
1.4 Illumina MiSeq测序 使用2%琼脂糖凝胶收集PCR扩增产物,并使用AxyPrep DNA凝胶提取试剂盒(美国Axygen Biosciences公司)纯化。纯化产物用2%琼脂糖电泳检测,然后使用 QuantiFluorTM-ST(美国Promega公司)进行定量检测。根据Illumina MiSeq平台(美国Illumina公司)的标准操作方案,将纯化的扩增片段构建到PE 2*300的文库中。构造文库步骤如下:(1)连接“Y”形接头;(2)使用磁珠去除自连接片段;(3)通过PCR扩增富集文库模板;(4)氢氧化钠变性后产生ssDNA片段。测序过程在Illumina的Miseq PE300平台上进行。
1.5 测序方法 原始序列由Trimmomatic软件进行质量控制,并通过FLASH软件进行拼接。具体流程如下:(1)reads结束时20个以下的碱基被过滤,并设置50 bp的窗口。如果窗口中的平均质量<20,我们从窗口中截断后端碱基。质控后过滤低于50 bp的reads,去除含有N碱基的reads;(2)根据测序数据之间的重叠关系,将paired reads拼接成重叠长度最小为10 bp的序列;(3)拼接序列重叠区最大允许错配率为0.2,筛选出错配序列;(4)利用序列两端的barcode和引物区分样本,调整序列方向。条形码和引物的允许和最大错配数分别为0和2。然后使用Qiime平台的Usearch软件(7.0版,http://drive5.com/uparse/),并根据97%的相似性对序列进行聚类。使用 RDP分类器(http://rdp.cme.msu.edu/)对聚类后的代表性序列进行注释和聚类,并在70%的比较阈值下与Silva数据库(SSU128/16s细菌)进行比较。
1.6 靶向代谢学分析 在患者就诊时,将血液抽入含有柠檬酸钠作为抗凝剂的CPT管中,至少禁食8 h。将试管在室温下轻轻倒置8次,并在抽血后6 h内以1 500g离心20 min。血浆等分试样储存在-80 ℃。使用AbsoluteIDQ p180试剂盒(澳大利亚BIOCRATES Life Sciences AG公司)对储存的冷冻血浆样本进行靶向代谢学分析。这种靶向方法同时使用液相色谱法和流动注射分析-质谱法测量12种代谢物,包括犬尿氨酸/色氨酸、ADMA、脯氨酸、丙氨酸、异亮氨酸、亮氨酸、缬氨酸、戊酰基肉碱、十八烷二烯酰肉碱和3种甘油磷脂(PC ae C34:3、PC ae C36:5、PC ae C38:5),详细的测定程序已在之前文献[6]中描述过。
2 结果
2.1 肥胖和非肥胖PCOS女性的临床和激素变量 与非肥胖正常组相比,非肥胖PCOS组中多毛症评分、痤疮评分、LH、LH/FSH、睾酮、E2和脱氢表雄酮显著增加(P<0.05)。与肥胖正常组相比,肥胖PCOS组中多毛症评分、LH/FSH和睾酮显著升高(P<0.05),FSH显著降低(P<0.05),见表1。
表1 参与者的临床和生化特征
2.2 微生物多样性和组成的比较 在对7 500个计数进行稀疏后,共发现了1 084个操作分类单位(OTU),其相似性截止为97%。在门水平上,在所有参与者中发现了厚壁菌门、拟杆菌门、放线菌门和梭杆菌门,微生物丰度中位数分别为52%、35%、2.9%和0.8%(图1)。在属水平上,鉴定出147个属的中位相对丰度为0.43%(IQR=0.1-0.88%),91个属的平均相对丰度至少为0.1%。通过主坐标分析(PCoA)将样本群体的微生物群分布与属水平的Bray-Curtis差异进行了协调。图2A中的第一个和第二个主坐标图解释了总方差的15.2%和8.7%,显示没有肥胖状态或PCOS状态的分离。每个测量的样本内微生物多样性(观察到的OTU丰富度、属水平的Chao 1指数和香农指数)没有显著差异(图2B-D)。
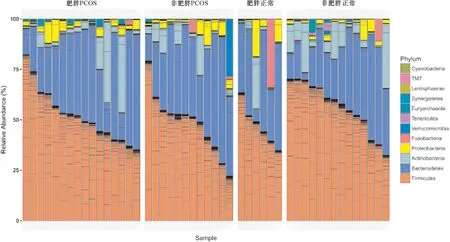
图1 PCOS和正常的微生物组成比较
2.3 肥胖差异丰富的属 表2显示,差异丰度分析确定了与肥胖状态显著相关的4个属(Finegoldia、Anaerococcus、Sneathia和Adlercreutzia)(P<0.05)。与没有肥胖的女性相比,Finegoldia、Anaerococcus、Sneathia、Adlercreutzia在肥胖女性中的丰度显著较低(P<0.05)(图3)。在按PCOS状态分层的分析中(表2),Finegoldia和Anaerococcus在PCOS和非PCOS女性中均与肥胖呈显著负相关,而PCOS和肥胖与Sneathia和Adlercreutzia之间存在暗示性但不显著的相互作用(分别为PPCOS×肥胖= 0.090、0.057)。
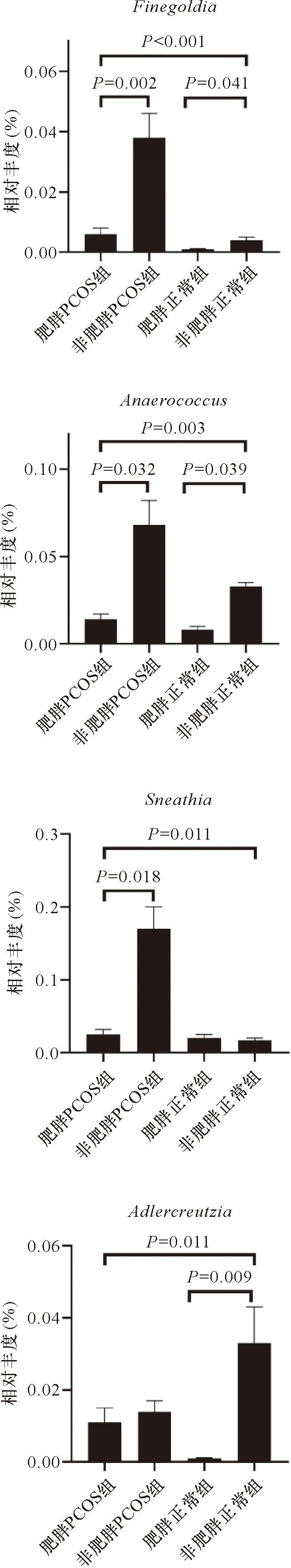
图3 4种细菌属(Finegoldia、Anaerococcus、Sneathia、Adlercreutzia)的相对丰度

表2 肥胖状态差异丰富的属
2.4 代谢物与肥胖和细菌属的关联 为了进一步研究代谢物和肠道微生物组与肥胖的关系,我们检查了4种与肥胖相关的肠道微生物属与12种代谢物之间的相关性(图4)。Anaerococcus与犬尿氨酸/色氨酸比率和缬氨酸呈负相关(r=-0.38、-0.32,P=0.007、0.041),而Adlercreutzia与脯氨酸和丙氨酸呈负相关(r=-0.37、-0.32,P=0.012、0.034)。另一方面,所有4种与肥胖相关的微生物属都与肥胖相关的甘油磷脂呈正相关(所有3种甘油磷脂的r=0.12-0.36,r=0.29-0.36,P>0.05)。
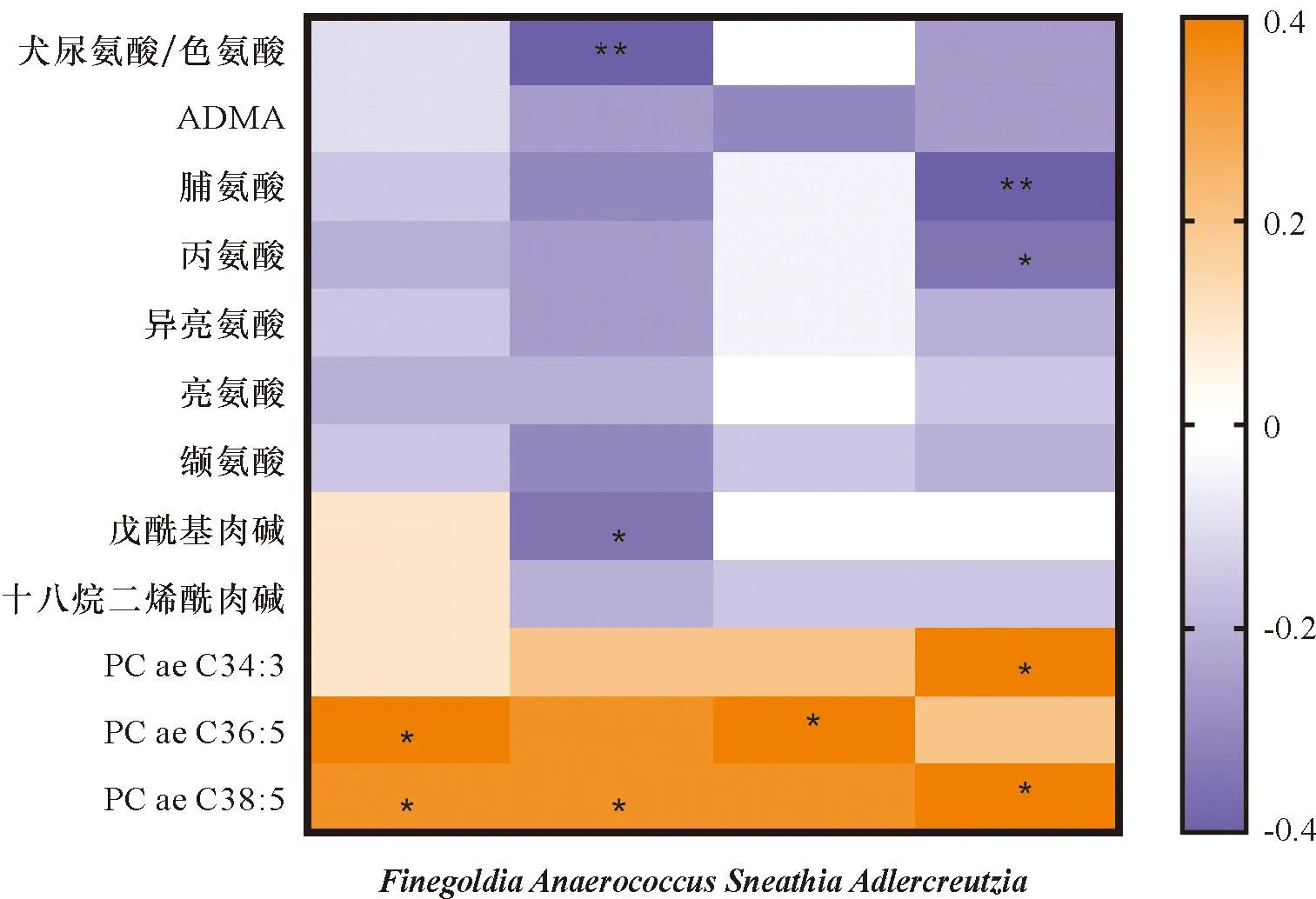
注:*P<0.05,**P<0.01图4 肥胖相关微生物属与肥胖相关代谢物之间的Spearman相关性
3 讨论
在本研究中,我们揭示了肥胖和非肥胖PCOS女性的临床表现差异、血清激素水平和特征性肠道菌群。肥胖和非肥胖PCOS患者多毛评分、LH/FSH和血清睾酮水平显著高于正常组。此外,我们发现肥胖与非肥胖的女性之间微生物群落的组成和多样性没有显著差异。这些发现与大多数先前研究在正常人群中检查肠道微生物群与肥胖之间的关系的研究[7-8]基本一致。然而,在检查PCOS与微生物多样性的关系时,本研究没有发现显著的关联,而之前的许多研究发现PCOS的这种差异有统计学意义,这可能与本研究纳入的样本量少有关[9]。
在属水平上,我们发现,与没有肥胖的女性相比,肥胖女性中两个属(Finegoldia和Anaerococcus)的相对丰度显著降低,并且PCOS患者和非PCOS患者的结果是一致的。早期微生物组研究确定了肥胖与人类肠道微生物组之间的联系[10-11]。这些研究表明,肥胖小鼠和人类中Finegoldia的比例均降低。已知Anaerococcus菌会产生丁酸盐,这是一种细菌发酵的产物,参与抗炎、提高胰岛素敏感性和改善肥胖[12]。此外,本研究中Anaerococcus与犬尿氨酸/色氨酸比率和缬氨酸呈负相关。犬尿氨酸/色氨酸比率和缬氨酸曾被报道与PCOS人群中的肥胖有关。此外,色氨酸通过吲哚胺2,3-双加氧酶分解代谢成犬尿氨酸,以响应炎症和免疫激活[13]。因此,我们的结果进一步支持了Anaerococcus菌在抗炎中的潜在参与。
此外,另外两个属Sneathia和Adlercreutzia在本研究中显示出与肥胖的暗示性负相关,并可能因PCOS而改变效果。值得注意的是,非肥胖PCOS组显示出显著较高的Sneathia相对丰度,而其他3个PCOS/肥胖状态组显示该属的相对丰度较低且相似。这可能有助于说明为什么仅在PCOS人群中观察到Sneathia与肥胖之间的负相关。Sneathia属是阴道分娩过程中母体微生物组向新生儿自然传播中的可能与1型肥胖、哮喘和肥胖有关的细菌之一[14]。然而,以前没有研究检查过PCOS与Sneathia之间的关系。本研究表明,在正常个体中,Adlercreutzia属与肥胖之间存在负相关,而之前的一项研究报告称,与健康对照组和PCOS患者相比,肥胖PCOS患者的粪便样本中Adlercreutzia属减少[15]。尽管PCOS的潜在影响改变需要进一步研究,但Adlercreutzia与肥胖之间的暗示性关联得到了该属与本研究中观察到的血浆脯氨酸之间的负相关性以及该属可能参与过氧化物酶体增殖物激活受体γ(PPAR-γ)途径的支持[16]。然而,由于样本量相对较小,我们的结果应该谨慎解释。未来需要更大样本量的研究来阐明这些属与PCOS背景下的肥胖之间的关联。
总之,本研究表明,在PCOS女性中,4种肠道微生物属的相对丰度和与肥胖相关的相关代谢物变化降低。已知产生丁酸盐的细菌属在肥胖中具有较低的相对丰度,这与较高的色氨酸分解代谢相关。这些发现表明肠道菌群、肥胖和PCOS之间存在潜在的相互关系。然而,由于本研究样本量较小,并且本研究没有收集与微生物群落密切相关的膳食摄入信息。因此,需要进一步研究更大样本量和宏基因组学数据,以研究特定微生物及其在肥胖中的功能作用以及PCOS背景下的代谢特征。
利益相关声明:本文所有作者声明不存在任何利益冲突,本文中所有研究结果未在任何杂志发表过。
作者贡献说明:徐腊梅负责了论文的全部撰写和进行研究设计;高洁、李英负责实施了论文中病例收集、数据统计等;刘立栋在论文撰写修改、讨论以及研究设计中都有巨大贡献。

