基于JAK2/STAT3/SOCS1 信号通路探讨电针不同腧穴对急性结肠炎大鼠的作用机制
张春青,唐坤鹏,闫丽萍,文 坛,王海军
(山西中医药大学,山西 晋中 030619)
炎症性肠病(inflammatory bowel disease,IBD)是一种以肠道炎症反复发作为特征的衰弱性疾病[1],临床中可分为急性发病和慢性缓解两个时期,治愈难度较大[2]。尤其是在急性期会产生大量的促炎因子,在持续无菌性炎症反应的刺激下,加速向克罗恩病(crohn,s disease,CD)和溃疡性结肠炎(ul‑cerative colitis,UC)转化[3]。近年来其发病率在我国迅速上升[4],目前,西医对急性结肠炎的治疗较为局限,多以激素类、免疫抑制剂等为主[5],但停药后病情容易反复,长时间服用会造成药物依赖性,同时也会出现不同程度的不良反应[6,7]。因此,有效抑制炎症细胞的浸润,改善炎症微环境,有助于减轻急性结肠炎的发生发展。
酪氨酸蛋白激酶2(janus kinase 2,JAK2)/信号转导及转录激活因子3(signal transducer and activa‑tor of transcription 3,STAT3)/细胞因子信号抑制物1(suppressor of cytokine signaling 1,SOCS1)信号通路属于经典的炎性反应信号通路,可通过激活下游促炎细胞因子,产生炎性级联反应及致使结肠黏膜损伤[8,9]。课题组前期研究发现,电针“天枢”、“大肠俞”、“足三里”、“上巨虚”穴治疗慢性期结肠炎的疗效显著,且上巨虚穴效最优[10]。因此,本课题在前期研究的基础上,拟以结肠炎的急性期为研究对象,通过检测JAK2/STAT3/SOCS1 信号通路相关的蛋白含量表达及大鼠血清中白介素的含量,探讨电针不同腧穴对急性结肠炎的作用机制,选出最优穴,为临床治疗上提供组方依据。
1 材料与方法
1.1 实验动物与分组
SPF 级SD 大鼠36 只,雌雄各18 只,体质量(180±20)g,于北京斯贝福生物技术有限公司购买,许可证号[SCXK(京)2019‑0010]。所有大鼠自由饮食,自然光照,动物房温度(23±2)℃、湿度(50±5)%,适应性喂养1 周。大鼠按随机数字表分为6 组,正常组、模型组、天枢组、大肠俞组、足三里组、上巨虚组,每组6 只。实验已通过山西中医药大学动物伦理委员会审查(伦理审批号:2021 DW211)。
1.2 试剂和仪器
主要试剂:BCA 蛋白浓度测定试剂盒(AB0146,武汉BOSTER 工程有限公司);蛋白酶抑制剂cocktail(HY‑K0010,美国MCE 生物科技公司);IL‑4、IL‑8 试剂盒(MM‑0191R1、MM‑0175R1,山西仁安生物科技有限公司);JAK2 抗体、STAT3抗体、SOCS1 抗体、羊抗兔 IgG‑HRP(AF1489、AF1492、AF8022、AS014,武汉BOSTER 工程有限公司);飞克特超敏ECL 发光液(MA0186,大连美仑)。
主要仪器:电泳仪(DYY‑6D,北京六一);高速冷冻离心机(3K15,曦玛离心机有限公司);酶标仪(2108251C,美国BioTek);Tanon5200 化学发光成像仪(Tanon‑5200 Multi,美国BioTek 公司);脱色摇床(DS‑2H200,武汉Servicebio 生物科技有限公司);石蜡包埋机(YB‑6LF,湖北省亚光医用电子技术有限公司)。
1.3 模型制备
参考课题组前期造模的方法[11],急性结肠炎大鼠模型采用6%的冰乙酸溶液灌肠进行制备。造模时,除正常组之外,其余各组将涂抹有石蜡油的聚氯乙烯管从大鼠的肛门处缓慢插入至肛门内8 cm处,将1 mL 的6%冰乙酸溶液缓慢的推入,15 s 后抽取5 mL 的生理盐水对其进行冲洗,在此过程中各组大鼠均不需要麻醉。正常组用生理盐水替换6%冰乙酸溶液,余处理不变。
1.4 穴位选取及干预治疗
腧穴具体定位参照《实验针灸学》[12]选取“天枢”、“大肠俞”、“足三里”、“上巨虚”作为电针双侧穴位。
造模后,选用无菌毫针、华佗牌SDZ‑Ⅱ型电子针疗仪给予各腧穴(双侧)电针刺激,频率为2~50 Hz,强度2 mA,20 min/次,1 次/d,连续3 d。其中正常组和模型组于同时间段仅固定不针刺。
末次治疗结束后,各组大鼠禁食、不禁水,12 h后进行麻醉、取血,在4 ℃环境下进行离心,收集上清液,置于−20 ℃冰箱保存待检。将截取的大鼠结肠组织(肛门及以上12 cm)置于无菌冻存管中,随后立即放入−80 ℃冰箱进行保存,待其检测。
1.5 观察指标及检测方法
(1)观察大鼠一般情况:各组大鼠的毛色光亮如何、反应是否灵敏度、是否活跃、精神是否萎靡及体质量是否下降等进行密切观察。
(2)HE 染色法观察结肠组织粘膜变化:取结肠组织(约为2 mm×2 mm×2 mm)用于HE 染色,之后将结肠组织开始进行固定、脱水、透明等,制成蜡块。蜡块切片厚约5 μm,脱蜡,脱水,浸泡,分化,洗涤等。然后滴加伊红染液,随后清洗、封片。于光学显微镜(200×)下采集图像。
(3)ELISA 法检测血清IL‑4、IL‑8 的含量:将收集好的上清液取出,冰上进行解冻。以ELISA 试剂盒的解释说明为指导进行操作,对大鼠血清中IL‑4和IL‑8 的含量进行检测。
(4)Western blot 检测结肠组织中蛋白表达量:取100 mg 的结肠组织进行研磨、取上清,随后BCA法测其蛋白浓度,蛋白变性后保存待用。检漏结束后开始制胶、上样,上样结束后开始电泳、转膜,转膜结束后脱脂牛奶进行封闭,封闭完成之后孵育一抗JAK2 抗体、STAT3 抗体、SOCS1 抗体(比例为1∶2 000、1∶1 000、1∶2 000),孵育完成后4 ℃冰箱封闭过夜,第二日,T‑BST 洗膜3 次后孵育山羊抗兔IgG(1∶5 000),2 h 后T‑BST 洗膜,然后使用超敏ECL 发光液进行发光显影,保存蛋白条带图,之后用ImageJ 软件对蛋白条带灰度值开始进行分析。
(5)Real‑timePCR 法检测结肠组织中JAK2、STAT3、SOCS1 mRNA 的表达:称取大鼠结肠组织约50 mg,提取总RNA,合成cDNA。以GAPDH为内参基因,以总mRNA 为模板,反转录为cDNA进行扩增。扩增条件:预变性95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,循环40 次。采用2‑ΔΔCt法计算目的基因的相对表达量。其引物设计及合成均由山西仁安生物科技有限公司完成。引物序列见表1。

表1 引物序列Tab 1 Primer sequence
1.6 统计学分析
采用SPSS26.0 统计软件进行统计分析,以均数±标准差(±s)表示,所有样本数据均符合正态分布且方差齐时,组间比较采用单因素方差分析和LSD 法检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 各组大鼠一般情况比较
造模前,各组大鼠精神饱满,反应灵敏,毛发有光泽,大便正常;造模后,各组大鼠毛发暗淡无光,精神萎靡、懒散,出现稀水便,严重者则出现血便,体重减轻;干预后,各腧穴组毛色较模型组有明显改善,体重和活动量有所增加,血便减少,便形逐渐恢复正常形状,总体情况较模型组有明显的改善,其中足三里穴组状况改善较其他腧穴组最为显著。
2.2 各组大鼠结肠组织病理形态学的比较
正常组腺体排列有序,隐窝表面规则,黏膜层和肌层无充血、水肿,结构完整;模型组腺体排列严重紊乱,大量炎症细胞浸润,充血、水肿,黏膜层和肌层受损严重,结构明显异常;各腧穴组与模型组相比病变明显得到改善,炎症反应明显减轻,但黏膜层和肌层还有缺损,腺体排列部分异常;其中,足三里穴组较其他各腧穴组黏膜层、肌层和腺体结构明显改善。见图1。
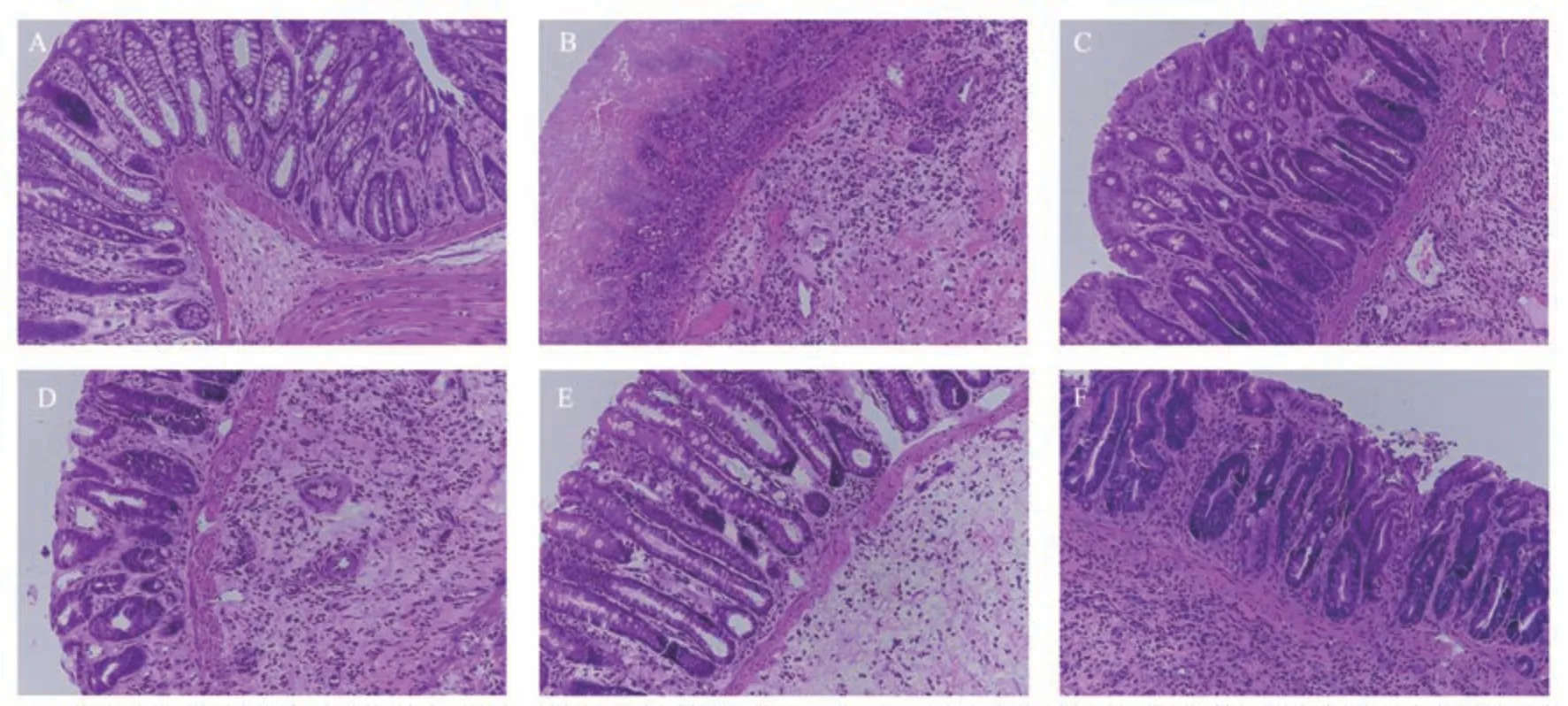
图1 结肠组织病理变化比较(HE,×200)Fig 1 Comparison of pathological changes of colon tissue (HE,×200 )
2.3 各组大鼠血清IL‑4、IL‑8 含量的比较
正常组与模型组相比较,发现模型组大鼠血清中IL‑4 水平明显降低,IL‑8 水平明显升高(P<0.01);各腧穴电针干预组与模型组相比较,发现电针干预后大鼠血清中IL‑4 水平均明显升高,IL‑8 水平均明显降低(P<0.01);其中,足三里组与天枢、大肠俞、上巨虚组相比较,发现大鼠血清中IL‑4 水平显著升高,IL‑8 水平显著降低(P<0.05);天枢组、大肠俞组、上巨虚组三组间相比较,发现大鼠血清中IL‑4、IL‑8 含量差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠血清IL⁃4、IL⁃8 含量的比较(pg/mL,n=6,±s)Tab 2 Comparison of serum IL⁃4 and IL⁃8 levels in each group of rats (pg/mL,n=6,±s)

表2 各组大鼠血清IL⁃4、IL⁃8 含量的比较(pg/mL,n=6,±s)Tab 2 Comparison of serum IL⁃4 and IL⁃8 levels in each group of rats (pg/mL,n=6,±s)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01;与足三里组比较,△P<0.05,△△P<0.01。
IL‑8 53.18±7.03 140.39±7.90**95.55±7.61##△98.62±6.91##△△83.65±8.62##102.16±8.83##△△77.861<0.0001组别正常组模型组天枢组大肠俞组足三里组上巨虚组FP IL‑4 96.00±4.68 43.54±6.39**70.88±7.46##△66.86±7.45##△△78.78±5.01##65.78±5.66##△△46.164<0.0001
2.4 各组大鼠结肠组织中JAK2、STAT3、SOCS1蛋白表达的比较
正常组与模型组相比较,发现模型组大鼠结肠组织中JAK2、STAT3 蛋白含量明显升高,SOCS1蛋白含量明显降低(P<0.01);各腧穴电针干预组与模型组相比较,发现电针干预后结肠组织中JAK2、STAT3 蛋白含量明显降低,SOCS1 蛋白含量明显升高(P<0.05);其中,足三里组与天枢、大肠俞、上巨虚组相比较,发现大鼠结肠组织中JAK2、STAT3蛋白含量显著下降,SOCS1 蛋白含量显著升高(P<0.05);天枢组、大肠俞组、上巨虚组三组间相比较,发现结肠组织中JAK2、STAT3、SOCS1 蛋白含量差异无统计学意义(P>0.05)。见图2、表3。
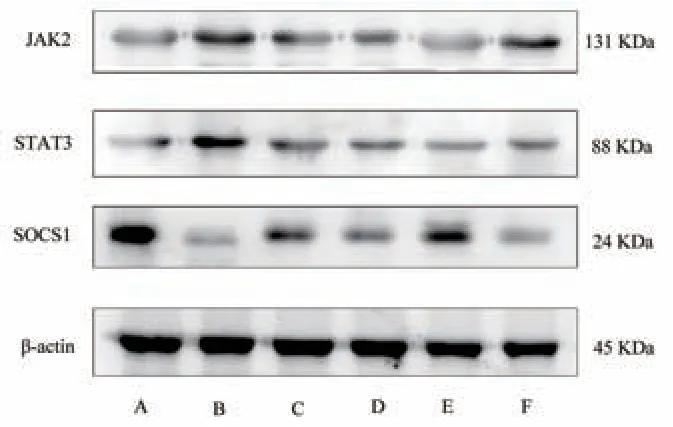
图2 各组大鼠结肠组织JAK2、STAT3、SOCS1 蛋白表达Fig 2 Expression of JAK2, STAT3 and SOCS1 protein in colon tissue of rats in each group
表3 各组大鼠结肠组织中JAK2、STAT3、SOCS1 蛋白表达量的比较(n=6,±s)Tab 3 Comparison of JAK2, STAT3 and SOCS1 protein ex⁃pression in colon tissue of rats in each group(n=6,±s)
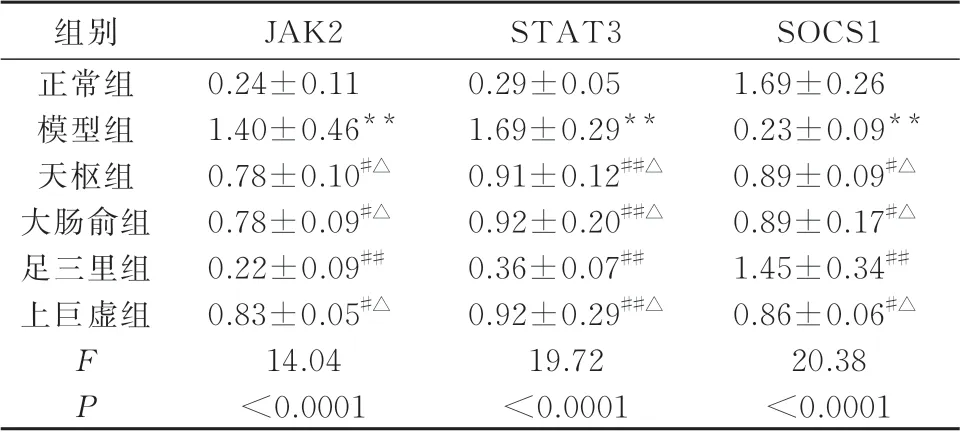
表3 各组大鼠结肠组织中JAK2、STAT3、SOCS1 蛋白表达量的比较(n=6,±s)Tab 3 Comparison of JAK2, STAT3 and SOCS1 protein ex⁃pression in colon tissue of rats in each group(n=6,±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与足三里组比较,△P<0.05。
SOCS1 1.69±0.26 0.23±0.09**0.89±0.09#△0.89±0.17#△1.45±0.34##0.86±0.06#△20.38<0.0001组别正常组模型组天枢组大肠俞组足三里组上巨虚组FP JAK2 0.24±0.11 1.40±0.46**0.78±0.10#△0.78±0.09#△0.22±0.09##0.83±0.05#△14.04<0.0001 STAT3 0.29±0.05 1.69±0.29**0.91±0.12##△0.92±0.20##△0.36±0.07##0.92±0.29##△19.72<0.0001
2.5 各组大鼠结肠组织中JAK2、STAT3、SOCS1 mRNA 表达的比较
正常组与模型组相比较,模型组大鼠结肠组织中JAK2、STAT3 mRNA 表达明显上升,SOCS1 mRNA 表达明显降低(P<0.01);各腧穴电针干预组与模型组相比较,电针干预后大鼠结肠组织中JAK2、STAT3 mRNA 表达明显降低(P<0.05),SOCS1 mRNA 表达明显升高(P<0.01);其中,足三里组与天枢、大肠俞、上巨虚组相比较,发现大鼠结肠组织中JAK2、STAT3 mRNA 表达显著下降,SOCS1 mRNA 表达显著升高(P<0.05);天枢组、大肠俞组、上巨虚组三组间相比较,发现结肠组织中JAK2、STAT3、SOCS1 mRNA 表达差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠结肠组织JAK2、STAT3、SOCS1mRNA 相对表达量比较(n=6,±s)Tab 4 Comparison of relative expression of JAK2, STAT3 and SOCS1 mRNA in colon tissue of rats in each group(n=6,±s)
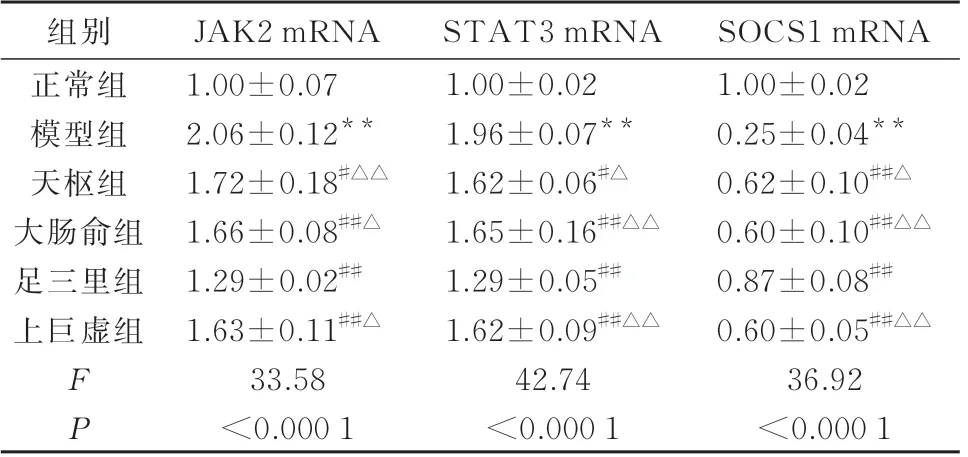
表4 各组大鼠结肠组织JAK2、STAT3、SOCS1mRNA 相对表达量比较(n=6,±s)Tab 4 Comparison of relative expression of JAK2, STAT3 and SOCS1 mRNA in colon tissue of rats in each group(n=6,±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与足三里组比较,△P<0.05,△△P<0.01。
SOCS1 mRNA 1.00±0.02 0.25±0.04**0.62±0.10##△0.60±0.10##△△0.87±0.08##0.60±0.05##△△36.92<0.000 1组别正常组模型组天枢组大肠俞组足三里组上巨虚组FP JAK2 mRNA 1.00±0.07 2.06±0.12**1.72±0.18#△△1.66±0.08##△1.29±0.02##1.63±0.11##△33.58<0.000 1 STAT3 mRNA 1.00±0.02 1.96±0.07**1.62±0.06#△1.65±0.16##△△1.29±0.05##1.62±0.09##△△42.74<0.000 1
3 讨论
结肠炎在中医学中归属于“肠澼”、“泄泻”、“腹痛”、“痢疾”等范畴,病位在肠,主要责之于脾胃[13]。正如《素问·阴阳应象大论》提到:“夫肠胃者,水谷之道也,五味入胃……下输于肾,别而为清浊”。近年来,大量文献研究表明针灸在临床治疗中具有独特的优势,对结肠炎也具有明显的治疗作用,可以有效的抑制肠道炎症反应[14‑17]。课题组前期研究也发现电针“天枢、大肠俞、足三里、上巨虚”四组腧穴对其治疗疗效显著,并对腧穴的特异性进行了更深一步的研究,发现电针上巨虚穴治疗慢性结肠炎疗效显著[10]。基于此,本实验继续以结肠炎为研究对象,以急性期开展基础研究,沿用“天枢、大肠俞、足三里、上巨虚”四组特定穴,观察其治疗作用,并进一步分析其特异性。天枢穴属阳明胃经,为大肠的募穴,具有理气、通调肠腑的之效。大肠俞属足太阳膀胱经,为大肠经的背俞穴,具有调畅肠腑、理气化滞的功效。足三里为足阳明胃经的合穴,根据“合治内腑”理论,足三里不仅可以治疗脾胃相关病症,还可治疗六腑相关疾病,是人体强壮保健要穴。上巨虚属于为大肠经的下合穴,具有调理气机、通经活络的作用。有研究发现电针“天枢”、“足三里”通过调控血清中相关炎症因子的含量,减轻炎症反应,起到保护结肠粘膜的作用[11]。本研究结果显示,经电针治疗后,各腧穴组大鼠一般情况明显好转,血便减少,体重和活动量有所增加,其中足三里穴组改善状况较其他腧穴组最为显著。
促炎和抗炎细胞因子的失衡与急性结肠炎的发生、发展密切相关[18]。IL‑4 和IL‑8 作为两种重要的炎症因子,在炎症性肠病的发生、发展中起重要作用。IL‑4 是由Th2 产生的抑炎细胞因子,主要作用于免疫活性细胞,并诱导活化的成熟T 细胞增值,能够抑制炎症反应和免疫细胞的浸润[19,20]。IL‑8 是一种促炎因子,当炎症发生时可以起直接介导的作用,也是一种很强的中性粒细胞趋化因子和活化因子[21]。当结肠炎急性期发作时,IL‑4 和IL‑8含量的分泌不足与太过都会导致肠道黏膜屏障的破坏和炎症反应的加剧。由此可以看出,IL‑4 和IL‑8 在急性结肠炎中的作用机制主要是通过促进和抑制炎症反应及免疫细胞的浸润,导致肠道黏膜屏障的破坏和炎症反应的加剧。因此,有效控制炎症因子IL‑4、IL‑8 的分泌,有助于减轻急性结肠炎的症状和炎症反应。本研究结果显示,急性期结肠组织中炎症细胞因子IL‑4 的分泌含量减少、IL‑8 的分泌含量增高。经电针治疗后可增加炎症细胞因子IL‑4 的分泌含量、减少IL‑8 的分泌含量,表明电针通过增加IL‑4、减少IL‑8 的含量,避免炎症细胞的浸润,从而维持炎症微环境的稳定来改善结肠黏膜的症状,保护结肠黏膜,其中足三里穴组IL‑4 的含量较其他腧穴组高,IL‑8 的含量则低于其它腧穴组。
JAK2/STAT3/SOCS1 信号通路作为一种经典的促炎信号通路,其可通过介导细胞因子的信号传导,将多种刺激信号进行传导,还可以通过靶基因来调节其相应的细胞反应[22,23]。其中JAK2 是一种酪氨酸激酶,当JAK2 的活性升高,能够促进炎症反应的发生[24]。STAT3 是一种转录因子,其主要作用是调节细胞的生长和分化[25]。在炎症微环境中,STAT3 的活性通常会升高,从而加剧炎症反应的发生[26]。SOCS1 是一种负免疫调节因子,它对调节细胞因子信号的JAK/STAT 途径提供负反馈[27]。当SOCS1 的表达水平升高,就会抑制JAK/STAT 信号通路的活性,减少炎症细胞的浸润。本研究结果显示,大鼠腹腔注射6%的冰乙酸溶液灌肠后,结肠组织明显出现损伤症状,JAK2、STAT3的表达显著升高;SOCS1 的表达显著降低。而电针各腧穴可减少JAK2、STAT3 的表达,增加SOCS1的表达。因此,通过抑制JAK2/STAT3/SOCS1 信号通路的活性,可以减轻炎症反应,改善急性结肠炎的症状。因此,该信号通路可能成为治疗急性结肠炎的新靶点。
综上,电针各腧穴均能改善急性结肠炎大鼠结肠组织黏膜的损伤,减轻炎症反应。其中足三里穴治疗效应总体优于天枢、大肠俞、上巨虚穴,其作用机制可能通过抑制JAK2/STAT3/SOCS1 信号通路相关蛋白,增加炎性细胞因子IL‑4、减少IL‑8 的分泌有关。
作者贡献度说明:
张春青:完成实验,进行指标检测,分析、整理数据,撰写论文;唐坤鹏、文坛:协助完成实验,在指标检测、数据分析方面给予相应的指导;闫丽萍:通讯作者,实验设计、指导及文章修改;王海军:对实验的顺利完成给予支持和帮助。
所有作者声明不存在利益冲突关系。
——用艾灸防治便秘(上)

