中药单体基于炎症机制治疗糖尿病肾病的研究进展
韩汶龙,秦嘉萍,蔺可欣,刘 嫱
(海南医学院药理学教研室,海南 海口 571199)
糖尿病(diabetes mellitus, DM)是一种复杂的多系统代谢性疾病,高血糖为其主要标志,影响着全球超过5 亿人,且发病率呈逐年增加的趋势,预计到2045 年患病人数将增加至6.3 亿人[1]。此外,DM还会引起心脏、肾脏、眼及血管的并发症,这些并发症会导致器官功能损害,是一大严重的公共问题[2]。
糖尿病肾病(diabetic kidney disease, DKD)大量存在于Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)患者中,是终末期肾病(end‑stage‑renal‑dis‑ease , ESRD)最常见的病因之一,是DM 的微血管并发症,会进一步影响DM 患者的生活质量。虽然DKD 的具体发病机制尚不明确,目前研究以持续高糖、炎症、氧化应激、自噬等为影响DKD 发生发展的主要机制[3]。
中药单体可以通过调控炎症发展,从而改善DKD 患者的微炎症状态,然而,目前依旧缺乏对中药单体治疗DKD 的完整性论证,因此有必要进一步加强对DKD 患者微炎症的中药单体研究论证。本文将从炎症机制与DKD 间相互作用及中药单体对DKD 治疗等方面的研究进展进行详细综述。
1 炎症机制对糖尿病肾病发生、发展的作用
局部肾脏炎症在DKD 的发生和进展中起着至关重要的作用[4,5],与传统炎症不同,DKD 局部炎症处于一种慢性、低水平的微炎症状态[6]。肾小管间质炎症成分,特别是近端小管上皮细胞,在DKD 的发病机制中发挥核心作用。炎症因子和炎症细胞对DKD 的影响是多靶点、多途径的。肾脏微炎症会诱导DKD 纤维化反应[7],包括巨噬细胞和其他免疫细胞释放细胞因子和促纤维化因子,并与肾细胞相互作用,诱导产生促纤维化的微环境[8],甚至引发促纤维化级联反应[5]。肾脏中一些细胞可以分泌炎症因子,这些炎症因子通过多方面作用,介导趋化因子和炎症细胞形成复杂的炎症网络,从而放大和延续肾脏中的炎症过程。因此,抑制炎症因子及炎症细胞进入肾脏将对肾脏具有一定的保护作用[9]。
1.1 炎症因子与DKD
DKD 的微炎症发生期间,巨噬细胞产生过量的炎症因子,如IL‑6、TNF‑α、NO、PGE2、iNOS、COX‑2、VEGF 等诱导细胞坏死并损伤组织。调节炎症反应和免疫反应的炎症因子AIF‑1 和IGFBP5 也参与到DKD 炎症反应中,若表达水平显著升高,则会诱导肾脏产生炎症。上调的炎症因子会诱导体内自由基水平增高,抗氧化能力减弱,出现氧化应激损伤,进一步加重炎症[10]。
1.2 炎症细胞与DKD
肾脏组织中炎症细胞(如单核细胞等)的积聚程度也与DKD 发展密切相关。炎症细胞在局部合成并分泌TNF‑α 等促炎因子,这些促炎因子会直接破坏肾脏结构,诱导肾脏发生上皮间质转化过程,导致细胞外基质(extracellular matrix,ECM)积累,最终引起巨噬细胞浸润并诱发肾脏炎症。同时,TNF‑α 能够通过趋化单核细胞、中性粒细胞等炎症细胞,诱导炎症发生,促进单核细胞和巨噬细胞的吞噬作用而加强炎症作用[11]。此外,趋化因子和黏附分子表达的上调同样会诱导炎症细胞迁移至肾脏组织,参与淋巴组织的形成和慢性肾脏炎症,最终加强炎症反应,加速肾脏损伤[12]。在炎症状态下,肾脏多种细胞会表达CX3CL1,CX3CL1 具有诱导白细胞定向肾脏的作用[13];与CCL20 相似[14],CCL2 与其受体CCR2 结合后会使单核巨噬细胞黏附性、浸润性增加,诱导IL‑6 分泌,使系膜细胞增殖和基质沉积,引发肾小球炎症和硬化以及肾间质纤维化[12]。
2 炎症相关信号通路与DKD
部分炎症介质通过参与信号通路的活化介导炎症反应,如NF‑κB 通路、JAK/STAT 通路、Nrf2/HO‑1 通路、MAPK 通路及Wnt 通路等[10]。这些通路受多种因子共同调控,相关通路之间抗炎、抗自噬及抗细胞凋亡等反应间相互转化,如炎症和氧化应激的病理生理过程密切相关[3,4,15,16]。
2.1 NF‑κB 信号通路与DKD
NF‑κB 通路的活化是诱发DKD 炎症的关键因素之一,该通路被激活后,刺激下游信号,使得炎症因子和细胞黏附蛋白等表达增强,促进肾小球硬化[17],最终加重DKD 对肾脏的损伤[18]。Yang 等[19]使用NF‑κB 抑制剂,使得糖尿病大鼠肾脏中的巨噬细胞浸润减少,抑制炎症细胞因子的产生,逆转肾功能障碍而达到保护肾脏的效果。
2.2 JAK‑STAT 信号通路与DKD
在DKD 发生发展中,JAK/STAT 通路被高浓度葡萄糖、糖基化终末产物(AGEs)、氧化应激等上游信号激活后,诱导细胞因子共同参与炎症、纤维化和细胞增殖[20]。研究表明,JAK‑STAT 通路被高浓度葡萄糖激活后,足细胞自噬调节将被抑制。自噬调节的异常是DKD 发病机制之一,若机体无法有效清除已受损的蛋白质及细胞器,则会加重足细胞损伤和DKD 进展[21]。氧化应激中过量的ROS 也会通过激活NF‑κB,触发JAK‑STAT 通路,从而加剧炎症过程[1,4]。若下调JAK/STAT 信号通路,降低NF‑κB 的表达,恢复足细胞自噬作用,将对DKD肾功具有保护作用[22]。
3 中药单体基于炎症机制防治DKD 的研究
多项研究表明,一些中药单体如黄芩素、毛蕊异黄酮、大蒜素等能抑制NF‑κB 途径,减轻肾脏炎症,降低DKD 小鼠肾小管上皮细胞中炎症因子表达,减少DKD 小鼠蛋白尿,保护肾脏组织[23‑25]。也有一些中药单体通过抑制JAK/STAT 信号通路活性,减少肾脏中炎症因子的表达[26],促进肾小管上皮细胞增殖,抑制细胞凋亡[27]。
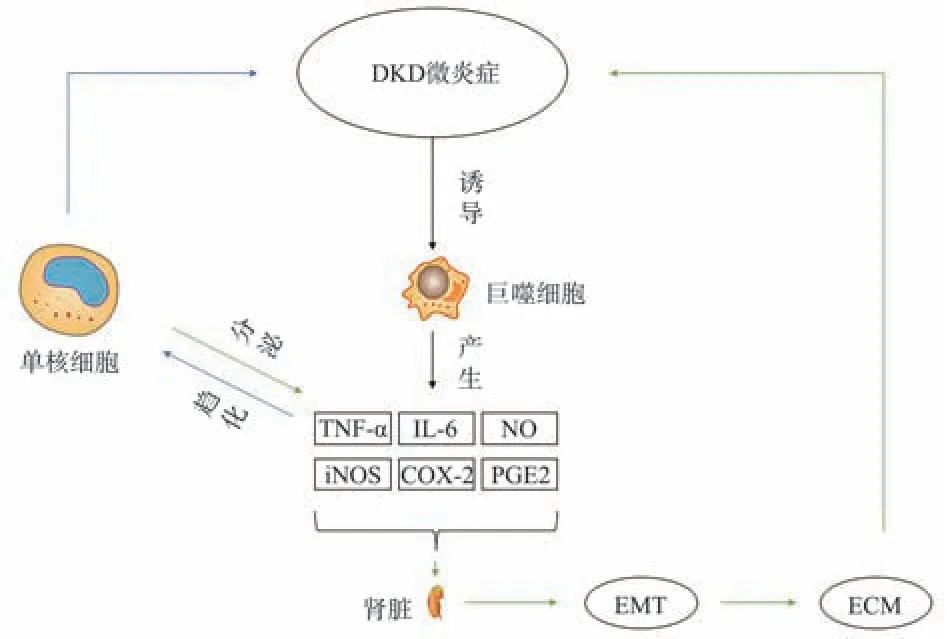
图1 炎症与DKD 间相互作用Fig 1 Interaction between inflammation and DKD
3.1 雷公藤多苷和雷公藤甲素
雷公藤中提取的有效成分如雷公藤甲素和雷公藤多苷,抗炎作用较强,已广泛应用于各种肾小球疾病及多种自身免疫性疾病的治疗[28,29]。雷公藤多苷降低糖尿病大鼠肾组织TNF‑α、IL‑6、INF‑γ 和MCP‑1 等炎症因子水平,降低p‑JAK2 和p‑STAT3蛋白的表达,下调JAK/STAT 信号通路,减少炎症发生,减轻糖尿病大鼠肾组织病变程度[30]。雷公藤甲素可抑制NF‑κB 信号通路,降低MCP‑1、ICAM‑1等促炎因子的表达,发挥抗炎作用,保护肾脏[31,32]。
3.2 芍药苷
白芍总苷是多种单萜类化合物的总称,其中占比最大的是芍药苷[33]。芍药苷不仅可以抑制MCP‑1、TNF‑α 及IL‑1 等多种炎性因子,防止细胞坏死和组织损伤,还可以降低高糖下肾细胞p‑JAK2 与p‑STAT3 蛋白表达,下调JAK/STAT 信号通路,减轻对足细胞自噬的抑制,从而减轻肾组织炎症,保护肾脏[34,35]。
3.3 黄芪多糖和黄芪甲苷
黄芪活性成分有黄芪甲苷、黄芪多糖等[27,36]。黄芪多糖不仅可调节JAK‑STAT 信号通路,抑制肾小管上皮细胞中p‑STAT1、p‑STAT3、α‑SMA 等蛋白表达,减轻足细胞凋亡并降低IL‑1β 和IL‑18 等炎症因子水平[37];还能改善胰岛素抵抗所致的脏器损伤。黄芪甲苷能够降低TGF‑β1、Smad3、p‑Smad2/3 和α‑SMA 蛋白表达水平,提高Smad7、E‑钙黏蛋白表达水平,抑制DKD 所致系膜过度增殖和肾纤维化[38]。
3.4 丹酚酸
丹酚酸是丹参中水溶性酚酸类化合物[38],丹酚酸通过调节JAK/STAT 信号通路,降低DKD 大鼠JAK2、STAT3 等蛋白的表达水平,抑制肾纤维化,保护肾脏[39]。此外,丹酚酸还能抑制TGF‑β1/Smad信号通路转导,减轻DKD 肾组织细胞凋亡,降低肾组织TGF‑β1、p‑Smad2、Smad2 蛋白表达水平,改善DKD 小鼠肾纤维化和炎症[40]。临床实验表明,丹参多酚酸盐能够降低糖尿病患者TNF‑α 和IL‑6 水平,辅助治疗糖尿病肾病,有效降低患者炎性反应[41]。
3.5 黄连素
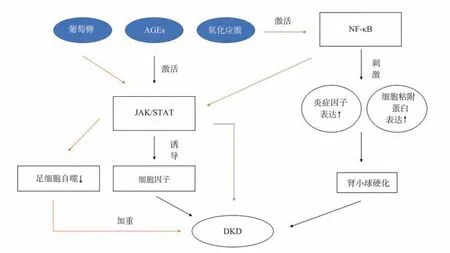
图2 信号通路与DKD 间相互作用Fig 2 Interaction between signal pathway and DKD
黄连素是黄连、黄柏中提取的生物碱[42]。黄连素通过抑制NF‑κB 通路,抑制肾小管细胞炎症和纤维化的发生,缓解DKD 大鼠的炎症反应和高糖诱导的足细胞的凋亡;同时降低TGF‑β 表达,抑制ECM 沉积,抑制肾小球系膜细胞增殖[43]。若黄连素联合使用NF‑κB 通路抑制剂二硫代氨基甲酸吡咯烷,能够更好的阻断NF‑κB 通路,加强黄连素抑制足细胞炎症和凋亡作用的效果[44]。
3.6 其他中药单体
蛹虫草多糖能抑制JAK/STAT 信号通路的表达,增强细胞自噬,抑制氧化应激,最终减轻肾脏炎症[29]。葛亮等[45]发现姜黄素可逆转DKD 大鼠的肾脏病理损害,降低肾脏TGF‑β1、p‑AMPK 蛋白表达水平,从而减轻大鼠糖尿病肾病的肾脏纤维化。Xu等[46]研究发现6‑姜酚能够下调db/db 小鼠TNF‑α、MCP‑1、IL‑6 等炎症相关因素的表达,减轻DKD 症状及改善肾脏炎症损伤。丹皮酚可通过抑制NL‑RP3/Caspase‑1 的表达,减少炎症因子的释放,减轻炎症[47]。大黄酸通过干预肾脏PI3K/Akt/FoxO1 信号转导通路,降低血糖,保护肾脏[48]。

表1 中药单体抗炎作用机制Tab 1 Mechanism of anti⁃inflammatory action of TCM monomer
4 小结与展望
对DKD 而言,机体受到长期持续的高糖状态刺激,产生炎症反应;同时,这种炎症会持续不断地激活ROS 的过量产生,受到氧化应激的损害,而这种氧化损伤反之进一步加重炎症反应,而氧化应激与微炎症之间二者相互作用对DKD 造成严重影响。目前,国内外对中药抗炎机制展开了深入研究,一些中药及其提取物能够改善糖尿病肾组织的炎症性损伤,进而保护肾脏。随着对中药干预DKD作用机制的深入研究,以多个炎症途径为靶点开发中药新药防治DKD 将是很有前途的治疗策略,积极寻找有效的抗炎抗氧化中药治疗方法,可能是下一步治疗DKD 的一个热点研究方向。
作者贡献度说明:
韩汶龙:参与文章的主要撰写与修改。秦嘉萍、蔺可欣:参与资料、 数据的收集、 整理与分析。刘嫱:参与选题、构思和设计。
所有作者声明不存在利益冲突关系。

