基于网络药理学、分子对接与实验验证揭示槲皮素治疗腹泻型肠易激综合征的潜在分子机制
冯敏超,罗 芳,谢 胜,陈祖民,谭瑾轩,李 凯,陈国忠,王道刚
(1.广西中医药大学,广西 南宁 530001;2.广西中医药大学第一附属医院,广西 南宁 530001)
肠易激综合征(irritable bowel syndrome,IBS)是一种常见的功能性胃肠道疾病,以腹泻、便秘、疼痛为特征,影响全球9%~23%的人口,其中腹泻型肠易激综合征(diarrhoeal irritable bowel syndrome,IBS‑D)是IBS 最常见的亚型,约占40%[1,2]。目前IBS‑D 发病机制尚未能被完全揭示。槲皮素作为黄酮类化合物,有抗炎、抗氧化、抑制细胞增殖等作用。前期已经证实,槲皮素能减轻IBS 大鼠的炎症反应,可作为肠易激综合征治疗的辅助药物[3,4]。网络药理学是一种用于从宏观角度分析和预测药物干预疾病的潜在机制的方法,因此,本研究基于网络药理学对槲皮素干预IBS‑D 的作用机制进行初步探究,并结合动物实验进行初步验证,以提供证据支持含有槲皮素成分的中药对IBS‑D 的治疗。
1 材料与方法
1.1 实验动物
SPF 级雄性SD 大鼠50 只,体重160~200 g,购自湖南屠宰场景达实验动物(中国长沙;证书号SCXK(湘)2019‑0004)。所有大鼠在广西中医药大学第一附属医院医学分子生物学实验中心饲养[SYXK(湘)2019‑0001],光源每12 h 明暗交替循环,常规标准饲料喂养,自由采食,饮水。该研究按照《实验动物护理原则》进行,获得广西中医药大学实验动物伦理委员会的批准(审批号:2021‑066)。
1.2 实验药品与试剂
槲皮素、戊巴比妥钠购自Sigma 公司(批号:Q4951‑10G;AM00469);苏木精和伊红(H&E)染色试剂盒(Solarbio 公司,G1120);大鼠IL‑1β、IL‑6、TNF‑α、VEGFA ELISA 试剂盒(Proteintech 公司,批号:KE10003;KE10007;KE10002;KE20014);大鼠TP53 ELISA 试剂盒(CUSABIO 公司,CSB‑E08336r);大鼠AKT1 ELISA 试剂盒(上海科艾博生物公司,CB13377‑Ra)。
1.3 仪器设备
组织切片机(德国Leica 公司,型号:RM2016);酶标仪(Rayto 公司,型号:RT‑6100);光学显微镜(Olympus 公司,型号:BX43)。
1.4 网络药理学分析
1.4.1 槲皮素靶点的筛选和中药‑槲皮素‑靶点网络图的构建 使用搜索词“槲皮素”在TCMSP (Tra‑ditional Chinese Medicine Systems Pharmacology,https://tcmspw.com/tcmsp.php)、SwissTar‑getPre‑diction (http://www.swisstargetprediction.ch/) 和BATMAN‑TCM 数据库 (http://bionet.ncpsb.org/batman‑tcm/) 获得槲皮素的潜在靶点和相对应中药。通过TCMIP v2.0 数据库(http://www.tcmip.cn/TCMIP/index.php)、中国药典2020 版本、相关书籍文献获得中药的性味归经。UniProt 数据库(http://www.uniprot.org/) 用于标准化基因和蛋白质的名称。使用Cytoscape 3.7.1 构建中药‑槲皮素‑靶点网络图。
1.4.2 IBS‑D 相关靶点的收集 通过使用搜索词“diarrhea irritable bowel syndrome”在GeneCards 数据库中获得IBS‑D 的相关靶点 (https://auth.lifemapsc.com/)。
1.4.3 交叉目标基因的Venn 图映射 Venny 工具(http://bioinformatics.psb.ugent.be/webtools/Venn/) 用于绘制槲皮素靶基因与IBS‑D 靶基因的维恩图并进行比较,以获得靶基因的交集。
1.4.4 蛋白质互作网络(PPI)的构建 基于交叉目标结果,在string 数据库 (http://string‑db.org/) 中构建了PPI 网络,物种限制为“智人”,所需的最低交互分数为0.4。然后将PPI 网络数据导入Cytoscape 3.7.1 软件,使用CytoHubba 和MCODE 算法插件获得该网络的一组核心靶点。
1.4.5 GO 功能分析和KEGG 途径富集分析 为了确定槲皮素调节IBS‑D 的潜在通路途径,使用DA‑VID 数据库对交叉靶标进行GO 富集分析(https://david.ncifcrf.gov/)。进行KEGG 分析,根据P≤0.01 绘制了信号通路直方图,并选择了前20条信号通路绘制KEGG 气泡图。然后通过Omic‑Share 网站将数据可视化(https://www.omicshare.com/)。
1.5 分子对接模拟
在PPI 网络分析中确定的前五个核心基因被选择用于与槲皮素进行分子对接模拟。其中槲皮素的2D 结构从PubChem 数据库下载(https://pub‑chem.ncbi.nlm.nih.gov/)并使用ChemBio3D 优化机械结构。靶蛋白的晶体结构从RCSB 数据库中获得(https://www.rcsb.org/)。 使用AutoDockTools 1.5.6 将配体和受体文件转换为pdbqt 格式,并通过用氢原子替换水分子来改进其结构。最后,在Dis‑covery Studio 软件中进行分子对接模拟。Discov‑ery Studio 计算的LibDock 评分表明配体与受体的结合程度。
1.6 动物实验
1.6.1 IBS‑D 模型制备和实验分组 大鼠按随机数字表法分为空白组、模型组、槲皮素低、中、高剂量组,每组10 只。大鼠IBS‑D 模型建立的参考文献[5],每日束缚大鼠1 h 并使用1 mL 4%乙酸灌肠,持续7 d。造模成功后开始灌胃给药,槲皮素组大鼠分别给予槲皮素5、10、20 mg/kg 灌胃[3],空白组与模型组大鼠给予等量生理盐水灌胃,每日1 次,持续2 周。
1.6.2 IBS‑D 大鼠结肠组织病理学观察 在制备切片(5 μm 厚)之前,用4%多聚甲醛固定大鼠的结肠组织并将其包埋在石蜡中。切片,烤片30 min,用二甲苯和无水乙醇脱蜡和水合,进行HE 染色。通过在光学显微镜来评估IBS‑D 大鼠结肠组织的病理变化。
1.6.3 ELISA 法检测大鼠血清IL‑1β、IL‑6、TNF‑α、TP53、AKT1、VEGFA 的水平 无菌条件下,大鼠腹主动脉取血,血液样本在室温下静置2 h,然后在高速离心机中以3 000 r/min 在4 ℃下离心15 min。去除血清上层,并根据制造商的说明,使用酶标仪在450 nm 处测量IL‑1β、IL‑6、TNF‑α、TP53、AKT1、VEGFA 的OD 值,绘制样品标准曲线并换算浓度。
1.7 统计学处理
所有资料分析均使用SPSS 25.0 软件与Graph‑Pad Prism 9.0 软件进行。数据以(±s)表示,使用单因素方差分析分析各组间差异的显著性。P<0.05 为差异具有统计学意义。
2 结果
2.1 槲皮素潜在靶点的筛选
在 TCMSP、SwissTargetPrediction 和 BAT‑MAN‑TCM 数据库中搜索槲皮素的潜在靶点和对应的中药,共获得311 个潜在靶点和188 味中药。随后,我们构建一个中药‑槲皮素‑靶点网络,如图1所示,该网络包括500 个节点和499 个边缘,例如包括IL‑2、IL‑6、IL‑10、CXCL2、MYC 等靶点和谷精草、牡丹皮、香附、丁香、三七等草药。
2.2 含有槲皮素的中药的性味归经分析
在TCMSP 数据库搜索含有槲皮素的中药,利用TCMIP 等数据库归纳中药的性味归经,含有槲皮素的中药的“四气”多归属为寒;“五味”多为苦、甘;归经多入肝经、肺经,见图2。
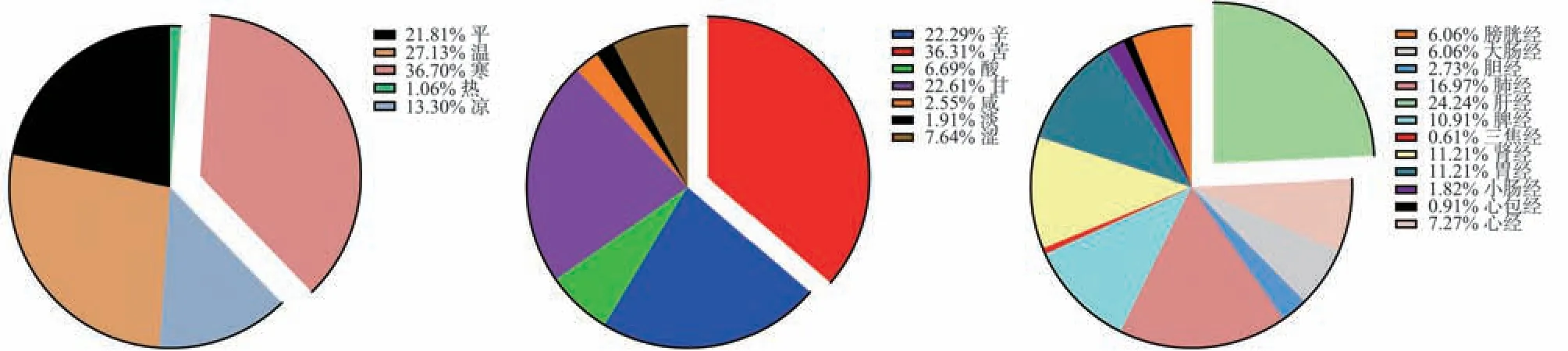
图2 中药性味归经分析Fig 2 Analysis chart of Chinese herbal medicine's sexual flavor and meridian
2.3 PPI 网络的构建
搜索TCMSP、BATMAN‑TCM 和Swiss 靶点数据库预测槲皮素在治疗IBS‑D 中所涉及的潜在靶点,确定了311 个潜在靶点。通过搜索GeneCards数据库(相关性评分≥16.261 283 87),获得650 个IBS‑D 相关基因。将槲皮素的靶点和IBS‑D 的相关基因导入OmicShare 云平台后,识别出77 个重叠的靶基因,见图3A。进一步探索槲皮素治疗IBS‑D 的核心目标,将这些重叠的目标基因导入STRING 网站构建PPI 网络,该网络包括77 个节点和1135 个边缘,包括TP53、VEGFA、SRC、EGFR 和IL1B 等靶点,见图3B 和表1。
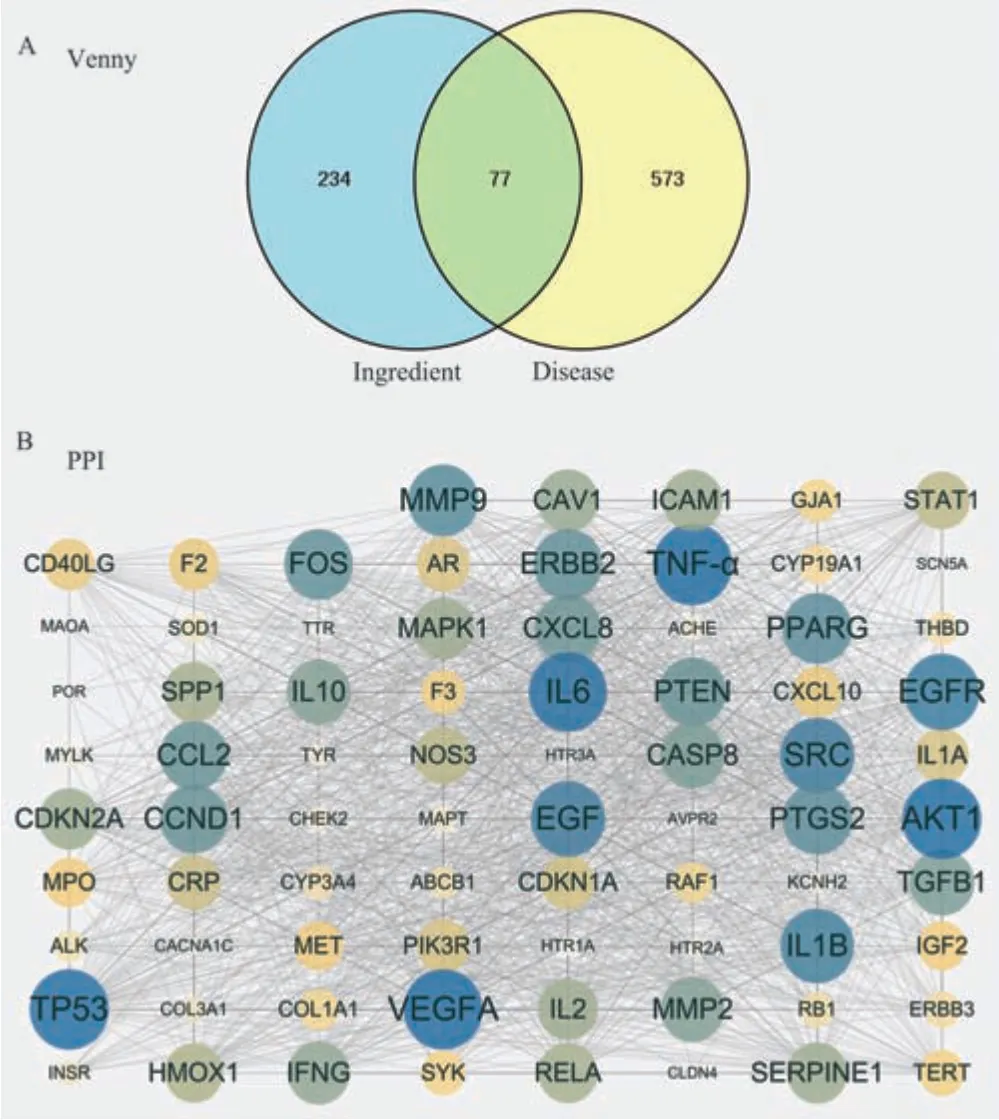
图3 网络药理学靶标分析Fig 3 Network pharmacological target analysis
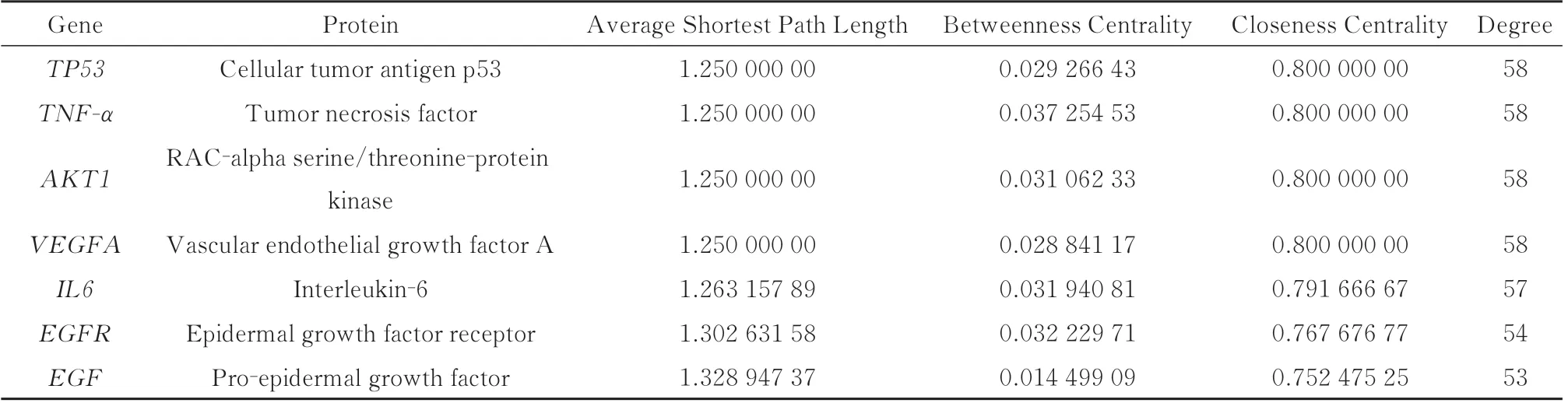
表1 PPI 网络中77 个主要组件的拓扑分析Tab 1 Topological analysis of 77 main components in PPI network
2.4 槲皮素核心靶点的搜索
使用MCODE 对PPI 网络进行模块划分与聚类分析,共获得4 个模块,其中得分最高的模块(得分=33.632)包括39 个节点和639 条边,见图4A 和表2;模块二(得分=3.750)包括9 个节点和15 条边,见图4B;模块三、四(得分=3.000)包括3 个节点和3条边,见图4C、D;此外,使用CytoHubba 插件提取PPI 网络中按degree 排名前10 的节点,包括TP53、TNF‑α、AKT1、VEGFA 和IL6 等核心节点,见图4e和表3。结合两种算法结果,上述靶点被确定为槲皮素治疗IBS‑D 的核心靶点。
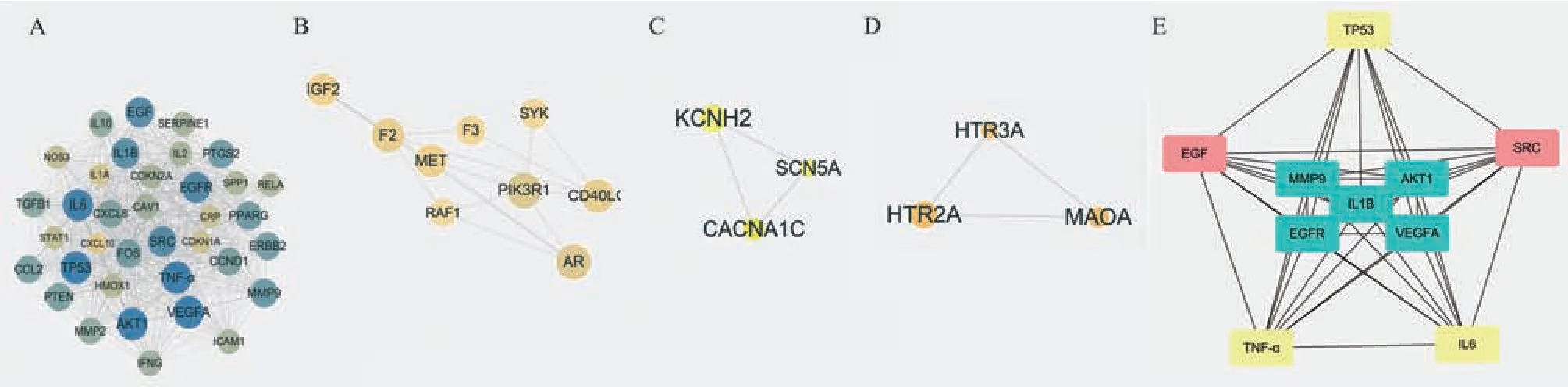
图4 PPI 网络核心靶点分析Fig 4 PPI network core target analysis
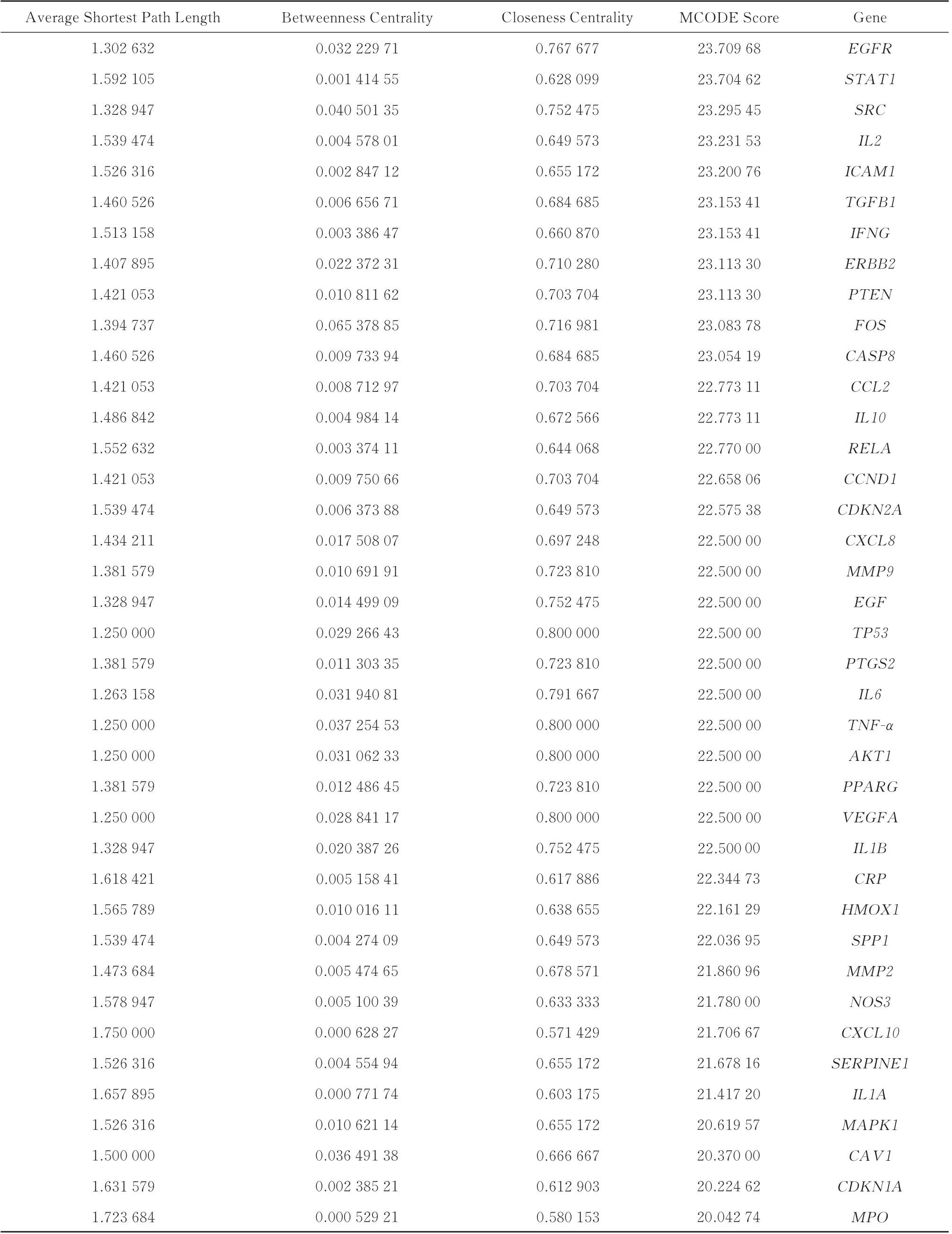
表2 基于Mocde 的网络核心目标拓扑分析Tab 2 Topological analysis of network core targets based on Mocde
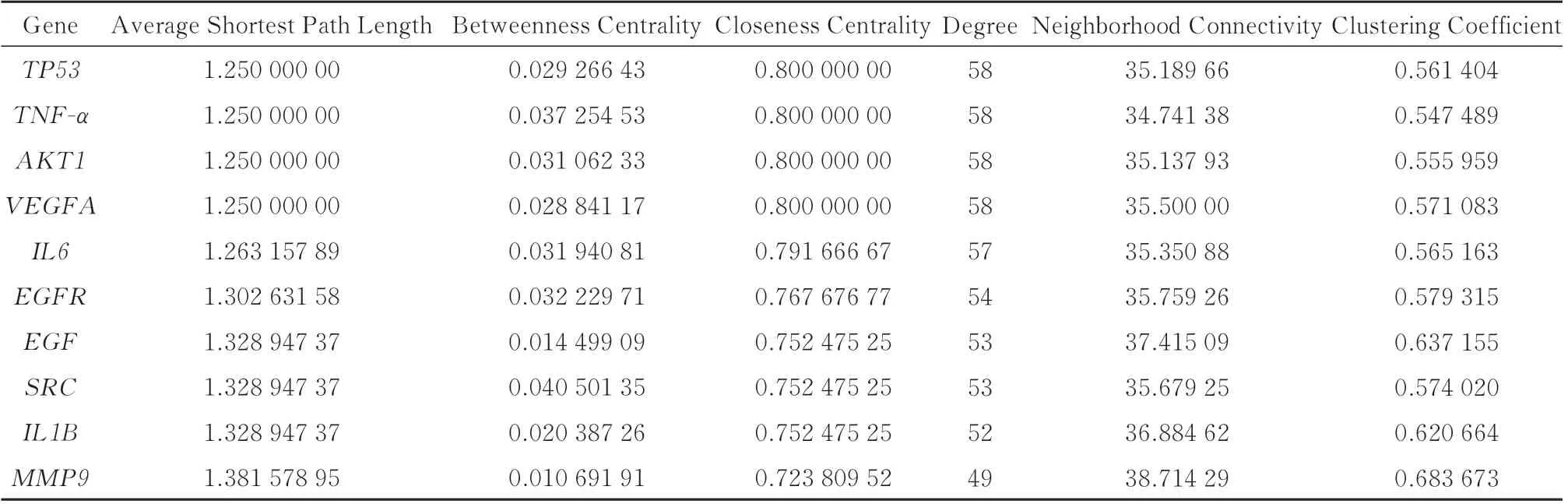
表3 基于Cytohubba 的网络核心目标拓扑分析Tab 3 Topological analysis of network core targets based on Cytohubba
2.5 GO 功能富集和KEGG 途径富集分析
77 个重叠的靶基因被提交到DAVID 数据库和Om‑icShare 云平台,用于GO 和KEGG 途径富集分析,共鉴定了2 793 个相关GO 富集条目和132 条KEGG 途径(P≤0.01)。涉及IBS‑D 治疗的GO 富集条目包括2 494 个生物过程条目(BP)、178 个分子功能条目(MF)和121 个细胞成分条目(CC)。GO富集分析的BP、MF、CC 的前20 个条目,见图5。这些分析表明,生物质量调节、程序性细胞死亡的调节、分子功能的正调节、分子功能的正调节和细胞增殖等生物过程在槲皮素的抗IBS‑D 作用中起着重要作用。分子功能包括生长因子受体结合、蛋白磷酸酶结合、受体结合、细胞因子活性和激酶活性。细胞成分主要涉及质膜蛋白复合物、细胞质核周区、质膜部分和细胞基膜。

图5 槲皮素用于IBS‑D 治疗的网络药理学靶标的GO 富集分析Fig 5 GO enrichment analysis of network pharmacological targets of quercetin for IBS⁃D treatment
132 条KEGG 途径涉及人类疾病(如癌症、传染病、心血管疾病和免疫性疾病)、细胞过程(细胞生长和死亡及运输和分解代谢)、生物系统(如免疫系统、消化系统和循环系统)、环境信息处理(如信号转导和信号分子及相互作用)和代谢(如脂质代谢)等。此外,Pathways in cancer、MAPK、PI3K‑Akt 和TNF 信号通路被鉴定为在IBS‑D 发展中起主要作用的4 种途径,见图6。
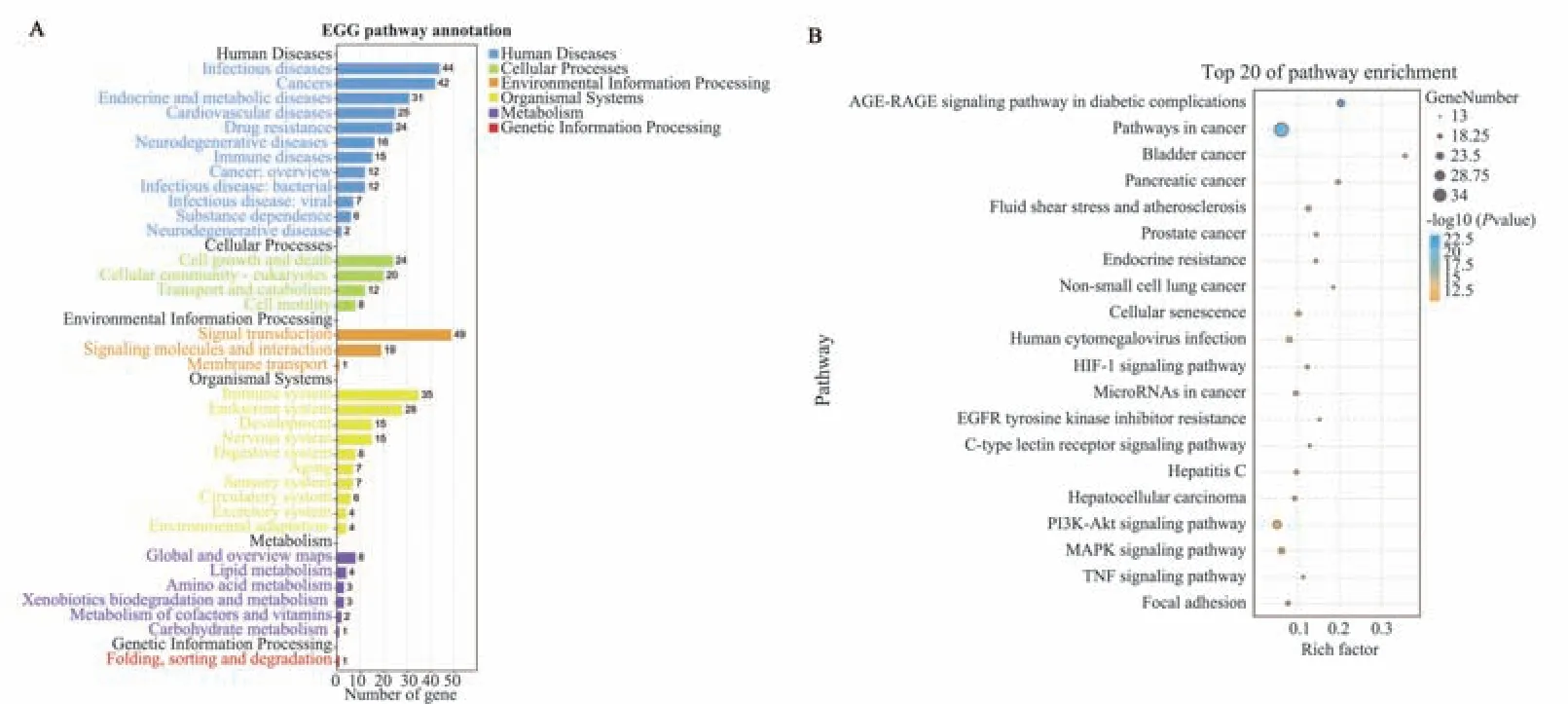
图6 槲皮素治疗IBS‑D 的网络药理学靶标的KEGG 富集分析Fig 6 KEGG enrichment analysis of network pharmacological targets for quercetin treatment of IBS⁃D
2.6 分子对接分析
用五个核心靶标(TP53、TNF‑α、AKT1、VEG‑FA 和IL6)和槲皮素进行分子对接,见图7。基于Discovery Studio 软件的计算结果显示,TP53‑槲皮素、TNF‑α‑槲皮素、AKT1‑槲皮素、VEGFA‑槲皮素、IL6‑槲皮素具有良好的结合能力,LibDock 得分分别为85.698 4、111.196、72.431 7、79.826 3 和107.199。
2.7 实验验证结果
2.7.1 大鼠一般情况 空白组大鼠精神较佳、粪便正常、饮食规律、活动自如;模型组大鼠精神状态不佳、粪质稀溏、饮食及活动减少、体质量降低;经过治疗后,槲皮素各剂量组大鼠精神状态较好,粪质逐渐好转,饮食及活动增加,体质量增加。
2.7.2 槲皮素对结肠组织的影响 空白组大鼠结肠组织上皮细胞连接紧密,肠粘膜结构完整,腺体结构排列整齐,未见明显器质性病变。模型组大鼠可见杯状细胞浆内富含液颗粒,少量中性粒细胞及炎性细胞散量存在,肠粘膜结构相对完整。与模型组对比,槲皮素各剂量组大鼠结肠组织未见明显器质性病变,炎性反应减少,见图8。
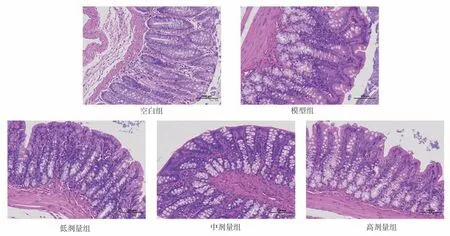
图8 槲皮素对IBS‑D 大鼠结肠组织病理学的影响(HE,×400)Fig 8 Effect of quercetin on colonic histopathology in IBS⁃D rats (HE, ×400)
2.7.3 槲皮素对IBS‑D 大鼠TP53、TNF‑α、AKT1、VEGF‑A、IL‑1β、IL‑6 的影响 ELISA 结果显示,与空白组相比,模型组大鼠TP53、TNF‑α、AKT1、VEGF‑A、IL‑1β、IL‑6 均升高(P<0.05);与模型组相比,槲皮素各治疗组大鼠逆转了TP53、TNF‑α、AKT1、VEGF‑A、IL‑1β、IL‑6 的升高(P<0.05),其中槲皮素高剂量组抑制效果最显著,见表4。
表4 槲皮素对IBS⁃D 大鼠TP53、TNF⁃α、AKT1、VEGF⁃A、IL⁃1β 和IL⁃6 的影响 (n=10, ±s)Tab 4 Effect of quercetin on TP53, TNF⁃α, AKT1, VEGF⁃A, IL⁃1β and IL⁃6 in IBS⁃D rats (n=10, ±s)
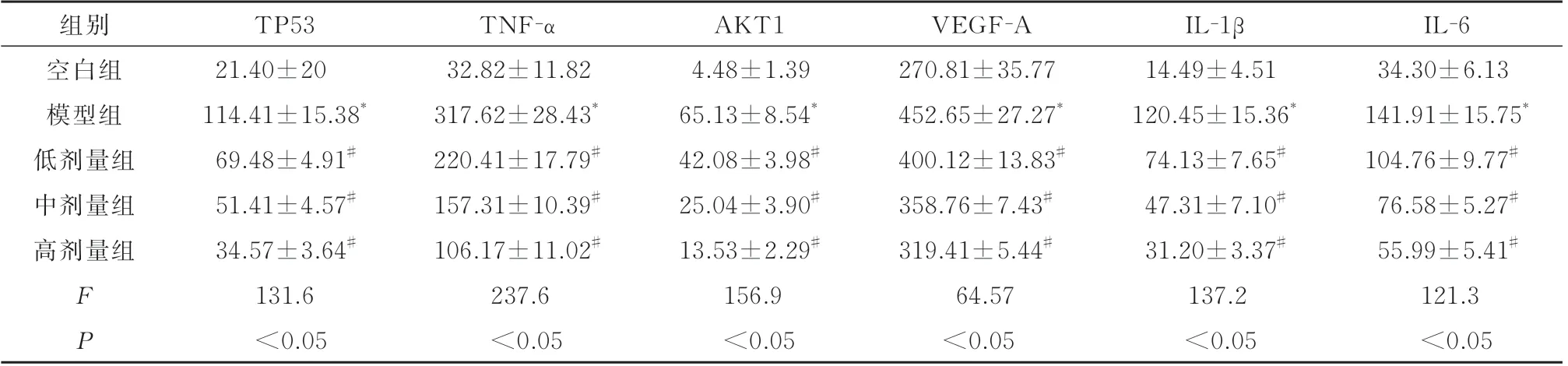
表4 槲皮素对IBS⁃D 大鼠TP53、TNF⁃α、AKT1、VEGF⁃A、IL⁃1β 和IL⁃6 的影响 (n=10, ±s)Tab 4 Effect of quercetin on TP53, TNF⁃α, AKT1, VEGF⁃A, IL⁃1β and IL⁃6 in IBS⁃D rats (n=10, ±s)
注:与空白组比较,*P<0.05; 与模型组比较,#P<0.05。
组别空白组模型组低剂量组中剂量组高剂量组FP TP53 21.40±20 114.41±15.38*69.48±4.91#51.41±4.57#34.57±3.64#131.6 TNF‑α 32.82±11.82 317.62±28.43*220.41±17.79#157.31±10.39#106.17±11.02#237.6 AKT1 4.48±1.39 65.13±8.54*42.08±3.98#25.04±3.90#13.53±2.29#156.9 IL‑1β 14.49±4.51 120.45±15.36*74.13±7.65#47.31±7.10#31.20±3.37#137.2 IL‑6 34.30±6.13 141.91±15.75*104.76±9.77#76.58±5.27#55.99±5.41#121.3<0.05<0.05<0.05<0.05 VEGF‑A 270.81±35.77 452.65±27.27*400.12±13.83#358.76±7.43#319.41±5.44#64.57<0.05<0.05
3 讨论
目前认为IBS‑D 与肠道微生物群、内脏超敏反应、肠道通透性、肠脑相互作用、低度炎症等多种机制相关[6]。其中,炎症反应是免疫系统诱导的基本反应,以保护身体免受病原体、组织损伤和压力的侵害。本研究网络药理学结果显示,槲皮素治疗IBS‑D 的核心关键靶点为TP53、TNF‑α、AKT1、VEGF‑A 和IL‑6,这些靶点与炎症反应,细胞程序性死亡,氧化应激有关。研究表明TP53 作为转录因子,能使得线粒体外膜通透性增高,诱发细胞凋亡,也可以通过PI3K/Akt、MAPK 等信号通路调控细胞周期、炎症反应、细胞凋亡[7‑9]。AKT1 是一种细胞内激酶,几乎在所有组织中都有表达,可以调节细胞新陈代谢、稳态、存活和增殖等[10]。有学者发现在结肠炎相关癌症中,AKT1 磷酸化能诱导NLRP3 炎症小体活化介导炎症反应[11]。氧化应激可以激活生长、趋化、炎性细胞、抗炎等多种转录因子维持机体内环境稳态[12]。据报道,VEGF‑A 是一种高度保守的分泌信号蛋白,受缺氧或生长因子等效应物调节,同时VEGF 是氧化应激过程中的重要节点,能增加细胞内ROS 的表达,诱导内皮细胞迁移和增殖,调节缺氧/复氧系统之间的平衡[13]。另外,VEGF 的缺失能增加细胞凋亡,影响内皮细胞存活和代谢[14]。作为炎症反应的促进者,TNF‑α 可增加更多趋化因子和细胞因子的产生,导致炎症级联的放大,加剧器官的炎症损伤[15]。IL‑6 是诱导和维持炎症的关键细胞因子,可以由巨噬细胞在组织损伤时释放,IL‑6 高表达可以促进全身性的炎症反应[16]。本研究,槲皮素明显降低TP53、TNF‑α、AKT1、VEGF‑A、IL‑1β 和IL‑6 的表达水平,表明槲皮素可能是通过抑制细胞凋亡、细胞自噬、氧化应激、炎症反应干预IBS‑D。
KEGG 途径富集分析显示MAPK、PI3K‑Akt 和TNF 信号通路可能是槲皮素作用IBS‑D 发展中起主要作用的途径。MAPK 通路已被证实是IBS‑D发展中的重要途径,可以发挥调节IBS 大鼠模型中免疫相关分子的分泌和镇痛作用[17]。此外MAPK的抑制剂可以有效缓解动物模型中的炎症和神经性疼痛[18]。研究表明,PI3K/Akt 信号在细胞的凋亡和自噬过程中有重要作用[19]。据报道,PI3K‑Akt 通路激活自噬破坏肠黏膜屏障,导致IBS 症候群的发生,抑制PI3K‑Akt 通路能够保护肠上皮细胞,改善肠黏膜屏障[20]。先前的研究也表明,抑制PI3K/AKT 信号通路可降低IBS‑D 小鼠的内脏敏感性,改善IBS‑D 症候群[21]。TNF 信号通路控制免疫系统的发育,细胞存活信号通路,增殖并调节代谢过程[22]。HOU 等人发现,抑制TNF 通路诱导的炎症信号可以保护肠上皮紧密连接并修复IBS‑D 对肠上皮屏障造成的损害[23]。遗憾的是,本研究没有对MAPK、PI3K‑Akt 和TNF 信号通路进行实验验证,希望后续可以展开研究。
综上所述,本研究采用网络药理学方法揭示了槲皮素治疗IBS‑D 的关键靶点及作用通路,实验验证了槲皮素作用于TP53、TNF‑α、AKT1、VEGF‑A、IL‑6 等关键靶点调节炎症反应、氧化应激、细胞自噬等途径,发挥治疗IBS‑D 的作用。
作者贡献度说明:
冯敏超、谢胜:构思并设计了该研究和实验;罗芳、谭瑾轩:负责数据收集处理及文章撰写;王道刚、陈祖民、李凯、陈国忠:负责实验思路及最终文章的修改。
所有作者声明不存在利益冲突关系。

