Hsa⁃miR⁃155⁃3p 和hsa⁃miR⁃155⁃5p 作为系统性硬化症生物标志物及调控生物学行为的研究
王宝玥,孙晓林,王永福
(1.内蒙古科技大学包头医学院,内蒙古 包头 014010;2.内蒙古科技大学包头医学院第一附属医院风湿免疫科,内蒙古 包头014010)
系统性硬化症(systemic sclerosis,SSc)是一种由遗传、环境等多种因素引起的风湿性疾病[1]。目前尚未完全明确 SSc 的发病机制,但有大量研究表明免疫紊乱、内皮功能障碍和促纤维化机制之间的相互作用是 SSc 发病的常见原因[2]。在 SSc 中,肌成纤维细胞活化会引起大量的细胞外基质沉积在皮肤、内脏等器官,而肺纤维化的出现是导致其高死亡率的重要原因[3]。因此,寻找新的预测标志物探索SSc 的发生、发展,可能会成为治疗SSc 的新方向。
微小 RNA(microRNA,miRNA)是一种可调控基因表达的非编码RNA,通过与靶mRNA 互补位点结合,促进mRNA 降解或抑制其表达[4]。成熟miRNA 由两条链组成,是经过miRNA 前体(pre‑miRNA)的5′端臂和3′端臂加工后得来的,因此命名为“‑5p”和“‑3p”[5]。越来越多的证据表明,miR‑155 可调控疾病的免疫紊乱、纤维化、炎症等过程[6‑8]。在SSc 真皮和肺成纤维细胞中,NOD 样受体热蛋白结构域相关蛋白 3(NOD‑like receptor thermal protein domain associated protein 3, NL‑RP3)可通过上调miR‑155 的表达,诱导胶原蛋白的合成,促进SSc 纤维化[9]。此外,干扰 miR‑155 的表达,可以抑制Wnt/β‑catenin 连环蛋白和Akt 途径,导致 SSc 小鼠模型皮肤纤维化程度减轻[10]。这些表明 miR‑155 在SSc 中的作用十分重要,但是miR‑155 能否作为 SSc 临床诊断的生物标志物仍有待探索。
因此,本研究通过检测hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 在SSc 患者与健康对照者PBMCs中的表达水平,分析其与SSc 临床数据的相关性,探讨其作为SSc 诊断标志物的可能性。此外,本研究还利用生物信息学方法分析了hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 的 靶 基 因 ,进 一 步 探 究hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 在SSc 中的作用机制。
1 资料与方法
1.1 研究对象
从内蒙古科技大学包头医学院第一附属医院风湿免疫科和体检科分别选取10 例SSc 患者和10例年龄性别相匹配的健康对照者的全血。纳入标准:(1)年龄≥18 岁;(2)男性或者未妊娠女性;(3)确诊系统性硬化症疾病;(4)可完成基本的交流与沟通,自愿参加并签署知情同意书。排除标准:(1)年龄<18 岁;(2)合并严重感染的患者;(3)合并恶性肿瘤或既往有恶性肿瘤病史的患者;(4)具有其他各种研究者认为不能加入此临床试验的情况。
SSc 的诊断均符合2013 年美国风湿病学会(American college of rheumatology,ACR)/欧洲抗风湿病联盟(European league against rheumatism,EULAR) SSc 分类标准[11]。对照组中男性3 例,女性7 例;年龄31~67 岁,平均(54.30±13.26)岁;体质量指数20~25 kg/m2,平均(21.26±0.77)kg/m2。SSc 组中男性3 例,女性7 例;年龄 33~70 岁,平均(56.20±12.09)岁;体质量指数20~25 kg/m2,平均(21.76±0.98) kg/m2。对照组和SSc 组的性别、年龄和体质量指数比较,差异均无统计学意义(P>0.05),具有可比性。本研究获得本院医学伦理委员会批准,医院伦理批号:包医伦理2022 第 (106) 号。外周血标本的获取经过了所有患者的知情同意。
1.2 实验材料
人外周血淋巴细胞分离液(天津灏洋生物制品科技有限公司);Trizol (美国Themor Fisher 公司);氯仿(上海西格玛奥德里奇);异丙醇(北京索莱宝);70%乙醇(天津欧博凯);RNase Free(北京索莱宝);miRNA cDNA 第一链合成(茎环法)试剂盒(上海生工);RT‑PCR kit 试剂盒、SYBR Green Re‑altime PCR Master Mix(日本东洋纺生物科技有限公司);荧光定量PCR 仪(ABI 公司)。
1.3 方法
1.3.1 实验室资料收集 包括高分辨率CT(HRCT)、肺活量占预计值百分比(VC%)、用力肺活量预计值百分比(FVC%)、第1 秒用力呼气容积占预计值百分比(FEVl%)、血沉(ESR)、淋巴细胞百分比(LYM%)、中性粒细胞百分比(NEUT%)、白蛋白(ALB)、球蛋白(GLB)、白球比(ALB/GLB)等临床指标。
1.3.2 PBMCs 及RNA 提取 收取全血2 mL,移入胶皮管中,并向管中加入2 mL 生理盐水,缓慢混匀。抽取混匀的全血,放入盛有2 mL 淋巴细胞分离液的胶皮管中,2 000 r/min,离心22 min。抽取中间层PBMCs 之后,放置到盛有3 mL 的生理盐水的胶皮管中混匀,1 500 r/min 离心7 min。将上清倒出,再加入3 mL 生理盐水混匀,1 500 r/min 离心4 min。最后倒出上清,加入Trizol 1 mL 混匀,室温放置5 min,加入0.2 mL 氯仿,剧烈摇荡15 s,静置5 min,12 000 r/min 离心5 min。取上清液放入一个新的离心管,加0.5 mL 异丙醇,剧烈摇荡,4 ℃,12 000 r/min 离心10 min。弃上清,加入1 mL 70%乙醇,4 ℃,7 500 r/min 离心5 min。弃上清,然后室温干燥5~10 min,加入30 μL RNase Free 的水中,取2 μL 进行电泳检测。
1.3.3 实时荧光定量PCR(Real‑time Quantitative PCR, RT‑qPCR)检测miRNA 的表达水平 利用Trizol 试剂提取人PBMCs 中的总RNA,检测人PBMCs 中的hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 的表达水平。使用 ReverTra Ace qPCR RT Kit 试剂盒将 1 μg 总 RNA 反转录为 cDNA,将制备好的cDNA 进行 PCR 扩增,反应条件为:95 ℃,1 min,1 cycle;95 ℃,15 s,40 cycles;60 ℃,30 s。通过2‑△△Ct方法分析数据。本研究中使用的引物序列见表1。

表1 hsa⁃miR⁃155⁃3p 和hsa⁃miR⁃155⁃5p 引物序列Tab 1 Primer sequences of hsa⁃miR⁃155⁃3p and hsa⁃miR⁃155⁃5p
1.3.4 miRNA 与临床数据的相关性分析 使用IBM SPSS 26.0 和GraphPad Prism8.0.2 分析miR‑NA 与HRCT、VC% 、FVC% 、FEVl% 、ESR、LYM%、NEUT%、ALB、GLB、ALB/GLB 等临床数据之间的相关性,然后绘制用于诊断SSc 的受试者操作特征曲线(receiver operating characteristic curve,ROC)。
1.3.5 miRNA 的靶基因预测 采用miRDIP(http://ophid.utoronto.ca/mirDIP/) 、 miRDB(http://www.mirdb.org/)和TargetScan(https://www.targetscan.org/)3 个在线数据库预测miR‑155‑3p 和 miR‑155‑5p 的靶基因,使用在线工具VENNY 2.1.0(http://bioinfogp.cnb.csic.es/tools/venny/index.html)得到3 个数据库预测结果的交集。
1.3.6 miRNA 的靶基因GO 功能注释和KEGG Pathway 富集分析 通过David(https://david.ncif‑crf.gov/tools.jsp)和kobas(http://kobas.cbi.pku.edu.cn/index.php)在线网站对靶基因进行基因本体(geneontology,GO)功能注释和京都基因与基因组百科全书(Kyoto Encylopaedia of Genes and Ge‑nomes,KEGG)Pathway 富集分析,并利用微生信(http://www.bioinformatics.com.cn/)绘制GO 和KEGG 通路图。GO 分析包括生物过程(biological process,BP)、细胞成分(cellur component,CC)和分子功能(molecular function,MF),P<0.05 差异具有统计学意义。
1.3.7 蛋白质‑蛋白质相互作用(protein‑protein inter‑action,PPI)网络的构建以及核心(Hub)基因的筛选 在String 网站(https://www.string‑db.org/)构建miRNA 靶基因PPI 相互作用网络,选择基因相互作用置信度得分≥0.4 的数据,利用cyto‑scape 软件3.9.1 构建可视化的PPI 网络。选择cyto‑scape 软件中cytoHubba 插件最大团中心性 (maxi‑mal clique centrality,MCC )、最大邻域分量 (maxi‑mum neighborhood component,MNC )、连通性(De‑gree)筛选中心基因。
1.4 统计学处理
通过IBM SPSS 26.0 和GraphPad Prism8.0.2进行数据分析。符合正态分布的数据用(±s) 表示,两组间比较采用配对样本t检验,多组间比较采用单因素方差分析。当相关分析的数据为线性且符合正态分布时,使用Pearson 相关分析;否则,使用Spearman 相关性分析。诊断试验ROC 判断miR‑NA 的诊断价值。P<0.05 为具有统计学意义。
2 结果
2.1 SSc 患者PBMCs 中hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 的表达上调
采用 RT‑qPCR 检测SSc 患者和健康对照人群PBMCs 中 hsa‑miR‑155‑3p 和 hsa‑miR‑155‑5p 的表 达水平,结果显示:hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 在SSc 患者 PBMCs 中的表达水平显著高于健康对照人群(P<0.05),见图1。
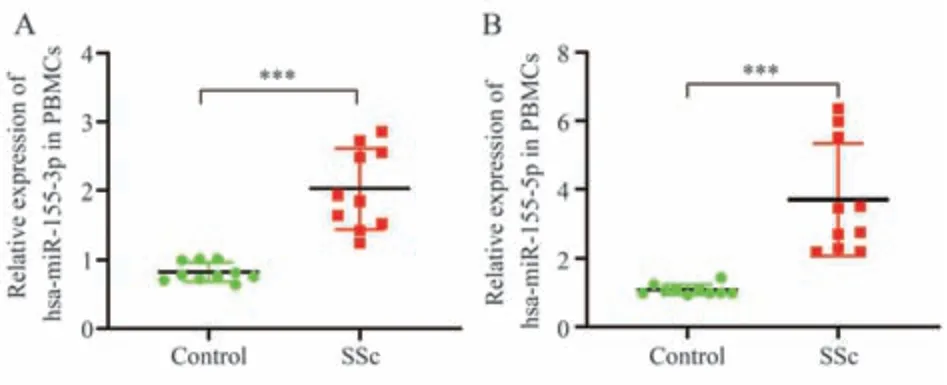
图1 RT‑qPCR 验证SSc PBMCs 中hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 表达水平(n=10)Fig 1 RT⁃qPCR validation of hsa⁃miR⁃155⁃3p and hsa⁃miR⁃155⁃5p expression levels in SSc PBMCs(n=10)
2.2 hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 对SSc 的诊断价值
ROC 曲线显示,hsa‑miR‑155‑3p(AUC=1,P=0.000 2) 、hsa‑miR‑155‑5p(AUC=1,P= 0.000 2),表明hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 可能在SSc 的临床诊断中发挥重要作用,见图2。
蒸散发(ET)是地球水文循环以及能量转换中的一个重要环节(Shan et al.,2015;Wang et al.,2017),它联系着陆地生态系统能量和水量平衡过程(Wever et al.,2002),在水资源管理以及有效利用等方面具有重要意义。然而,由于影响ET的变量较多且复杂,导致精准计算蒸散发仍存在较大难题。在研究中,常考虑采用参考蒸散发作为衡量蒸散发的重要参数(ET0)(郝振纯等,2013),Allen et al.(1998)将其定义为生长一致,水分充足,作物高度为0.12 m,灌层阻力为70 m·s-1,反照率为0.23,完全覆盖地面的绿色草丛植被。

图2 hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 独立诊断SSc 的ROC 曲线分析Fig 2 ROC curve analysis of hsa⁃miR⁃155⁃3p and hsa⁃miR⁃155⁃5p independent diagnosis of SSc
2.3 hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 和临床数据相关性分析
为了进一步明确 hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 能否作为SSc 诊断标志物,利用相关性分析分析了miRNA 与SSc 患者临床数据的相关性。结果显示:hsa‑miR‑155‑3p 和高分辨率CT(HRCT)、中性粒细胞百分比(NEUT%)、红细胞分布宽度标准差(RDW‑SD)、血小板体积分布宽度(PDW)、球蛋白(GLB)正相关,和淋巴细胞百分比(LYM%)、血小板比积(PCT)、白球比(ALB/GLB)负相关(P<0.05)。 hsa‑miR‑155‑5p 和HRCT、NEUT% 、RDW‑SD、红细胞分布宽度变异系数(RDW‑CV)、PDW、GLB 正相关,和肺活量占预计值百分比(VC%)、用力肺活量占预计值百分比(FVC%)、第1 秒用力呼气容积占预计值百分比(FEVl%)、淋巴细胞绝对值(LYM#)、LYM%、PCT、ALB/GLB 负相关(P<0.05),见图3。
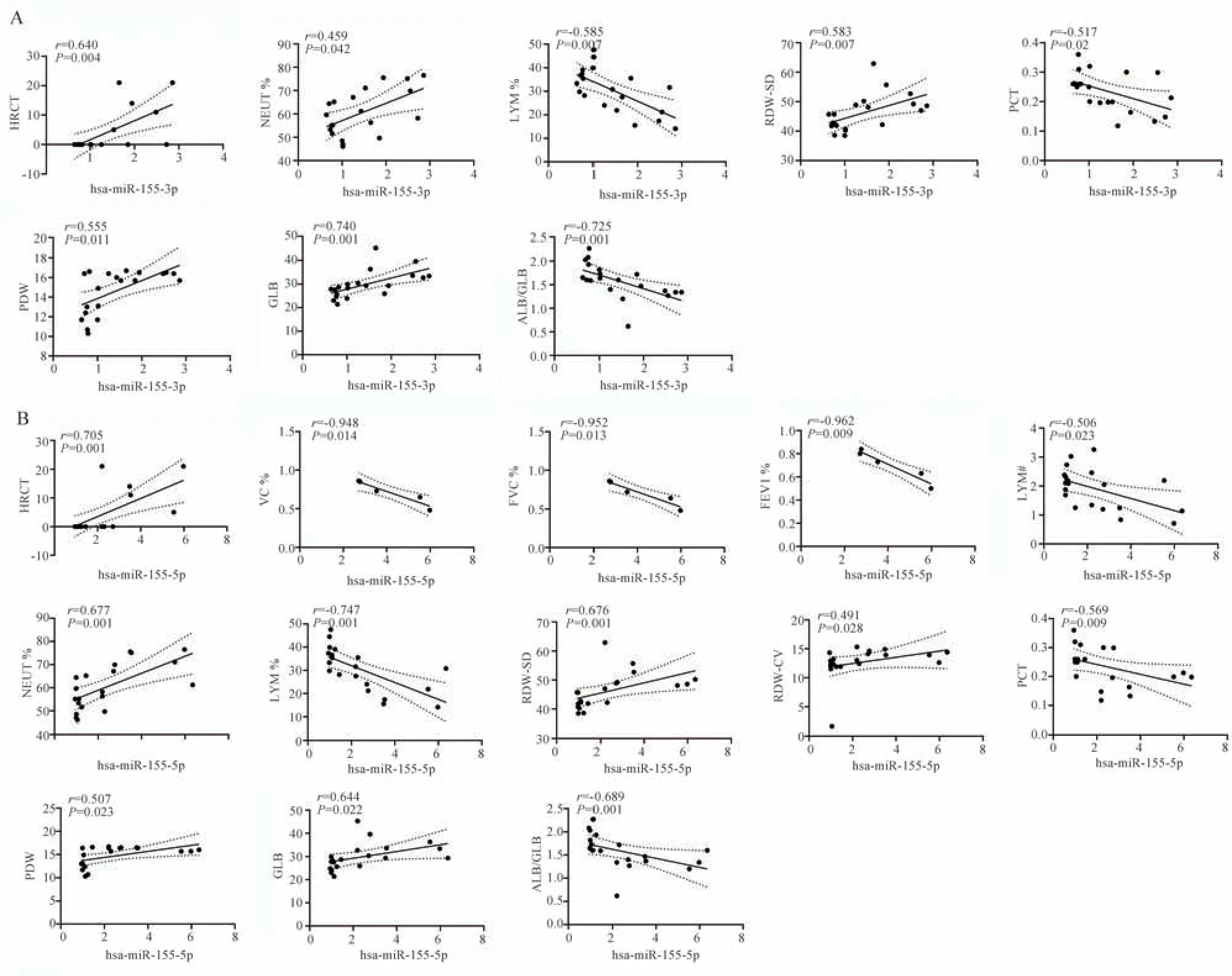
图3 hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 和 SSc 临床数据相关性分析Fig 3 Correlation analysis of clinical data for hsa⁃miR⁃155⁃3p, hsa⁃miR⁃155⁃5p and SSc
2.4 hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 的靶基因预测结果
miRDIP、miRDB、TargetScan 3 个在线数据库预测 hsa‑miR‑155‑3p 的靶基因个数分别是724、422、2 956,取交集后得到预测靶基因309 个;预测hsa‑miR‑155‑5p 的靶基因个数分别是977、234、556,取交集后得到预测靶基因121 个,见图4。

图4 hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 的靶基因预测结果Fig 4 Target gene prediction results for hsa⁃miR⁃155⁃3p and hsa⁃miR⁃155⁃5p
2.5 hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 的靶基因GO和KEGG 分析
将 hsa‑miR‑155‑3p 预测的 309 个基因和hsa‑miR‑155‑5p 预测的121 个基因进行GO 分析,BP 显示靶基因主要富集在RNA 聚合酶 Ⅱ 启动子的转录调控、DNA 触发的转录调控、基因表达的调控等方面; CC 显示靶基因主要富集在细胞核、细胞质、染色质等方面;MF 显示靶基因主要富集在RNA 聚合酶Ⅱ转录调控区DNA 序列特异性结合、蛋白质结合、DNA 结合等方面,见图5。KEGG 分析显示,hsa‑miR‑155‑3p 靶基因显著富集的Wnt 信号通路、FoxO 信号通路、TRP 通道、P53 信号通路以及hsa‑miR‑155‑5p 靶基因显著富集的IL‑17 信号通路、MAPK 信号通路、TNF 信号通路、T、B 细胞受体信号通路、Toll 样受体信号通路、PI3K‑AKT 信号通路、NF‑κB 信号通路、NOD 样受体信号通路、FoxO 信号通路和SSc 纤维化、免疫、炎症的发生发展密切相关,见图6。
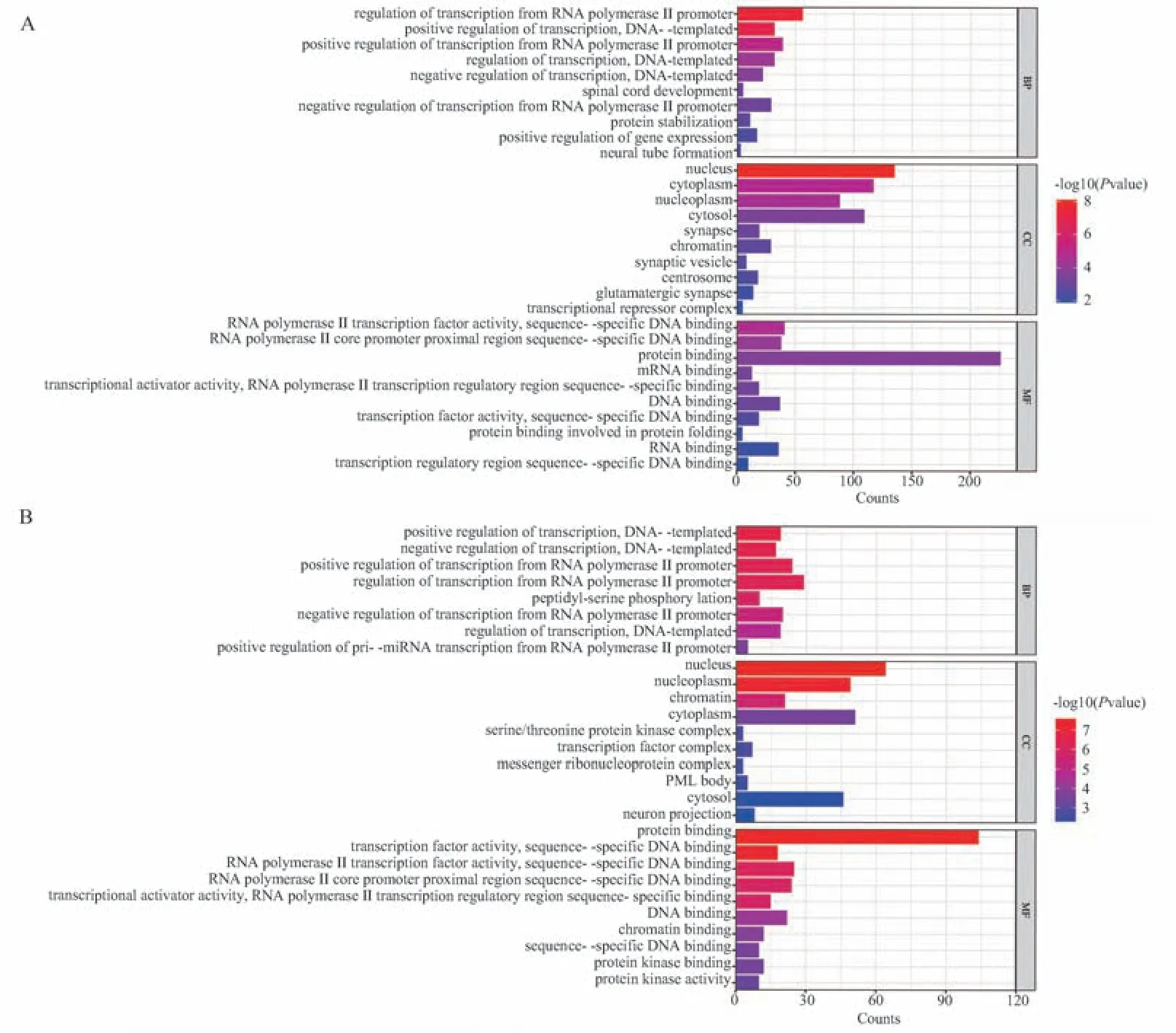
图5 hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 的靶基因GO 分析条形图Fig 5 Bar graph of GO analysis of target genes of hsa⁃miR⁃155⁃3p and hsa⁃miR⁃155⁃5p
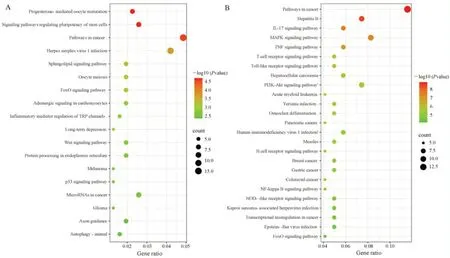
图6 hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 的靶基因KEGG Pathway 气泡图Fig 6 KEGG Pathway bubble map of target genes of hsa⁃miR⁃155⁃3p and hsa⁃miR⁃155⁃5p
2.6 PPI 网络和Hub 基因的构建
通 过 String 在 线 网 站 分 别 建 立 了hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 靶基因的PPI 网络,见图7、8。然后利用Cytoscape 软件中的cyto‑Hubba 插件MCC、MNC、Degree 三种算法筛选前5个Hub 基因,并通过绘制韦恩图选择交集基因,结果显示hsa‑miR‑155‑3p 的关键靶基因为SMAD4、HSP90AA1、MAPK14,hsa‑miR‑155‑5p的关键靶基因为FOS、SMARCA4、SMAD2、KRAS,这些靶基因可能在SSc 的发病机制中发挥重要作用,见图9。
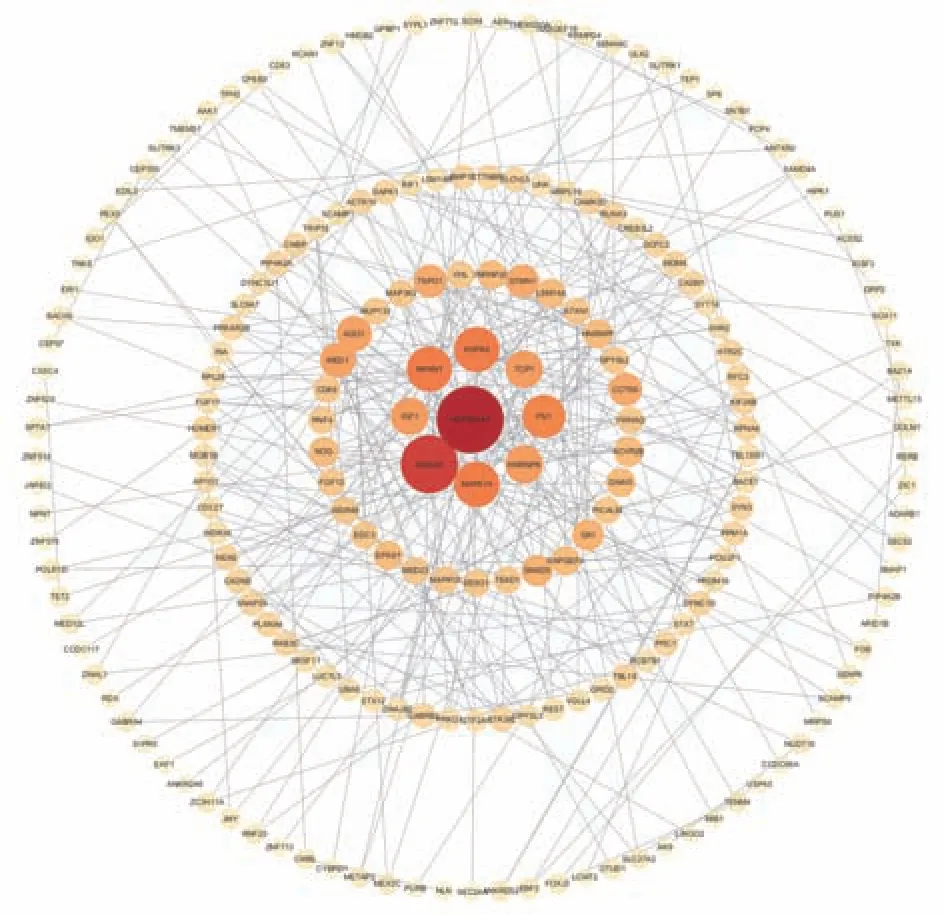
图7 hsa‑miR‑155‑3p 靶基因的PPI 网络Fig 7 PPI network of hsa⁃miR⁃155⁃3p target genes

图8 hsa‑miR‑155‑5p 靶基因的PPI 网络Fig 8 PPI network of hsa⁃miR⁃155⁃5p target genes
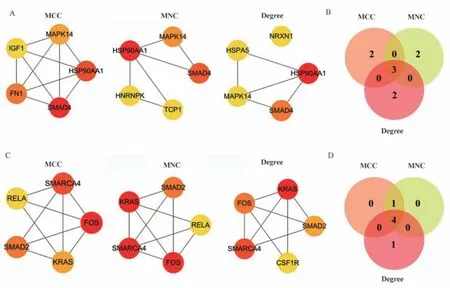
图9 hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 关键靶基因的筛选Fig 9 Screening of hsa⁃miR⁃155⁃3p and hsa⁃miR⁃155⁃5p key target genes
3 讨论
SSc 是一种罕见的、多器官受累并且预后差的免疫异常疾病,该病的治疗面临着很大困难,而寻找有效的治疗方法是目前需要解决的问题。最近关于疾病潜在生物标志物的研究越来越多,生物标志物的出现为疾病的诊断和治疗带来了新的突破口,不仅可在早期发现一些高风险人群,后期也可根据疾病严重程度指导治疗,改善患者的预后。因此,探寻 SSc 中有价值的生物标志物是当前研究的一个热点。
miRNAs 作为生物标志物的研究已经多次报道,在自身抗体阳性但无症状的直系亲属和类风湿关节炎(rheumatoid arthritis,RA) 患者中,miR‑103a‑3p 的表达水平明显增加,这表明其可能作为高危个体中即将发生RA 的潜在生物标志物[12]。在抗拓扑异构酶(抗SCL70)抗体阳性的SSc患者中,miR‑27a 的表达水平明显低于抗体阴性患者,由于该抗体与疾病的严重程度具有相关性,表明 miR‑27a 可能作为评估疾病进展的潜在标志物[13]。Niu 等[14]在探讨 miR‑155 对肝硬化的影响时发现,miR‑155 的表达在肝功能Child‑Pugh C 级的患者中显著上调;同时,与miR‑155 低表达的肝移植患者相比,高表达患者肝移植后的生存时间缩短,提示miR‑155 与肝硬化的进展以及临床预后密切相关。Wajda 等[15]研究证实,与健康对照人群相比,miR‑155 在SSc 患者血清中的表达显著上调,高表达的miR‑155 可能与SSc 早期微血管病变有关。本研究中发现SSc 患者PBMCs 中hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 的表达水平明显高于健康对照者,并且 ROC 诊断实验发现 hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 的曲线下面积(areaunderthecurve,AUC)均为1,表明高表达的hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 对SSc 的诊断和治疗具有重要意义。
肺功能检查同样是诊断肺纤维化的一个必备项目,既可以了解肺通气与弥散功能,其动态演变还能反映肺纤维化的进展和预后[20]。肺纤维化中的顺应性降低导致肺容量偏低,表现为VC、FVC、FEV1 和肺总容量(TLC)的降低[21]。Christmann等[22]研究发现,在 SSc 合并间质性肺病患者的PBMCs 中miR‑155 表达与FVC%、肺一氧化碳弥散量占预计值百分比(DLCO%)呈负相关,提示miR‑155 可能影响呼吸功能并加重肺纤维化的进展。本研究同样发现hsa‑miR‑155‑5p 的表达水平和肺功能指标中VC%、FVC%、FEV1%呈负相关,同时hsa‑miR‑155‑5p 的表达水平也与HRCT 评分正相关,这些表明 hsa‑miR‑155‑5p 可能作为监测SSc合并间质性肺病以及评估疾病严重性的潜在生物标志物。
miR‑155 已被证实是炎症反应的主要调节因子,在烟雾吸入诱导的急性肺损伤中,miR‑155 可促进中性粒细胞的活化及募集,导致肺部炎症加重[23]。在动脉粥样硬化的小鼠模型中,活化的中性粒细胞释放的微囊泡中存在大量的miR‑155,而含有miR‑155 的微囊泡可粘附在疾病的易发区域,促进核因子κB(nuclear factor kappa‑B,NF‑κB)的表达,进而加剧动脉粥样硬化的形成[24]。本研究中hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 的表达水平和NEUT%呈正相关,进一步说明hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 可能与中性粒细胞一样,可作为反应SSc 炎症情况的临床指标。
淋巴细胞亚群异常是导致SSc 免疫紊乱的常见原因,Guo 等[25]研究表明,与健康对照者相比,SSc患者外周血中的 T 细胞总数明显减低,并且外周T细胞、CD4+T 细胞、调节性T 细胞(regulatory cells,Tregs)和Th1/Th2 的比值均和CRP 呈负相关。Gernert 等[26]研究也证明,在未使用免疫抑制的 SSc患者中,外周血B 细胞和T 细胞数量同样低于健康对照者。而Ma 等[27]研究指出,淋巴细胞数量的过度减少可引起SSc 疾病活动度加重,以及增加器官受累的风险。 本研究发现hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 的表达和LYM%呈负相关,说明hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 可作为监测SSc淋巴细胞的临床指标,评估SSc 的疾病进展。
RDW 是诊断贫血的一个常规指标,但有多项研究证实,RDW 还可作为影响疾病预后的独立危险因素[28,29]。在结缔组织病相关肺动脉高压患者中,RDW 数值越高,患者的预后越差[30]。此外,RDW 可作为预测 SSc 合并肺动脉高压的临床指标[31]。及时发现危险因素和新的生物标志物,有助于SSc 进行早期治疗,从而改善预后,而本研究中hsa‑miR‑155‑3p、 hsa‑miR‑155‑5p 的 表 达 和RDW‑SD 呈正相关,表明SSc 的预后也可通过hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 表达水平反应。
有研究报道,血小板可以通过刺激促炎物质在炎症中发挥重要作用[32]。PDW 可反应血小板的大小差异,并且和血小板的活化相关[33]。PCT 是指血小板在全血中所占容积的比例。Yu 等[34]研究表明PDW 可作为预测狼疮性肾炎的标志物。Oral 等[35]发现PCT 可作为早期检测非酒精性脂肪肝炎的有用生物标志物。 本研究中hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 的表达和PDW 呈正相关,和PCT呈 负 相 关 ,再 次 说 明 hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 是SSc 发生炎症的影响因素。
ALB 是血浆中含量最多的蛋白,是评估营养不良的指标之一,而最近研究发现ALB 与炎症反应呈负相关,可作为炎症的潜在生物标志[36]。GLB 的升高同样与炎症相关,其中ALB/ GLB 是炎症中有希望的生物标志物,较高水平的ALB/GLB 与心衰患者的良好预后显著相关[37]。本研究中同样发现hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 的表达和GLB 呈正相关,和ALB/GLB 呈负相关,说明高表达的hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 可作为监测SSc 炎症的潜在生物标志。
miRNA 可与其靶基因互作参与调控多种疾病的生物学过程。 通过预测hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 靶基因,并探索靶基因的功能,可以更清楚的理解miRNA 在SSc 中的具体作用机制,为后续的诊断和治疗提供可靠的参考依据。本研究中依据hsa‑miR‑155‑3p、hsa‑miR‑155‑5p 靶基因GO 功能注释结果,发现这些基因与基因表达的调控、蛋白质的合成等过程密切相关。KEGG 分析结果显示hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 靶基因富集的信号通路广泛参与免疫、炎症、纤维化、肿瘤等生物过程。进一步分析hsa‑miR‑155‑3p 关键靶基因,最终得到SMAD4、HSP90AA1、MAPK143 个中心基因,其中SMAD4是参与Wnt、 FoxO 信号通路的基因,MAPK14是参与FoxO 信号通路的基因。hsa‑miR‑155‑5p 的关键靶基因为FOS、SMARCA4、SMAD2、KRAS,其中FOS是参与IL‑17、 TNF、MAPK、Toll 样受体、T、B 细胞信号通路的基因,KRAS是参与MAPK、T、B 细胞信通路的基因。
SMAD4 和SMAD2 是转化生长因子‑β(trans‑forming growth factor‑β,TGF‑β)通路的信号转导分子,TGF‑β/SMAD 信号通路可引起细胞外基质过度沉积并导致疾病纤维化的形成[38]。在博莱霉素诱导的肺纤维化小鼠中,银杏酸可能通过抑制TGF‑β1 诱导的 SMAD4 泛素化修饰,减少活性氧的 产 生 ,从 而 抑 制 上 皮‑间 充 质 转 化(epithelial‑mesenchymal transition,EMT),最终改善肺纤维化[39]。Jiang 等[40]研究表明,果胶多糖通过抑制TGF‑β /Smad2/3 信号传导,减弱肌成纤维细胞活化,减少胶原蛋白的表达,改善SSc 模型小鼠肺纤维化。MAPK14 是p38MAPK 家族的一种亚型,在细胞增殖、凋亡、衰老和炎症等多种过程中发挥作用[41]。有研究表明,LncRNA XIST 可通过调节miR‑12‑132p/MAPK14 轴促进脂多糖诱导的小鼠肺损伤[42]。据报道,FOS 与炎症、血管病变、肿瘤等多种病理过程有关[43,44]。此外,FOS 在组织纤维化中同样发挥重要作用,Xue 等[45]研究表明,miR‑29b‑3p 通过靶向FOS 抑制了TGF‑β1 诱导的心脏成纤维细胞增殖、迁移和分化,从而减轻了心脏纤维化。KRAS 是一种癌症相关的基因,但最近也有研究发现KRAS 与心衰患者纤维化的发生相关,并有可能作为诊断心力衰竭潜在生物标志物[46]。Yi 等[47]研究发现,CircRNA_30032 通过靶向miR‑96‑5p,促进KRAS 的表达,导致单侧输尿管梗阻模型小鼠的肾纤维化。上述这些靶基因参与了疾病纤维化的发展,因此hsa‑miR‑155‑3p 和hsa‑miR‑155‑5p 有可能通过调控上述靶基因,参与SSc 的发病过程。
综上所述,hsa‑miR‑155‑3p 及hsa‑miR‑155‑5p可能参与了调节SSc 纤维化、免疫、炎症的发生、发展,hsa‑miR‑155‑3p 及hsa‑miR‑155‑5p 有可能作为SSc 临床诊断和治疗的潜在生物标志物。但该研究样本量较少,具有局限性,后续还需更多的样本和临床资料来支持这一观点。
作者贡献度说明:
王永福:实验设计,文章修改;孙晓林:数据及图片整理,文章修改;王宝玥:数据收集、分析、文章撰写。
所有作者声明不存在利益冲突关系。

