基于网络药理学探讨健胃清肠合剂治疗急性胰腺炎作用机制
赵世伟 ,李生财 ,漆利红
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中医院,甘肃 兰州 730000
急性胰腺炎(acute pancreatitis,AP)是临床常见的急腹症,发病急骤,病情变化快,根据严重程度可分为轻症AP、中重症AP和重症AP,严重者可并发全身炎症反应综合征和多器官功能衰竭,甚至危及患者生命安全[1]。目前,西医治疗AP主要采用液体复苏、对症和支持治疗等方法,尚未有针对性药物,临床应用胰酶抑制剂和生长抑素的治疗价值还需验证,抗生素的使用也存在争议[2-3]。
AP属中医学“腹痛”“脾心痛”范畴,临床多属里、实、热证,治疗以通里攻下法应用多且效果显著[4-5]。健胃清肠合剂是由甘肃省中医院廖志峰研制的院内制剂,其组成为大黄、木香、枳壳、黄连、槟榔、元明粉,有通腑泄热、清热解毒、通里攻下功用。前期实验表明,其能降低肠梗阻模型大鼠血清中白细胞介素(IL)-6、IL-10水平,减轻炎症反应[6],临床应用表明,其联合生长抑素较单独使用生长抑素能更快缩短AP合并肠梗阻患者病程[7-8]。可见,本方可能对AP及其并发症有一定的治疗作用。本文通过网络药理学筛选健胃清肠合剂活性成分,分析其治疗AP的主要靶点和信号通路,从分子层面解释其药理作用机制,为后续相关研究提供基础。
1 资料与方法
1.1 健胃清肠合剂活性成分筛选与靶点预测
检索TCMSP数据库(https://www.tcmsp-e.com/),结合文献收集方中大黄、木香、枳壳、槟榔、黄连、元明粉的活性成分。其中元明粉在HERB(http://herb.ac.cn/)及TCMSP数据库中检索,根据口服生物利用度(OB)≥30%且类药性(DL)≥0.18筛选活性成分,获得健胃清肠合剂活性成分及靶点,通过UniProt数据库(https://www.uniprot.org)将靶点信息标准化处理。
1.2 急性胰腺炎相关靶点筛选
在GeneCards 数据库(https://www.genecards.org/)、OMIM数据库(https://www.omim.org/)中以关键词“Acute Pancreatitis”进行检索,汇总整理疾病靶点信息。在DrugBank数据库(https://www.drugbank.ca/)中检索收集治疗AP相关上市药物的靶点。将以上检索结果合并,去除重复值,获得AP相关靶点。
1.3 药物-疾病靶点网络及蛋白相互作用网络构建
使用Venny 平台(https://bioinfogp.cnb.csic.es/tools/venny/)将药物活性成分靶点与疾病潜在靶点进行映射,并绘制韦恩图。将交集靶点导入STRING数据库(https://string-db.org/),将蛋白质种类设置为“Homo sapiens”, 最小互作用阈值为“highest confidence>0.9”,构建蛋白相互作用(PPI)网络。
1.4 GO功能和KEGG通路富集分析
将药物-疾病靶点导入DAVID平台(https://david.ncifcrf.gov/)进行GO 功能和KEGG 通路富集分析,设置P<0.05,将结果上传微生信平台(http://www.bioinformatics.com.cn),并将排名前20位的条目绘图。
1.5 药物-成分-靶点-通路网络构建
应用Cytoscape3.9.1软件构建药物-成分-靶点-通路网络,应用Network Analyzer进行拓扑分析,计算节点度值、中介中心性和紧密中心性。分析健胃清肠合剂治疗AP的重要活性成分及核心靶点。
2 结果
2.1 健胃清肠合剂活性成分及靶点预测结果
全方共筛选得到活性成分37个(见表1),其中,大黄9个、木香5个、枳壳4个、黄连11个、槟榔7个,大黄、枳壳、元明粉共有1个成分,全方预测到靶点232个。药物-成分-靶点网络见图1。

图1 健胃清肠合剂药物-成分-靶点网络

表1 健胃清肠合剂活性成分
2.2 急性胰腺炎潜在靶点筛选
在GeneCards、OMIM、DrugBank数据库中分别得到1 193个、260个、6个疾病靶点,将其去重,用UniProt平台规范,获得1 360个AP潜在靶点。
2.3 蛋白相互作用网络构建
使用Venn平台将活性成分靶点与疾病靶点映射,获得123个交集靶点。将其导入STRING数据库,构建PPI网络(见图2),包含123个节点、526条边。
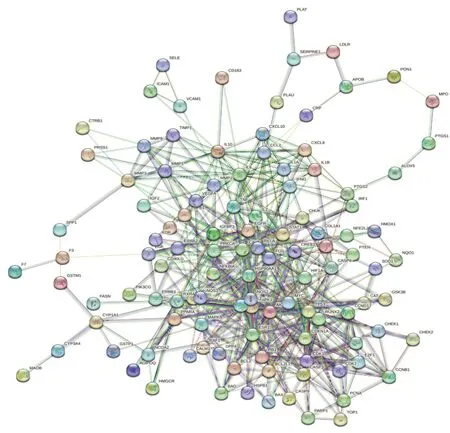
图2 健胃清肠合剂治疗AP靶点PPI网络
2.4 GO功能和KEGG通路富集分析
GO富集分析得到954条目,其中生物过程(BP)747条,涉及缺氧反应、基因表达、凋亡调控等;细胞组分(CC)81条,包括细胞成分、线粒体等;分子功能(MF)126条,涉及转录调节活性、酶结合等(见图3)。将123个药物-疾病交集靶点导入DAVID平台进行KEGG通路富集分析,以P<0.05为标准,得到174条信号通路,包括癌症、IL-17、TNF、PI3K-Akt等信号通路。排名前20位的信号通路见图4。
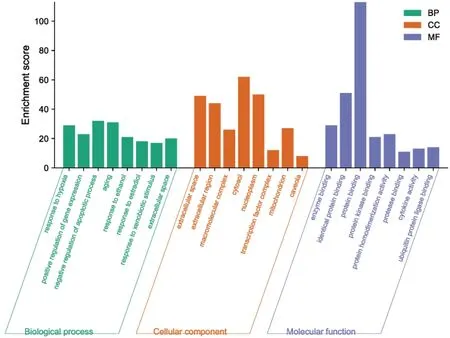
图3 健胃清肠合剂治疗AP靶点GO富集分析
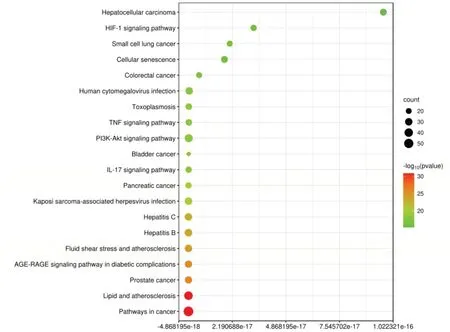
图4 健胃清肠合剂治疗AP靶点KEGG富集分析
2.5 药物-成分-靶点-通路网络构建
应用Cytoscape3.9.1软件构建药物-成分-靶点-通路网络,见图5,该网络共有280个节点、1 140个相互作用关系。根据degree 值筛选出前10 位活性成分,degree值越高,参与BP越多,据此可判断健胃清肠合剂治疗AP的关键活性成分及核心靶点(见表2)。
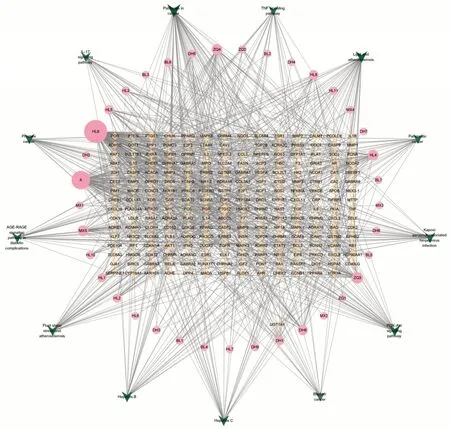
图5 健胃清肠合剂治疗AP药物-成分-靶点-通路网络
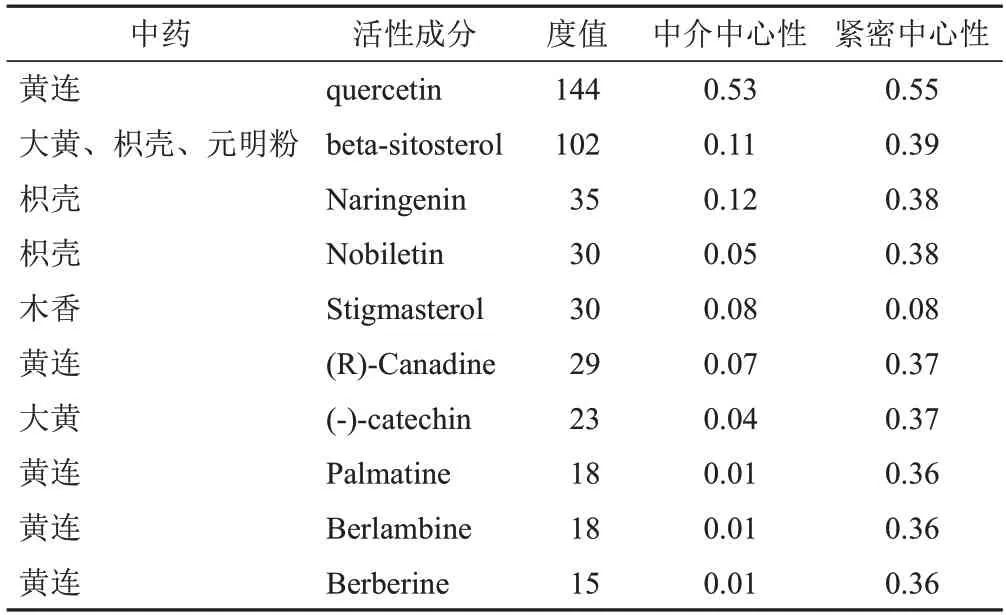
表2 健胃清肠合剂治疗AP关键活性成分
3 讨论
腑气不通是AP的基本病机[9],临床常以承气汤类方治疗,已有基础研究阐述其机制[10-11]。健胃清肠合剂是在承气方基础上加入健胃药,以达保胃气、存津液之效[12]。
本研究共挖掘出健胃清肠合剂活性成分37个,药物和疾病共同靶点123个,KEGG富集分析发现本方主要通过IL-17、TNF、PI3K-Akt、HIF-1信号通路治疗AP。IL-17信号通路与炎症发生密切相关,由Th17产生,IL-17可刺激中性粒细胞并进一步促进IL-6等促炎因子的表达[13-14]。同时,IL-6累积到一定水平会进一步促进Th17 分化,形成正反馈,加重AP 的炎症反应[15]。TNF信号通路在机体中有重要作用,可以调控细胞凋亡、免疫和炎症反应[16]。其中TNF-α可以激活NF-κB炎症核心因子,引发炎症联级反应[17]。PI3K-Akt信号通路可影响细胞生长和凋亡,通过调控该信号通路可有效减轻炎症反应,减少细胞凋亡[18-19]。HIF-1信号通路涉及缺氧、癌症、炎症等[20],还影响细胞自噬,低氧环境可激活NF-κB,从而影响炎症发生[21]。由此推测,健胃清肠合剂可通过相关信号通路调节炎症反应、影响细胞自噬与凋亡,以治疗AP。
从主要活性成分网络拓扑学分析结果得知,治疗AP主要包括槲皮素、β-谷甾醇、柚皮素等活性成分。研究表明,槲皮素有较好的抗炎作用,还可调节自噬功能、调控NF-κB 通路以减轻AP 造成的相关损伤[22-23]。β-谷甾醇有较好的抗炎作用,能影响IL-8、TNF-α表达及NLRP3激活。柚皮素可发挥在机体中抗菌消炎、抗损伤的作用。研究表明,柚皮素可通过长链非编码RNA途径减少炎症因子的产生,并可有效干预AP造成的心肌细胞损伤[24-25]。川陈皮素有较强的抗氧化功能,还可影响PI3K/AKT/mTOR信号通路的激活[26-28]。因此,槲皮素、β-谷甾醇、柚皮素、川陈皮素可能是治疗AP的关键活性成分,主要通过抑制炎症反应、影响相关自噬、调节细胞凋亡程序与信号通路干预AP造成的损伤。
分析健胃清肠合剂治疗AP的作用靶点,度值较高的PTGS2、HSP90AA1、PTGS1、MAPK1 均为治疗AP 常用靶点。PTSG1 和PTSG2 可参与机体炎症反应[29]。Zuehlke等[30]研究表明,HSP90AA1可诱导自噬的发生,抑制细胞凋亡。MAPK1可参与自噬,还可调控NF-κB影响炎症反应[31-32]。
综上所述,健胃清肠合剂能多成分、多通路、多靶点干预AP对机体造成的损伤。本研究为健胃清肠合剂后续研究及临床应用提供理论依据。但网络药理学受限于数据库更新限制,分析可能有偏差,也无法实现对健胃清肠合剂的浓度控制和检测。因此,本研究结果仍需要细胞实验和动物实验进行验证,才能为健胃清肠合剂治疗AP提供更客观的理论支撑。

