CNT-Fe/Zn 催化剂的制备及其催化臭氧氧化降解DBP
吴天翔,张翼飞,林 原,马思佳,王艳茹,任洪强,许 柯 (南京大学环境学院,污染控制与资源再利用国家重点实验室,江苏 南京 210023)
邻苯二甲酸二丁酯(DBP)是邻苯二甲酸酯类的一种,常用于杀虫剂、药物和增塑剂的制取,是环境中常见的内分泌干扰物[1],具有高毒性[2].DBP 由 2个甲酸丁酯取代苯环上2 个相邻的H 形成.DBP 为疏水性有机物且侧链较长,在pH 值为5~9 受pH 值变化的影响小,难降解,对生态环境和人类健康造成严重威胁[3-4].非均相催化臭氧氧化(HCO)技术是一种可以产生活性氧物种(ROS)如羟基自由基(·OH)从而显著提高臭氧利用率和有机物矿化率的高级氧化技术[5].然而,诸多因素限制了HCO 技术在实际中的应用,如pH 值、反应温度、臭氧用量和催化剂用量等[5-7].其中,pH 值是影响HCO 技术实际应用的关键因素[5,8].pH 值可以通过4 种方式影响HCO 的性能:(1)影响自由基的生成及其氧化能力.羟基自由基在酸性条件下的氧化能力比在碱性条件下更强[9];(2)改变催化剂表面零电荷点,导致对目标有机污染物的吸附等行为发生变化[10];(3)改变臭氧的稳定性.臭氧在碱性环境下的分解更快[5];(4)改变目标有机污染物的存在形式.例如,磺胺甲恶唑(SMX)在pH 值为1.97~6.16时以中性形式存在,而当pH值高于6.16时,SMX 以阴离子形式存在.近年来,学者们致力开发对pH 值不敏感的催化剂[11-16].在负载锌的碳纳米管和铜铁纳米颗粒的催化下,4-氯-3-甲基苯酚和DBP 在较宽的pH 值范围(3.0~9.0)内均表现出出色的去除率[17-18].
锌铁尖晶石具有良好的催化性能,同时具有一定pH 值适应性[19-20].已有研究使用MFe2O4(M=Cu、Zn、Ni、Co)催化臭氧氧化页岩气开采废水,四种催化剂在宽pH 值范围(5~9)下CODCr去除率相比单独臭氧都有明显的提升[21].但铁基尖晶石使用过程中金属离子的浸出会导致催化剂效率的大幅下降[22].近年来碳纳米管作为具有高催化活性的碳基材料被广泛应用,能够有效去除多种有机污染物,如有机酸[23]、酚类[24]和抗生素[25-27]等.此外,研究表明经表面酸化处理后的碳纳米管含氧基团浓度会大幅提升,这有利于金属离子的负载[25].因此,碳纳米管负载锌铁尖晶有望解决传统臭氧催化剂pH 值适应性差和铁基尖晶石金属离子浸出的问题.
本研究采用浸渍煅烧法制备了负载锌(CNTZn)、铁(CNT-Fe)和锌铁共掺杂(CNT-Fe/Zn)的多壁碳纳米管催化剂,通过BET、SEM、XRD 和XPS 等分析方法探究了催化剂的形貌特征和结构组成,对比研究了3 种催化剂催化臭氧氧化降解水体中DBP的效果和矿化程度,并揭示了该催化剂pH 值适应性和催化臭氧氧化DBP 的机理.
1 材料与方法
1.1 实验试剂
多壁碳纳米管购于渝时兴科技有限公司,羧基化碳纳米管购于美国NonoAmor 公司,邻苯二甲酸二丁酯购于美国Sigma 公司,无水醋酸钠、聚乙二醇、磷酸、叔丁醇和硫代硫酸钠购于南京化学试剂有限公司,盐酸、氢氧化钠、硝酸铁、硝酸锌、香豆素、硝酸、柠檬酸和磷酸钠购于国药集团化学试剂有限公司.
1.2 催化剂的制备
首先使用研钵将商业碳纳米管研磨为粉末,加入8mol/L 浓硝酸中130℃热浴,以100r/min 速度搅拌14h 后过0.22μm 滤膜,过膜后的样品用超纯水清洗至冲洗液pH 值不变,洗净冻干后得到预处理的碳纳米管CNTs-HNO3.将一定量的Zn(NO3)2·6H2O、Fe(NO3)3·9H2O 和柠檬酸混合于无水乙醇中,然后加入CNTs-HNO3,并于95℃水浴蒸发,干燥后加入尿素搅拌,最后将样品置于600 ℃的管式炉中通氮气煅烧8h,得到负载锌铁尖晶石的CNT-Fe/Zn 催化剂.CNT-Fe、CNT-Zn 催化剂制备过程中添加一种金属盐前驱体,CNT-C10H16O10Zn、CNT-ZnFe2O4和CNT-ZnO 催化剂制备过程中添加一种金属氧化物前驱体.
1.3 催化臭氧氧化实验
使用直径8cm、高30cm 的圆柱体有机玻璃进行催化臭氧氧化实验,采用孔径为5μm 的钛板微孔曝气头从底部曝气,反应时微气泡臭氧自下向上地充分和水溶液、催化剂接触并反应.
在一个典型的催化臭氧氧化实验中,向反应器中加入1L 的DBP 模拟溶液(4mg/L)和50mg 催化剂,并通入臭氧-氧气的混合气体(400mL/min).于催化臭氧氧化实验进行0,10,20,30min 时取样,并迅速加入200μL 的硫代硫酸钠(0.05mol/L)淬灭氧化性物种,取得的样品当天检测.反应结束后加入碘化钾消除残留的臭氧.使用HNO3(0.1mol/ L)和NaOH(0.1mol/L)调节溶液pH 值.实验均重复3 次.
1.4 催化剂的表征
使用RAPID II 型X-射线衍射仪(XRD)对催化剂的晶体结构进行表征.使用QUANTA 250FEG 型扫描电子显微镜(SEM)对催化剂的表面形貌进行表征.使用ASAP2020 型比表面积与孔分布分析仪(BET)测定催化剂的比表面积和孔隙.使用PHI 5000型X 射线光电子能谱仪(XPS)测定催化剂表面元素的元素组成和化学形态.
1.5 分析方法
使用BC-CL7685 臭氧检测仪检测液相中臭氧浓度;使用UV-2100 臭氧气体检测仪检测进出气臭氧浓度.使用高效液相色谱仪(Waters E2695,USA)测定DBP 的浓度[28],检测条件如下:使用体积比为8:2的甲醇和水作为流动相,流速1mL/min,进样量为80μL,紫外检测器波长230nm,柱温35℃,色谱柱使用CSH C18 色谱柱(5μm,4.6mm×150mm).采用Boehm滴定法[29]检测不同的含氧基团含量.·OH 会与香豆素剧烈反应生成具有荧光特性的7-羟基香豆素,使用酶标仪检测7-羟基香豆素的浓度进而计算·OH的瞬时浓度[9].采用紫外分光光度法测定水中过氧化氢(H2O2)浓度[13].
2 结果与讨论
2.1 催化臭氧氧化DBP 的优化研究
2.1.1 催化剂对催化臭氧氧化DBP 效果的影响 如图1 所示,反应30min 后,相较于单独臭氧,加入催化剂后DBP 的降解效率有明显提升,在6 种改性的碳纳米管中,CNT-Fe、CNT-Zn 和CNT-Fe/Zn3种以金属盐作为前驱体的催化剂催化性能优异,DBP的去除率比单独臭氧处理提高26.44%~51.42%.因此,后续实验采用CNT-Fe、CNT-Zn 和CNT-Fe/Zn 进行催化臭氧氧化DBP 的优化研究.
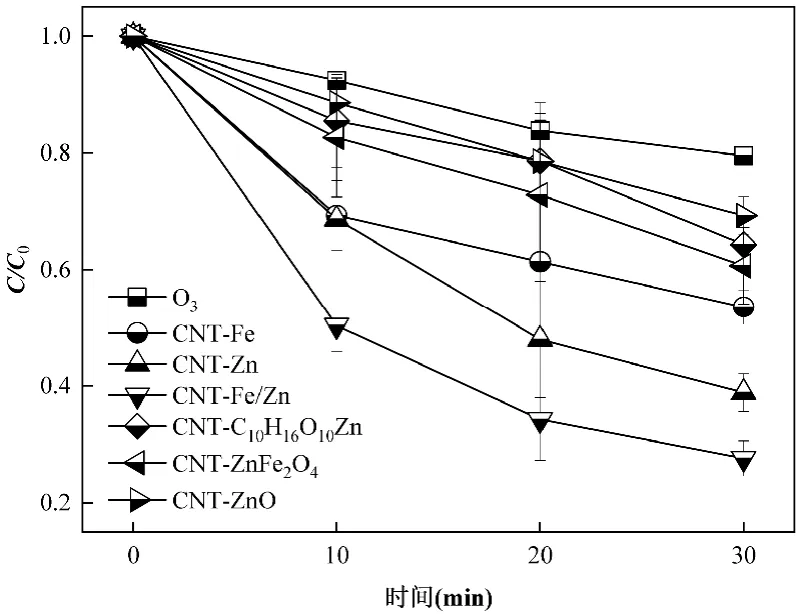
图1 不同催化剂对DBP 降解的影响Fig.1 Effect of different catalysts on DBP degradation
负载不同活性组分的碳纳米管催化剂CNTFe/Zn、CNT-Fe、CNT-Zn 的催化过程均符合准一级反应动力学,反应速率常数分别为0.03,0.01 和0.02min-1(R2=0.92/0.93/0.91>0.9), O3+CNT-Fe/Zn降解DBP 的动力学常数分别为O3+CNT-Fe 和O3+CNT-Zn 的1.3 和1.9 倍,锌铁尖晶石的负载极大的提高了DBP 的去除率[20].
2.1.2 臭氧投加量对催化臭氧氧化DBP 效果的影响 羟基自由基的产生量与水中臭氧浓度有密切的关系[31-32].
如图2 所示,当曝气臭氧浓度从7mg/L 提升至20mg/L 时,单独臭氧和O3+CNT-Fe/Zn 处理DBP 的去除率分别提高了17.21%和18.45%.进一步提高曝气臭氧浓度, O3+CNT-Fe/Zn 处理DBP 的去除率趋于60%.催化臭氧氧化过程的羟基自由基的产生量与臭氧浓度呈正比[40],但过量的臭氧会从反应器中溢出,并与DBP 在催化剂表面发生竞争吸附,降低臭氧利用率[33].因此,最佳臭氧投加浓度为20mg/L.
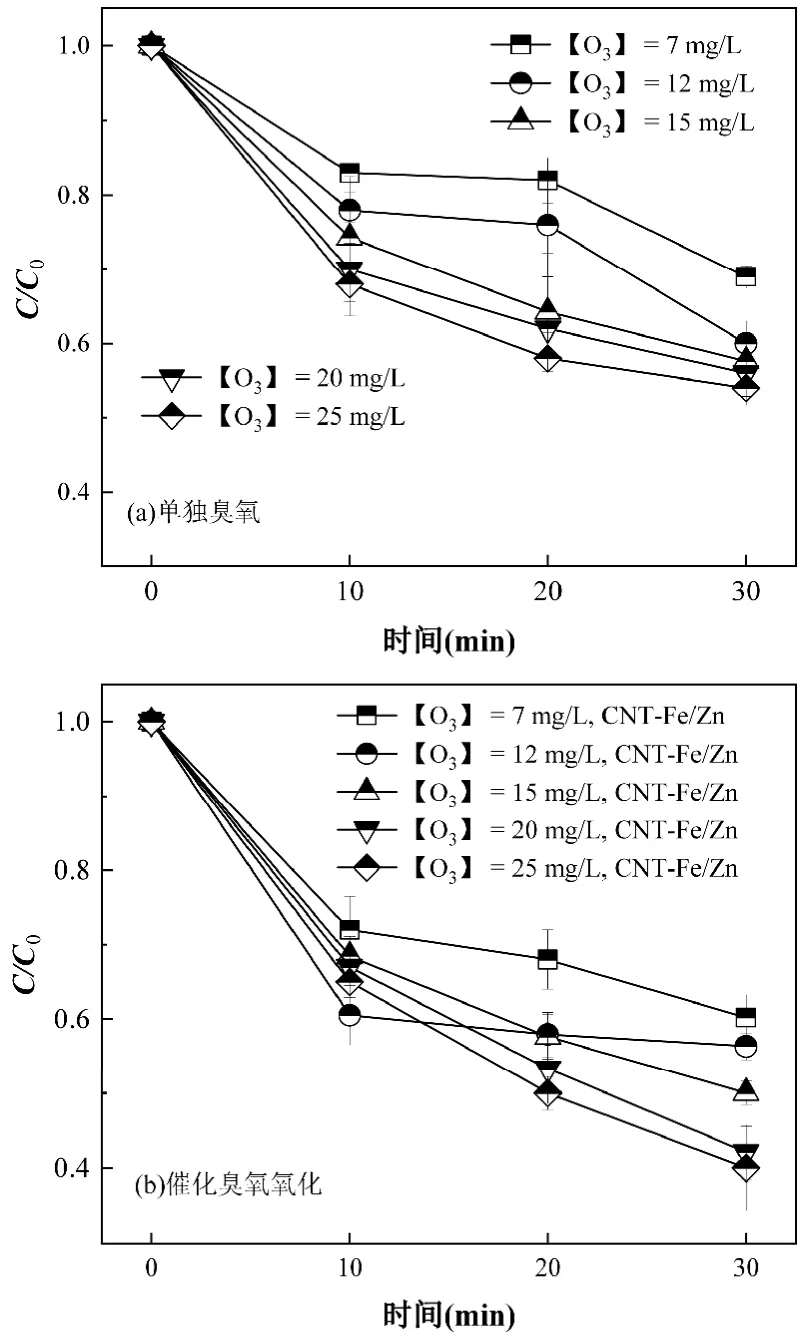
图2 不同臭氧投加量对DBP 降解的影响Fig.2 Effect of ozone dosage on DBP degradation
2.1.3 催化剂投加量对催化臭氧氧化DBP 效果的影响 催化剂投加量会直接影响臭氧和有机污染物在催化剂表面的吸附和催化氧化行为[4,33-34].如图3 所示,当催化剂的投加量从10mg/L 提升至50mg/L时,30min 后O3+CNT-Fe/Zn 对DBP 的去除率从26.21%提升至61.03%.催化剂投加量的提高会显著增强催化剂对有机物的吸附作用,并提供更多促进臭氧分解的活性位点,羟基自由基等ROS 产量增加[34].但进一步提高催化剂投加量至100mg/L,DBP的去除率仅比50mg/L 增加了2.73%.因此,本研究最佳催化剂投加量为50mg/L.
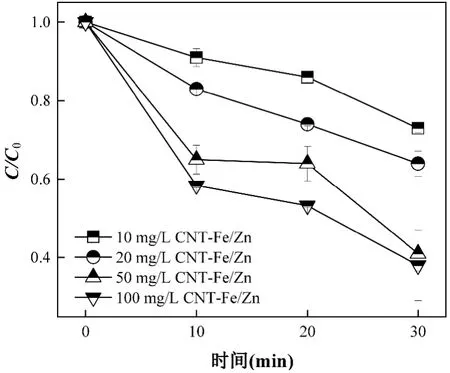
图3 不同催化剂投加量对DBP 降解的影响Fig.3 Effect of catalysts dosage on DBP degradation
2.1.4 初始pH 值对催化臭氧氧化DBP 效果的影响 pH 值可通过影响可电离有机分子的电荷、催化剂的表面性质、臭氧的利用效率和ROS 的生成[5,8-10]等对催化臭氧氧化过程产生影响.
如图4 所示, DBP 在单独臭氧处理下去除率较低,DBP 的去除率随pH 值的降低而下降.酸性条件下高浓度的氢离子通过抑制臭氧的分解从而阻碍DBP 的降解[5,9].CNT-Fe/Zn 催化剂在酸性、中性和碱性条件表现出优异的催化性能,催化臭氧氧化DBP 的效果均优于单独臭氧氧化、O3+CNT-Fe 和O3+CNT-Zn.在pH=4 时, O3+CNT-Fe/Zn 对DBP 的处理效果最佳, 30min 内DBP 去除率达72.41%,比单独臭氧提高了51.42%.而随着pH 值的上升,DBP的去除率略微下降,负载锌铁尖晶石的碳纳米管催化剂在臭氧催化氧化DBP 过程中表现出优异的pH值适应性.

图4 初始pH 对DBP 降解的影响Fig.4 Effect of the initial pH on DBP degradation
2.1.5 催化臭氧氧化DBP 的TOC 去除率 如图5所示,单独臭氧对于DBP的TOC去除效果不佳,加入CNT-Fe、CNT-Zn 和CNT-Fe/Zn 催化剂后,DBP 的TOC 去除率显著上升,效果最佳的CNT-Fe/Zn 催化剂催化臭氧氧化DBP 的TOC 去除率相比单独臭氧提升了24.46%.负载锌铁尖晶石的碳纳米管催化剂具实际应用潜能.

图5 不同催化剂对DBP 的TOC 去除率影响Fig.5 Effect of catalysts on TOC removal of DBP
2.2 催化剂的表征
从图6(a)、(c)可以看出,原生碳纳米管呈竹节状管状结构,有明显的缠绕且长度较长[33,35],改性处理后的碳纳米管(图6(b)、(d))长度明显减小,无定型结构增多,这些变化增大了碳纳米管比表面积,提供了更多的活性位点.改性后的碳纳米管表面比原生碳纳米管粗糙,因为大量的锌铁尖晶石呈颗粒状吸附着在碳纳米管的表面.

图6 碳纳米管和CNT-Fe/Zn 的扫描电镜图Fig.6 SEM images of CNT and CNT-Fe/Zn
如表1 所示,改性后的碳纳米管比表面积明显增大,大比表面积可促进臭氧和有机物的吸附,提高催化剂的催化性能[27].预处理打开了原生碳纳米管的结节,碳纳米管的部分孔道被锌铁尖晶石颗粒填充,改性后催化剂的孔体积和孔径明显减小.

表1 催化剂的比表面积和孔体积Table 1 Specific surface area and pore volume of catalysts
图7 为CNT-Fe/Zn 催化剂的XRD 谱图.CNTFe/Zn 催化剂具有清晰的分辨率和锐化的特征衍射峰(Rexp: 4.88, Rwp: 6.09, Rp: 4.84, GOF: 1.25),表明其结晶度良好.位于2θ=31.84°、36.32°、56.78°、63.01°、68.18°处的衍射峰与 ICSD 65119 (ZnFe2O4)的特征峰吻合并且强度一致,位于 2θ=35.26°、42.86°、62.25°处的衍射峰与 ICSD 91829 (ZnO)的特征峰吻合并且强度一致,位于 2θ=7.81°、26.59°处的衍射峰与 COD ID 2204330 (C10H16O10Zn)的特征峰吻合并且强度一致.催化剂 CNT-Fe/Zn 由C10H16O10Zn、ZnFe2O4和ZnO 三种主晶体覆盖,分别占86.73%、12.17%和1.10%,这都证明了锌铁尖晶石成功负载到碳纳米管上.

图7 CNT-Fe/Zn 的XRD 衍射图谱Fig.7 XRD patterns of CNT-Fe/Zn
如图8(a)所示,全范围的XPS 扫描可观察到明显的C 1s、O 1s、Zn 2p 和Fe 2p 的特征峰,证实CNT-Fe/Zn 催化剂含有C、O、Fe 和Zn 等元素.C 1s的精细图谱有3 个峰,分别对应C-C、C-O 和C=O[36](图8(b)); O 1s 精细图谱中有4 个峰,分别对应O-H、C-O、C=O 和O-C=O(图8(c)); Zn 2p 精细图谱中结合能为 1021.45eV 和 1044.38eV 的特征峰分别对应 Zn 2p3/2和 Zn 2p1/2,经拟合后可得Zn2+2p3/2和 Zn2+2p1/2的特征峰(710.94eV 和723.98eV,占比64.71%)以及Zn3+2p3/2和Zn3+2p1/2的特征峰(1020.74eV 和1043.78eV,占比34.31%)[22]; Fe 2p精细图谱中结合能为 1021.45eV 和1044.38eV的特征峰分别对应Fe 2p3/2和Ze 2p1/2,经拟合后可得Fe2+2p3/2 和 Fe2+2p1/2 的特征峰(709.68eV 和726.93eV,占比59.15%)以及Fe3+2p3/2和Fe3+2p1/2的特征峰(713.23eV 和723.82eV,占比40.85%)[25].

图8 CNT-Fe/Zn 的XPS 图谱Fig.8 XPS spectra of CNT-Fe/Zn
2.3 降解机理及pH 值适应性探究
2.3.1 CNT-Fe/Zn 对DBP 的吸附 吸附反应是催化臭氧氧化过程中的重要一环[5,38].如图9 所示,在仅加入氮气的条件下,pH 值为4、7 和9 条件下50mg/L 的CNT-Fe/Zn 对DBP 的吸附率分别为19.01%、13.32%和10.58%.使用Zetasizer Nano ZS90 型电位仪测定CNT-Fe/Zn 的等电点为6.4,在pH 值为7 和9 条件下表面呈去质子化状态, Wang等[37]测定了不同pH值下DBP 的Zeta 电位, DBP 所带负电荷量随pH 值的上升而增加,CNT-Fe/Zn对DBP的吸附因受电荷排斥作用而随pH 值的上升而降低.在O3+CNT-Fe/Zn 体系中,pH 值为4、7 和9 时DBP 的去除率分别为72.41%、59.32%和51.30%,远远高于CNT-Fe/Zn 对DBP 的吸附作用.此外,催化臭氧氧化实验中转子的搅拌和曝气使得催化剂剧烈无规则运动,反应过程中DBP 的脱附也是弱吸附作用产生的原因.
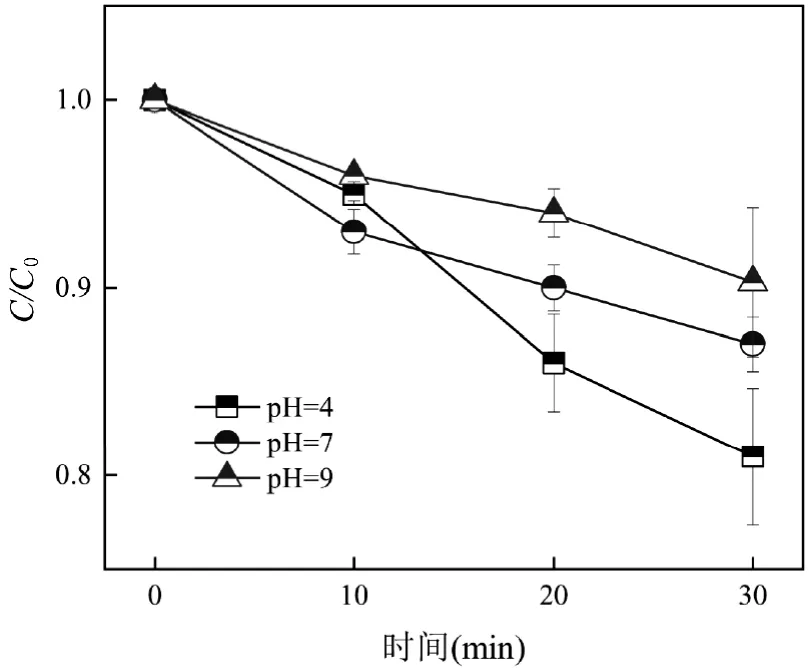
图9 不同pH 值下CNT-Fe/Zn 对DBP 的吸附Fig.9 Adsorption of DBP by CNT-Fe/Zn at different pH
2.3.2 主要活性氧物种 CNT-Fe/Zn 催化臭氧氧化过程中产生的主要ROS 可能为羟基自由基和过氧化氢[27,40].如图10(a)所示,在pH4 时,O3+CNT-Fe/Zn 体系中·OH 的瞬时浓度在前10min 迅速上升至163.06μmol/L,而10min 后趋于稳定,与此条件下DBP 的去除率变化趋势吻合.氯离子等无机阴离子和叔丁醇(TBA)是典型的·OH 淬灭剂[5,41],如图10(c)所示,氯离子和TBA 的加入极大削弱了催化臭氧氧化效果,在740mg/L TBA 和35.45mg/L 氯离子存在下,30min 内DBP 的降解效率分别降低34.29%和33.26%.在CNT-Fe/Zn催化臭氧氧化DBP的反应中,·OH 的氧化作用是DBP 降解的主要机理.
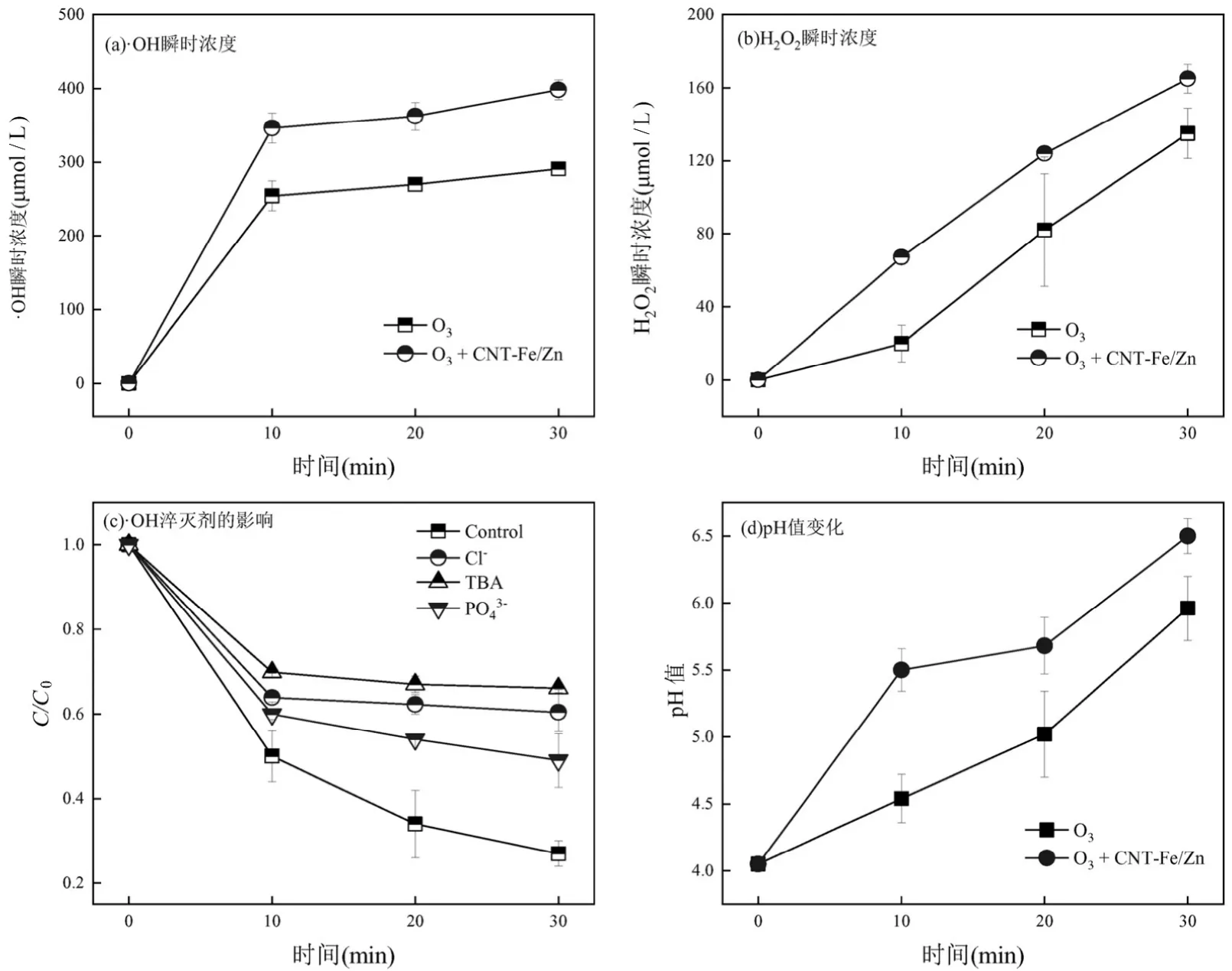
图10 单独O3 和O3+CNT-Fe/Zn 催化臭氧氧化DBP 过程中的(a) ·OH 的产量(b) H2O2 的产量(c)羟基自由基淬灭剂对DBP 降解的影响及(d)pH 值变化曲线Fig.10 (a) Concentration of ·OH (b) Concentration of H2O2 (c) influence of hydroxyl radical quenchers (d) and pH changes in on DBP degradation in single O3 and O3+CNT-Fe/Zn system
加入TBA 后CNT-Fe/Zn 催化臭氧氧化DBP 降解率仍远高于单独臭氧氧化,该体系还存在其他氧化性物种[41].Zhang 等[42]使用零价锌催化臭氧氧化对硝基氯苯,发现锌的加入会促进臭氧生成过氧化氢.如图10(d)所示,随着反应的进行, O3-CNT-Fe/Zn处理DBP溶液的pH 值从4 上升至6.5,大量的氢离子在催化臭氧氧化过程中被消耗,一部分被臭氧转化为羟基自由基的链式反应消耗,另一部分与氧气反应生成过氧化氢(公式(1)).而单独臭氧体系处理的DBP 溶液的pH值从4 升高到5.7,上升幅度较缓,侧面证明了过氧化氢的生成.如图10(b)所示,在pH4 的条件下,过氧化氢的瞬时浓度随反应时间呈上升趋势,30min 后单独臭氧体系和O3-CNT-Fe/Zn 体系的过氧化氢浓度分别为135.48,163.06μmol/L.生成的过氧化氢一部分自分解生成羟基自由基,另一部分与CNT-Fe/Zn 催化剂中的Fe2+形成类芬顿体系[43].催化剂促进臭氧生成过氧化氢是CNT-Fe/Zn 催化剂能够在酸性条件下具有优异催化性能的重要原因.而在中、碱性条件下,过氧化氢的生成被抑制,臭氧仅通过自分解和链式反应生成羟基自由基.
2.3.3 活性位点 研究表明碳纳米管的表面羟基等活性基团是臭氧吸附和分解的活性位点[25,44].在400、500 和600℃下煅烧羧基化的碳纳米管[44],得到MCNT-COOH-400、MCNT-COOH-500 和MCNTCOOH-600 不同表面羟基密度的3 种碳纳米管,并进行催化臭氧氧化DBP 的实验.
如图11 所示,碳纳米管的表面羟基浓度和表羧基浓度与DBP 的降解表观一级反应动力学常数均呈良好的线性关系(R2=0.94/0.96),与催化剂的催化活性呈正相关关系.如图10(c)所示,0.0376mg/L 磷酸根的加入使得DBP 的去除率降低了23%.磷酸盐是一种比臭氧和水更强的路易斯碱[41,45],它会与臭氧在催化剂表面的活性位点发生竞争吸附.此结果进一步证实了表面含氧官能团是CNT-Fe/Zn 催化剂的主要活性位点.CNT-Fe/Zn 由原始碳纳米管经浓HNO3酸化预处理后改性制得,通过酸化处理后的碳纳米管表面生成大量的表面羟基和表面羧基等含氧基团,它们不仅为催化臭氧氧化反应提供大量的活性位点,同时强化了锌铁尖晶石的负载.催化剂表面的含氧基团是CNT-Fe/Zn 催化剂具有高pH 值适应性和优异催化性能的重要原因.

图11 碳纳米管表面基团浓度与催化活性的关系Fig.11 Relationship between surface group concentration and catalytic activity of CNT
2.3.4 臭氧利用率Rct值(·OH 和O3浓度暴露的比例)可以反应催化剂的催化活性和臭氧利用率[46].Rct值和总二级反应速率常数的计算如公式(2)~(7)所示(P-DBP):
研究表明kO3和kOH分别为0.092,4.6×109mol/(L·s)[47],由公式(2)~(6)可得,臭氧累积浓度的与反应前后DBP 浓度比值的对数值呈线性关系(图12).

图12 臭氧累计浓度对DBP 降解动力学的影响Fig.12 Effect of cumulative ozone concentration on the kinetics of DBP degradation
如表2 所示,随着pH 值的升高,单独臭氧体系的Rct值从4.13×10-9增长到6.74×10-9,碱性条件臭氧的自分解更强[47],羟基自由基的产量和臭氧利用率高.而在O3+CNT-Fe/Zn 体系中,臭氧的自分解过程不占主导地位,羟基自由基通过其他途径生成.与单独臭氧相比,CNT-Fe/Zn 催化剂的加入提高了臭氧的利用率,在酸性、碱性及中性条件下Rct和总二级反应速率常数均远高于单独臭氧体系.CNT-Fe/Zn 催化剂在宽pH 值范围内均具有高臭氧利用率,从而提高羟基自由基的生成,进而促进了DBP 的降解.

表2 不同体系Rct 值及总二级反应速率常数Table 2 Rct values and total second order reaction rate constants of different systems
2.3.5 CNT-Fe/Zn 催化剂臭氧催化氧化DBP 机理 如图13(a)、(b)所示,对特征峰积分计算可得反应前后Zn2+含量分别为64.71%和65.69%, Zn3+含量分别为35.29%和34.31%.Zn2+将电子转移给臭氧产生Zn3+和O3−[5,41],进而生成羟基自由基[47].如图13(c)、(d)所示,对特征峰积分计算可得反应前后Fe2+含量分别为 62.63%和 59.15%,Fe3+含量分别为37.37%和40.85%,反应过程中Fe2+被氧化为Fe3+,进而形成Fe2+-Fe3+-Fe2+的链式反应.

图13 臭氧催化氧化反应前后CNT-Fe/Zn 的XPS 图谱Fig.13 XPS spectra of CNT-Fe/Zn before and after catalytic ozonation of DBP
综上对CNT-Fe/Zn 催化臭氧氧化DBP 的机理进行解析:在酸性条件下,臭氧会在锌和铁的促进下生成大量过氧化氢,生成的过氧化氢与Fe2+反应生成羟基自由基,同时Zn2+会与臭氧反应生成羟基自由基,铁和锌在此过程中不断进行二价-三价-二价的链式循环反应.中性及碱性条件下的机理类似,过氧化氢的产生会被抑制,羟基自由基的产生仅靠臭氧与金属离子的链式反应和臭氧的自分解反应生成.部分反应如公式(8)~(16)所示:
2.4 催化剂的稳定性和寿命
由图14 可见,在酸性条件下,第5 次循环实验的CNT-Fe/Zn 催化臭氧氧化DBP 的去除率仅比第1次下降12.34%,回收使用的CNT-Fe/Zn 催化剂仍然保持良好的催化性能.经过30min 反应后,CNTFe/Zn 锌离子和铁离子的浸出率分别为0.16%和0.32%,远低于CNT-Zn 的锌离子浸出率1.82%和CNT-Fe 的铁离子浸出率4.64%.CNT-Fe/Zn 催化剂具有优秀的催化稳定性和重复利用性.
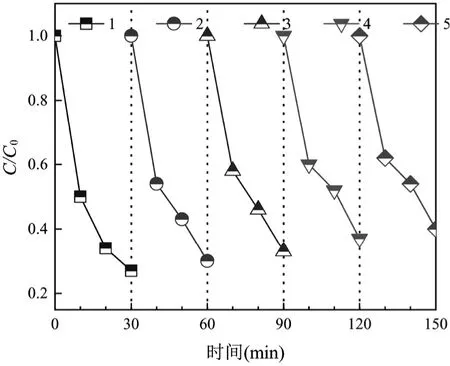
图14 DBP 的循环降解Fig.14 Cyclic degradation of DBP by CNT-Fe/Zn
3 结论
3.1 通过浸渍-煅烧法制备负载锌、铁以及锌铁共掺杂的碳纳米管,CNT-Fe/Zn 相比 CNT-Fe 和CNT-Zn 具有更强的催化性能,在宽pH 值范围内比单独臭氧降解DBP 的去除率提升约22%~52%.在DBP 初始浓度4mg/L、初始pH 值为4、臭氧用量20mg/L、催化剂投加量50mg/L 的条件下,30min DBP 去除率可达72.41%.
3.2 从SEM 结果可以看出,改性后的CNT-Fe/Zn催化剂碳纳米管的孔道内部及表面都存在大量负载物;BET 测试表明了经过铁尖晶石负载后的催化剂比表面积和总孔体积都有较大变化;XRD 谱图表明CNT-Fe/Zn 主要由C10H16O10Zn、ZnFe2O4和ZnO三种主晶体覆盖,且其结晶度良好;XPS 谱图显示CNT-Fe/Zn 主要由C、H、O、Fe、Zn 五种元素组成,其中Fe 和Zn 都呈现多价态.以上结果均证实了锌铁尖晶石的成功负载.
3.3 通过淬灭实验证明羟基自由基的氧化作用是O3-CNT-Fe/Zn 体系的主要催化机理.CNT-Fe/Zn 催化剂的加入极大的提高了体系中羟基自由基和过氧化氢的生成量,其表面羟基和羧基为催化剂提供了大量的活性位点,且碳纳米管与锌铁尖晶石具有良好的协同作用,强化了反应过程中的电子转移,促进了链式反应的进行.催化剂循环实验表明,CNT- Fe/Zn 催化剂具有较好的催化稳定性和重复利用性.

