介入治疗联合仑伐替尼及信迪利单抗治疗中晚期肝癌效果观察*
孙正路 王航宇 张艳停
1.河南大学第一附属医院消化内科 (河南 开封 475000)
2.开封市中心医院神经内科(河南 开封 475000)
肝癌作为最常见的恶性肿瘤之一,在全球范围内都具有较高的发病率和死亡率[1]。根据世界卫生组织的数据,每年约有75万人死于肝癌,其中大多数是中晚期肝癌[2]。尽管在过去几十年中,肝癌的诊断和治疗方法得到了显著的改进,但中晚期肝癌的治疗仍然面临着巨大的挑战。传统的介入治疗方法如经肝动脉化疗栓塞术(TACE)可以有效控制肿瘤的局部进展,但对于肿瘤的全身治疗效果有限。靶向治疗和免疫治疗作为新一代肝癌治疗策略的代表,已经取得了显著的进展,但单独应用时也存在一些局限性。近年来,联合治疗策略逐渐受到关注,并引起了临床研究的兴趣。联合治疗的目的是通过不同治疗方法的互补作用,提高疗效,减轻不良反应,延长患者的生存期。其中,介入治疗联合靶向治疗和免疫治疗的组合被认为具有潜在的优势。以往的一些临床研究数据也支持了这一观点。一项研究发现[3],在采用TACE联合靶向治疗的中晚期肝癌患者中,肿瘤缩小和疾病控制率明显提高,生存期也得到了显著延长。另外,一项回顾性研究表明[4],TACE联合免疫治疗的组合在中晚期肝癌患者中显示出较好的疗效和耐受性。本研究旨在评估介入治疗联合仑伐替尼及信迪利单抗治疗中晚期肝癌的疗效,并与传统的顺序治疗方案进行比较,以期为中晚期肝癌的治疗提供更有效的临床决策依据。
1 资料与方法
1.1 一般资料选取2021年1月~2023年4月在本院确诊的中晚期肝癌患者66例。
纳入标准:年龄在18岁以上;确诊为中晚期肝癌(BCLC-C或BCLC-B分期);满足TACE介入治疗和靶向治疗联合免疫治疗的适应症;肝功能Child-Pugh评分A或B级;具备完整的医学记录和随访资料;能够理解并遵守研究协议并签署知情同意书。排除标准:存在严重的器官功能障碍,如心肺、肾脏等;其他原发性肿瘤或伴发肿瘤;存在明显的消化道出血风险或血小板计数低于50×10^9/L;有未经有效控制的高血压或心脏疾病史;有严重的感染或免疫系统疾病史;有严重的精神疾病史或精神病药物治疗史;参加其他临床试验或接受其他治疗干预;孕妇或哺乳期妇女。依据患者治疗方法不同进行分组,对照组30例先行TACE介入治疗后,再进行靶向治疗联合免疫治疗,联合组36例先行靶向治疗联合免疫治疗后再行TACE介入治疗。对照组:男性24例,女性6例,年龄45~69岁,平均年龄(56.72±6.79)岁,Child-Pugh分级:A级27例,B级3例,BCLC分期:B分期18例,C分期15例。联合组:男性24例,女性12例,年龄45~70岁,平均年龄(56.43±6.54)岁,Child-Pugh分级:A级29例,B级7例,BCLC分期:B分期20例,C分期16例。两组一般资料,P>0.05。
1.2 研究方法(1)对照组:1)TACE介入治疗:每4-6周进行1次TACE治疗,每次化疗药物使用的主要是氧化铂50-120mg、阿霉素40-60mg、替加氟20-30mg,治疗方案根据个体情况调整。2)靶向治疗:采用仑伐替尼口服剂量为8mg/d,每日1次,连续28天为1个疗程,观察疗效后继续用药或停药。3)免疫治疗:采用信迪利单抗静脉注射,剂量为240mg,每2周1次,共6次疗程。(2)联合组:1)靶向治疗:采用仑伐替尼口服剂量为8mg/d,每日1次,连续28天为1个疗程,观察疗效后继续用药或停药。2)免疫治疗:采用信迪利单抗静脉注射,剂量为240mg,每2周1次,共6次疗程。3)TACE介入治疗:每4-6周进行1次TACE治疗,每次化疗药物使用的主要是氧化铂50-120mg、阿霉素40-60mg、替加氟20-30mg,治疗方案根据个体情况调整。(3)两组均在治疗中密切观察并针对不良反应及时处理,并根据患者病情随时调整治疗方案。随访期为6个月,治疗后2周、4周、6周、8周、16周、24周各随访1次,评估疗效和不良反应。
1.3 观察指标(1)疗效:CR指肿瘤消失或缩小至无法检测来表示疗效;PR指肿瘤缩小至一定程度,比如体积缩小了30%以上,或者病灶数量减少了50%以上;SD指肿瘤体积或数量没有明显变化,或者变化不够明显以达到PR定义的标准;PD指肿瘤体积或数量增大。ORR=(CR+PR)/总例数×100%。DCR=(CR+PR+SD)/总例数×100%。(2)不良反应:白细胞减少、低蛋白血症、甲状腺功能减低、血小板减少、甲状腺功能减低。(3)AFP水平:采集患者肘部静脉血3mL,离心,3000r/min,10min,采用全自动生化分析仪检测。
1.4 统计学方法采用SPSS 26.0统计软件对数据进行分析,计量资料用(±s)表示,比较用t检验;计数资料用[n(%)]表示,比较用χ2检验;以P<0.05为差异有统计学意义。
2 结 果
2.1 两组疗效比较两组疗效比较,P>0.05,见表1。
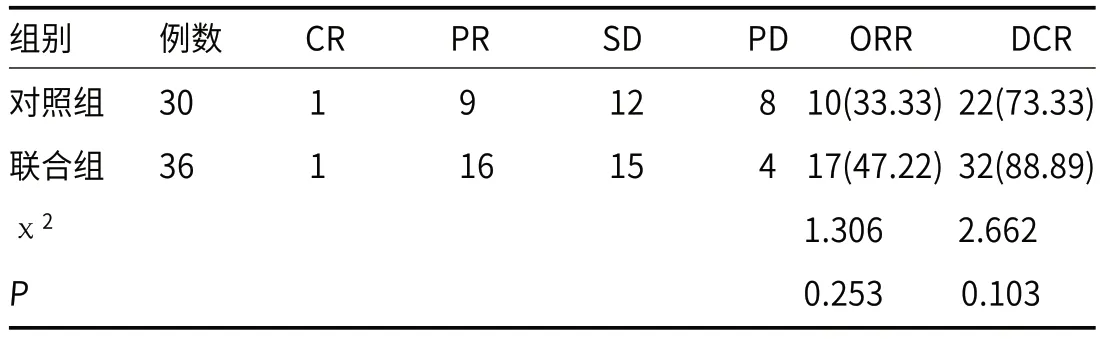
表1 两组疗效比较[n(%)]
2.2 两组不良反应比较两组白细胞减少、甲状腺功能减低、血小板减少、甲状腺功能减低比较,P>0.05,联合组低蛋白血症发生率低于对照组(P<0.05),见表2。
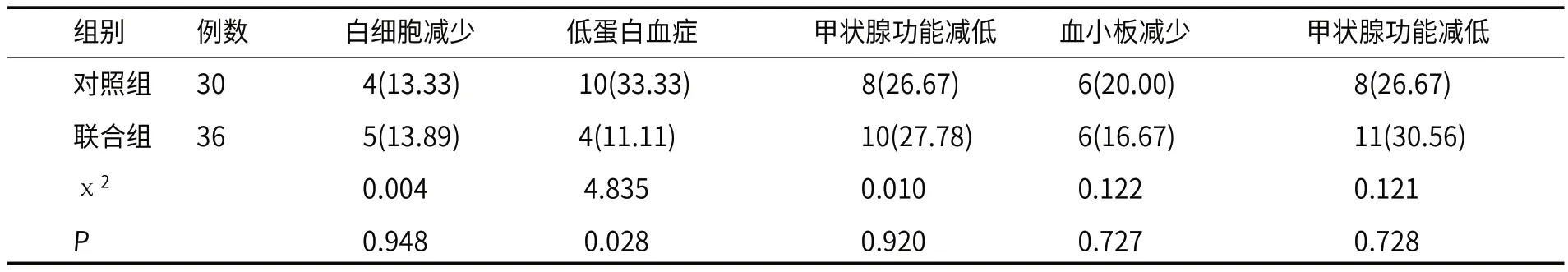
表2 两组不良反应比较[n(%)]
2.3 两组AFP水平比较随访0周,两组AFP水平比较,P>0.05,随访4~24周,联合组AFP水平均低于对照组(P<0.05),见表3。
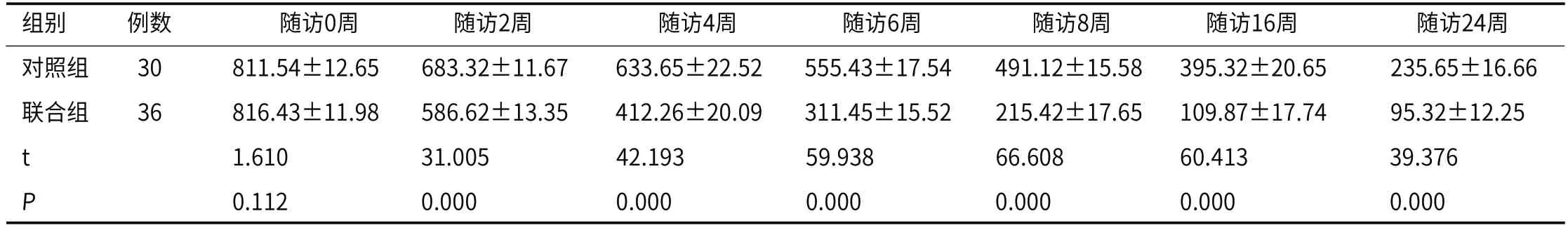
表3 两组AFP水平比较(mol/L)
3 讨 论
仑伐替尼是一种口服的抗癌药物,属于一类叫做酪氨酸激酶抑制剂的药物,可以抑制血管内皮生长因子受体(VEGFR)和其他受体的活性,从而阻断肿瘤的血液供应,抑制肿瘤生长和扩散,目前主要用于甲状腺癌、肾细胞癌、肝细胞癌[5-7]。信迪利单抗是一种PD-1抑制剂,适用于晚期非小细胞肺癌、晚期肝癌等恶性肿瘤的免疫药物[8-10]。信迪利单抗主要是通过动员机体自身的免疫功能,激活自身的免疫杀伤T细胞的作用,从而通过杀伤T细胞来杀死癌细胞,起到抗肿瘤治疗的作用[11-12]。目前临床上已经获批用于晚期非小细胞肺癌的一线治疗,一般信迪利单抗适合化疗药物联合使用,同时也可以用于晚期肠癌、晚期食管癌或晚期肝癌患者的一线治疗[13-14]。本次研究结果显示,两组疗效比较,P>0.05,说明介入治疗联合仑伐替尼及信迪利单抗在治疗中晚期肝癌方面可能具有与传统顺序治疗方案相当的疗效。两组白细胞减少、甲状腺功能减低、血小板减少、甲状腺功能减低比较,P>0.05,这说明介入治疗联合仑伐替尼及信迪利单抗与传统顺序治疗方案在不良反应的发生方面可能具有相似的安全性。联合组低蛋白血症发生率低于对照组(P<0.05),这意味着介入治疗联合仑伐替尼及信迪利单抗可能具有降低低蛋白血症的发生风险[15]。低蛋白血症是中晚期肝癌患者常见的并发症之一,可导致营养不良和免疫功能下降,影响患者的生存和生活质量[16-17]。因此,联合治疗方案的低蛋白血症发生率低于对照组的结果具有重要的临床意义。在随访0周时,两组之间在AFP水平方面没有显著差异。这意味着在治疗开始阶段时,介入治疗联合仑伐替尼及信迪利单抗与传统顺序治疗方案对AFP水平可能没有明显的影响。然而,在随访4~24周时,联合组的AFP水平均低于对照组,这表明介入治疗联合仑伐替尼及信迪利单抗可能能够更有效地控制AFP水平的升高[18]。AFP是中晚期肝癌的重要肿瘤标志物,其水平的控制和降低与肿瘤的生长和进展密切相关[19-20]。因此,联合治疗方案在降低AFP水平方面的优势具有重要的临床意义。
综上所述,介入治疗联合仑伐替尼及信迪利单抗对中晚期肝癌患者具有潜在的治疗优势,可促使AFP水平下降,减少低蛋白血症的发生。

