西藏牦牛瘤胃源产纤维素酶菌株筛选鉴定及产酶条件探究
■ 姜 南 李传博 杨晓钰 孙光明 洛桑顿珠 次旦央吉 石 汇 窦少华*
(1.西藏自治区畜牧兽医研究所,西藏拉萨 850004;2.大连大学生命健康学院,辽宁大连 116020)
纤维素是地球上最丰富的有机化合物,由大量葡萄糖单元通过β-1,4-糖苷键结合而成的聚合物。纤维素的聚合度根据其来源而不同。纤维素的主要来源是植物组织,是植物细胞壁的主要成分[1]。由于含有大量β-1,4-糖苷键,纤维素很难被物理分解[3],只能被一种名为纤维素酶的酶降解。纤维素酶主要是由细菌和真菌等微生物自然产生[4]。纤维素聚合物的降解需要多种碳水化合物活性酶的协同作用。这些酶家族通过氧化、水解和非水解活性的多重互补协调降解纤维素[5]。降解纤维素主要由3 种酶共同完成,即内切型葡聚糖酶、外切型葡聚糖酶和β-葡萄糖苷酶(BG),这3 种酶可以将纤维素降解为单糖[6]。细菌具有生长速率高、产酶能力强和对极端环境耐受性强等特点,已成为纤维素酶生产的研究重点[7]。许多食草动物肠道主要靠微生物分解消化纤维素并将其转化为单糖,再为动物所吸收利用[8]。细菌是食草动物和其他以植物为食的生物(包括昆虫)肠道中的主要纤维素分解微生物。纤维素降解菌分布在不同的区域,包括白蚁的肠道、反刍动物的瘤胃、马的大肠和有机废物[10]。许多报道表明,瘤胃是纤维素降解菌的重要来源之一,因为饲料的酶消化和机械消化都发生在瘤胃中[11]。在牛体内,潜在的纤维素分解细菌包括产琥珀酸拟杆菌、梭菌、毛若虫、放线菌、纤维溶丁酸弧菌、瘤胃球菌和甲烷酸菌[12]。
在饲料工业、食品工业、纺织业和造纸业等许多行业对纤维素酶有着巨大的需求[13-14]。此外,纤维素分解生物可作为动物营养中的益生菌,以增强消化、提高家畜的生长和生产力[15]。本研究旨在从牦牛瘤胃中分离和鉴定潜在的纤维素降解菌,并探究菌株的最适产酶条件,以期将分离筛选的菌株作为添加剂添加到饲料中,从而提升动物对饲料的利用率。
1 材料与方法
1.1 材料
1.1.1 瘤胃液样品
采集西藏牦牛养殖场野外散养非人工喂食的牦牛的瘤胃液,新鲜的瘤胃液用无菌采样管收集,置于带干冰的保温箱中,带回实验室,于冰箱中-80 ℃保存。
1.1.2 主要试剂与设备
京尼平苷、Na2CO3、精氨酸(Arg)、微晶纤维素、羧甲基纤维素钠(CMC-Na)、刚果红、3,5-二硝基水杨酸(DNS)、酒石酸钾钠、苯酚、NaHSO3,均购自上海麦克林生化科技股份有限公司。
FP-1100-C 型全自动生长曲线分析仪,Oy Growth Curves Ab Ltd.;ECLIPSE Ci-L 研究型正置荧光生物显微镜,尼康(NIKON)公司;Varioskan LUX 型多功能酶标仪,Thermo Fisher Scientific Incorporated。
1.1.3 培养基
富集培养基:CMC-Na 10 g/L,蛋白胨2 g/L,酵母粉1 g/L,NaCl 3 g/L,KH2PO42 g/L,Mg2SO4·7H2O 1 g/L,FeSO4·4H2O 10 mg/L,MnSO4·H2O 5 mg/L,pH自然。
固体培养基:CMC-Na 1 g/L,蛋白胨 0.5 g/L,酵母粉0.5 g/L,NaCl 0.5 g/L,KH2PO41 g/L,Mg2SO4·7H2O 0.5 g/L,琼脂 20 g/L,刚果红 0.2 g/L,pH自然。
液体培养基:CMC-Na 5 g/L,蛋白胨 2 g/L,酵母粉1 g/L,NaCl 3 g/L,KH2PO42 g/L,Mg2SO4·7H2O 1 g/L,FeSO4·4H2O 10 mg/L,MnSO4·H2O 5 mg/L,pH自然。
1.2 方法
1.2.1 纤维素分解菌的筛选
富集培养:在牦牛瘤胃液收集管中取1 mL 样品于100 mL富集培养基中,37 ℃摇床培养24~36 h。
初筛:用刚果红染色法进行初筛,将菌液进行梯度稀释至10-7,取10-5、10-6、10-73 个梯度的稀释液0.1 mL 涂布在初筛培养基上,37 ℃恒温培养箱中培养24 h。
复筛:挑取初筛培养基上具有透明圈的菌落,接种于复筛培养基中,后进行多次分离纯化划线,把所得菌株接种于发酵培养基中37 ℃振荡培养,测定发酵12、24、36、72 h 后的酶活性,选取产酶活性最高的菌株作为出发菌株。
1.2.2 酶活性测定
从发酵培养基中取2 mL 发酵液,4 ℃条件下12 000 r/min 离心10 min,取上清液,作为粗酶液测定纤维素酶活性。
依据Ghose[16]的方法测得葡萄糖标准曲线:y=2.063x-0.444 6,R2=0.999。
式中:C——还原糖浓度(mmol/L);
0.7——反应试剂总体积(mL);
0.1——酶液体积(mL);
15——反应时间(min)。
内切型-β-葡聚糖酶活性测定[17]:在200 μL 的1%的CMC-Na(由pH 5.0、0.1 mol/L 的磷酸盐缓冲液配制)中加入100 μL 的粗酶液,在50 ℃水浴中反应15 min,加入400 μL DNS(DNS 的配制参考赵玉萍等[17]的方法)显色,并于沸水浴中煮沸10 min 终止反应,待冷却后取200 μL 于96 孔板中。同时用失活的酶作为对照组,于540 nm测定吸光度。
在50 ℃、pH 5.0 条件下,将每分钟水解CMC-Na产生1 mg 葡萄糖所需的内切型-β-葡聚糖酶量定义为一个酶活性单位。
外切型-β-葡聚糖酶活性测定[18]:在200 μL 的1%的微晶纤维素(由pH 5.0、0.1 mol/L 的磷酸盐缓冲液配制)中加入100 μL的粗酶液,在50 ℃水浴中反应15 min,加入400 μL DNS 显色,并于沸水浴中煮沸10 min 终止反应,待冷却后取200 μL 于96 孔板中。同时用失活的酶作为对照组,于540 nm测定吸光度。
在50 ℃、pH 5.0 条件下,将每分钟水解微晶纤维素产生1 mg 葡萄糖所需的外切型-β-葡聚糖酶量定义为一个酶活性单位。
β-葡萄糖苷酶活性测定:依据梁华正等[19]的测定方法并稍作修改,在200 μL 的5 mmol/L 的京尼平苷(由pH 5.0、0.1 mol/L 的磷酸盐缓冲液配制)中加入100 μL 的粗酶液,在50 ℃水浴中反应15 min,加入1 mol/L的Na2CO3300 μL终止反应,再加入1.6 mg/mL的Arg 溶液100 μL 显色,沸水浴10 min 终止反应,待冷却后取200 μL于96孔板中。同时用失活的酶作为对照组,于540 nm测定吸光度。
在50 ℃、pH 5.0 的条件下,将每分钟水解京尼平苷产生1 mg葡萄糖所需的β-葡萄糖苷酶量定义为一个酶活性单位。
1.2.3 菌株的鉴定
菌落形态观察:选取出发菌株进行平板划线,在37 ℃恒温培养箱中培养24 h,然后进行革兰氏染色,在显微镜下观察菌落形态。
16S rDNA 基因序列测定与同源性分析:用细菌基因组DNA 提取试剂盒提取菌株基因组DNA,采用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)进行PCR扩增,由北京美优安诺生物科技有限公司进行测序,测序结果经NCBI比对后构建系统发育树。
1.2.4 菌株的生长曲线测定
取出发菌株于液体培养基中,在37 ℃振荡培养24 h 作为种子培养基,以5%的接种量接种于100 mL液体培养基中,取0.1 mL 于全自动生长曲线分析仪中进行生长曲线的测定。
1.2.5 温度对菌株的影响
将分离菌株以1%的接种量接种到100 mL 液体培养基中,在20、30、35、40、50 ℃进行发酵培养,测定不同发酵时间段(0~160 h)的600 nm处吸光度。
1.2.6 产酶条件探究
取一定量的种子液接种到液体培养基中进行发酵培养,探究发酵温度、pH、接种量在不同发酵时间段(0~160 h)内的产酶情况。
发酵温度对产酶的影响:在接种量1%、pH 自然条件下,测定20、30、35、40、50 ℃时不同发酵时间(0~160 h)的内切型-β-葡聚糖酶、外切型-β-葡聚糖酶和β-葡萄糖苷酶活性。
发酵pH 对产酶的影响:在接种量1%、37 ℃条件下,测定发酵pH 为3、4、5、6、7、8 时不同发酵时间的内切型-β-葡聚糖酶、外切型-β-葡聚糖酶和β-葡萄糖苷酶活性。
接种量对产酶的影响:在37 ℃、pH 自然条件下,测定接种量为0.25%、0.5%、1.0%、1.5%、2.0%时不同发酵时间的内切型-β-葡聚糖酶、外切型-β-葡聚糖酶和β-葡萄糖苷酶活性。
1.2.7 数据分析
所有试验均进行3 次平行试验,采用Origin 2019进行绘图,并进行误差分析。
2 结果与分析
2.1 菌株筛选
2.1.1 初筛
以初筛培养基上的透明圈为指标(见图1),选取菌落形态较好、透明圈较大的菌落。综合发酵时间等因素,编号(见图1)后进行复筛。
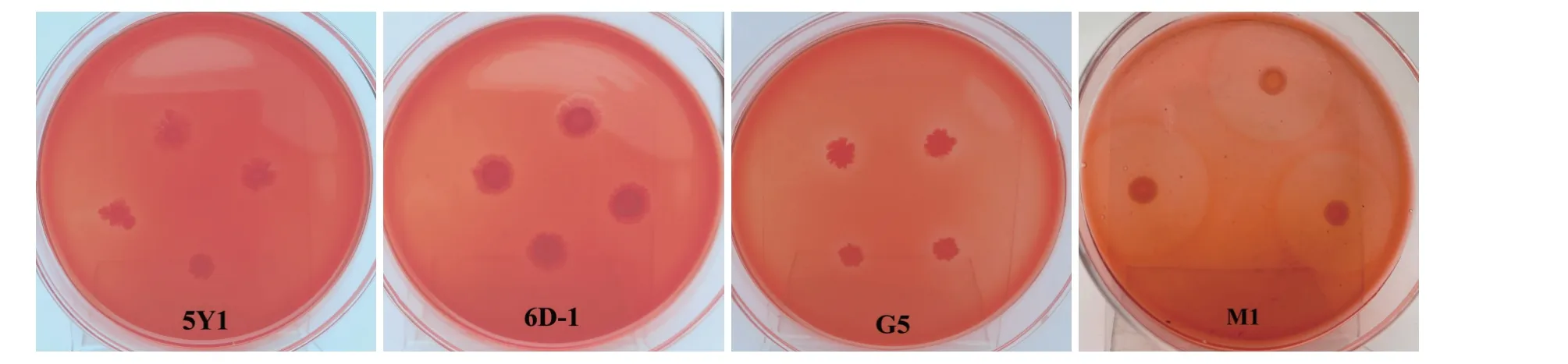
图1 分离菌株的菌落形态
2.1.2 复筛
以初筛得到的菌株进行发酵,测定发酵12、24、36、72 h 的发酵液540 nm 处吸光度,确定内切型-β-葡聚糖酶、外切型-β-葡聚糖酶活性,测定590 nm 处的吸光度,确定β-葡萄糖苷酶活性。不同菌株在不同发酵时间的产纤维素酶能力见表1。内切型-β-葡聚糖酶活性,M1 大于G5、6D-1,远远大于5Y1;外切型-β-葡聚糖酶活性,M1 大于5Y1、6D-1、G5;β-葡萄糖苷酶活性,M1大于G5、6D-1、5Y1。由此可见M1产酶能力最高,故选取M1为高产菌株。
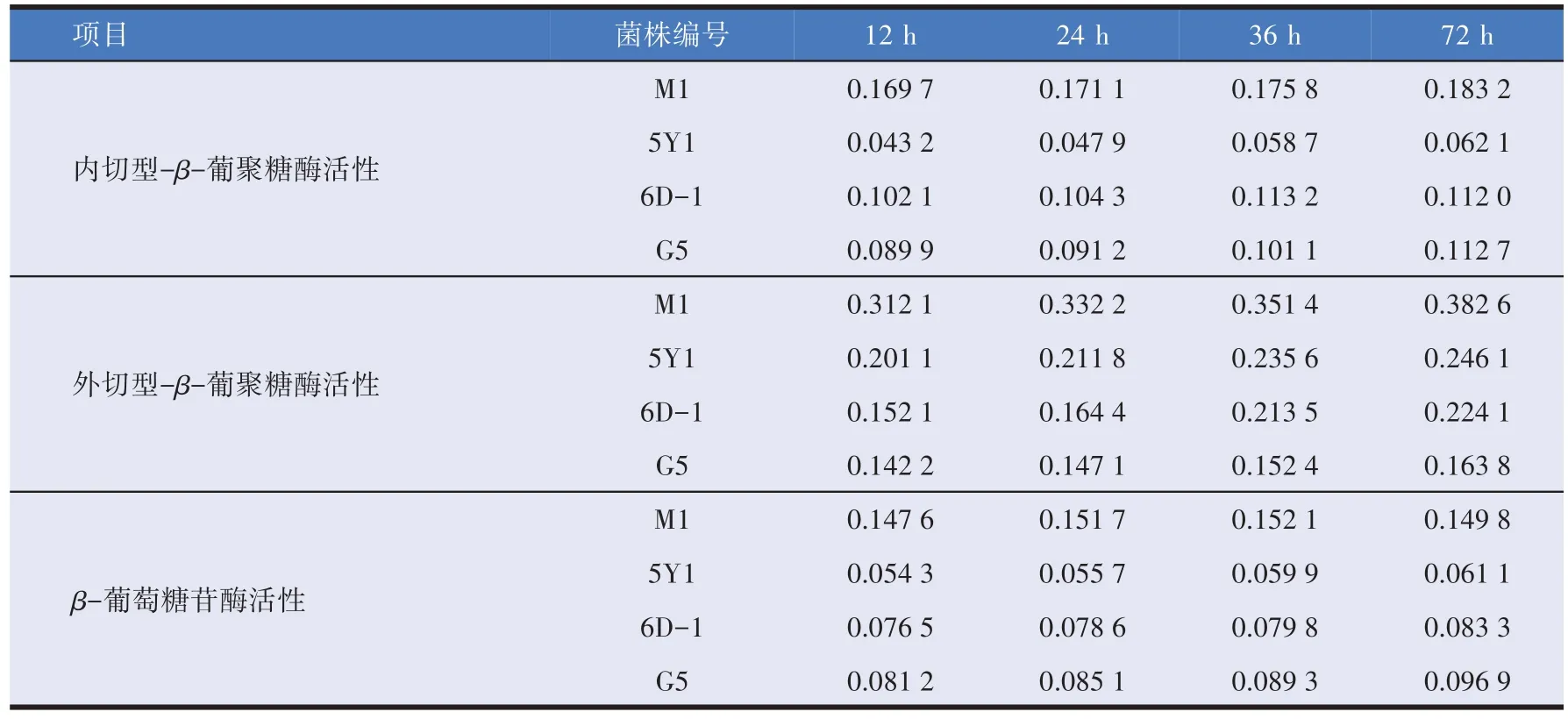
表1 纤维素酶活性(IU/mL)
2.2 菌株的形态观察与鉴定
如图1 所示,菌株M1 菌落呈乳白色且为表面光滑的圆形菌落,菌落边缘整齐,表面和背面一致平整,在刚果红培养基上菌落周围有透明圈分布。经革兰氏染色后结果如图2 所示,菌株M1 呈粉红色,是革兰氏阴性菌,显微镜下观察为短棒状。对M1 进行序列比,对结果显示M1 与 MT509910.1 克雷伯氏菌(Klebsiella oxytoca)16S rRNA 序列相似度高达99%,使用MEGA 7.0.14 软件的 Neighbor-Joining 方法构建系统发育树,如图3 所示。结合菌落形态的观察,鉴定菌株M1为克雷伯氏菌。
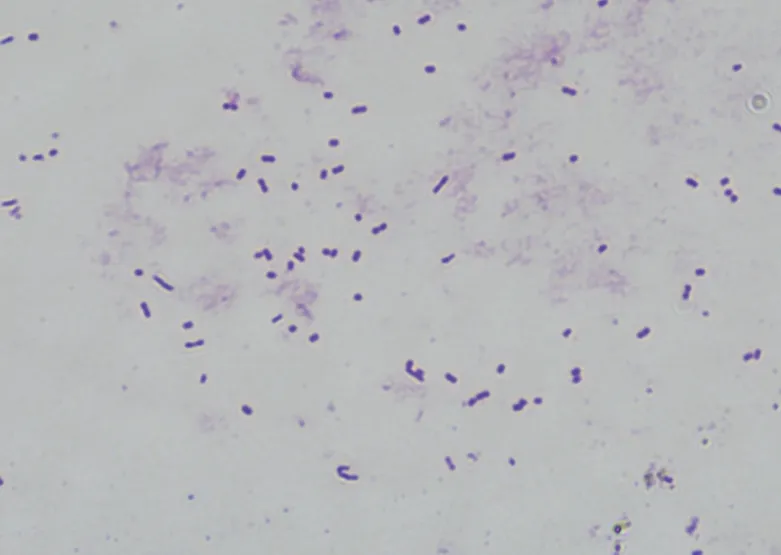
图2 菌株M1革兰氏染色(4×100)

图3 菌株M1基于16S rRNA构建的系统发育树
2.3 M1的生长曲线
用全自动生长曲线分析仪测量细菌在OD600时的细胞浊度,可以监控菌株M1 生长情况。如图4 所示,菌株M1 在0~45 h 时处于对数生长期,45 h 后进入稳定期,160 h 后进入衰亡期,此时菌株死亡率大于生长率。可能是因为培养基中的营养物质不足以满足微生物生长。
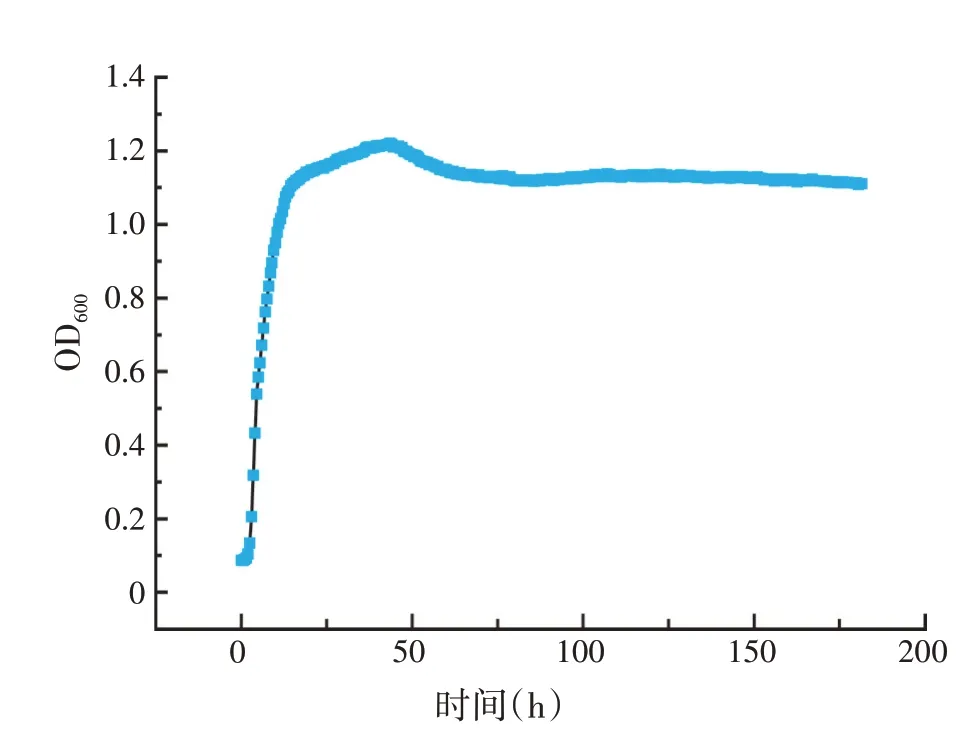
图4 M1生长曲线
2.4 发酵产酶条件优化
2.4.1 发酵温度对酶活的影响
如图5(a)所示,在发酵温度为35 ℃时,内切型-β-葡聚糖酶活性随着发酵时间的增加逐渐提高,在80~100 h 这段时间产酶速率最高,在发酵时间达到144 h 时,内切酶活性达到0.206 8 IU/mL。如图5(b)所示,在发酵温度为30 ℃时,发酵时间在96 h 时,产外切型-β-葡聚糖酶活性最高,为0.751 5 IU/mL。如图5(c)所示,当发酵温度为30 ℃时,发酵时间在60 h时,β-葡萄糖苷酶活性最高,为0.043 1 IU/mL。当发酵温度为50 ℃时,菌株M1 几乎不产纤维素酶,且酶活性不随发酵时间的变化而变化。
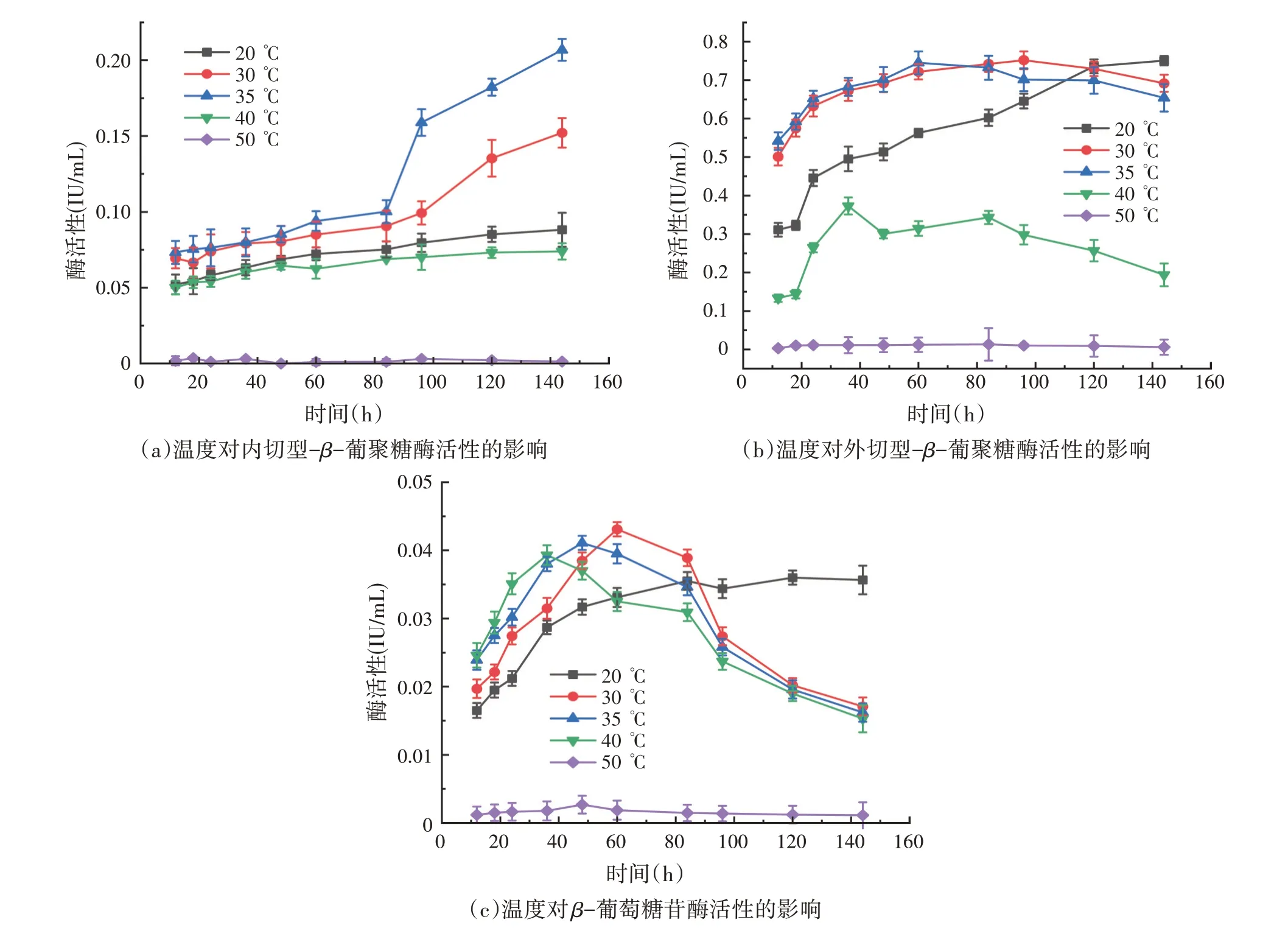
图5 温度对菌株M1产纤维素酶活性的影响
2.4.2 发酵pH对酶活性的影响
如图6(a)所示,当pH 为7 时,内切型-β-葡聚糖酶活性最高,且随时间增加逐渐增加,当发酵时间为144 h时,酶活性为0.159 4 IU/mL。如图6(b)所示,当pH为6、发酵时间96 h时,外切型-β-葡聚糖酶活性最高,为0.778 2 IU/mL。如图6(c)所示,当pH为6、发酵时间为60 h 时,β-葡萄糖苷酶活性为0.032 7 IU/mL。当pH 为3(过酸)时,菌株M1 几乎不产内切酶和β-葡萄糖苷酶,有少量的外切酶的产生;当pH 为8(过碱)时,菌株M1几乎不产纤维素酶。
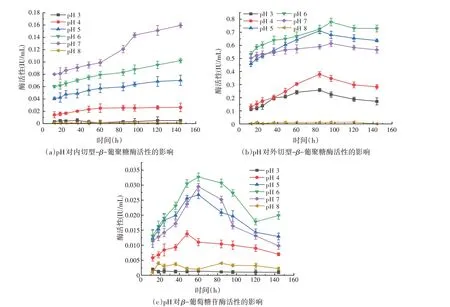
图6 发酵pH对菌株M1纤维素酶活性的影响
2.4.3 接种量对酶活性的影响
如图7(a)所示,当接种量为2.0%、发酵时间为120 h时,内切型-β-葡聚糖酶活性最高,为0.222 1 IU/mL;如图7(b)所示,当接种量为2.0%、发酵时间84 h 时,外切型-β-葡聚糖酶活性最高,为0.920 2 IU/mL。如图7(c)所示,当接种量为1.0%、发酵时间60 h时,β-葡萄糖苷酶活性最高,为0.039 7 IU/mL。
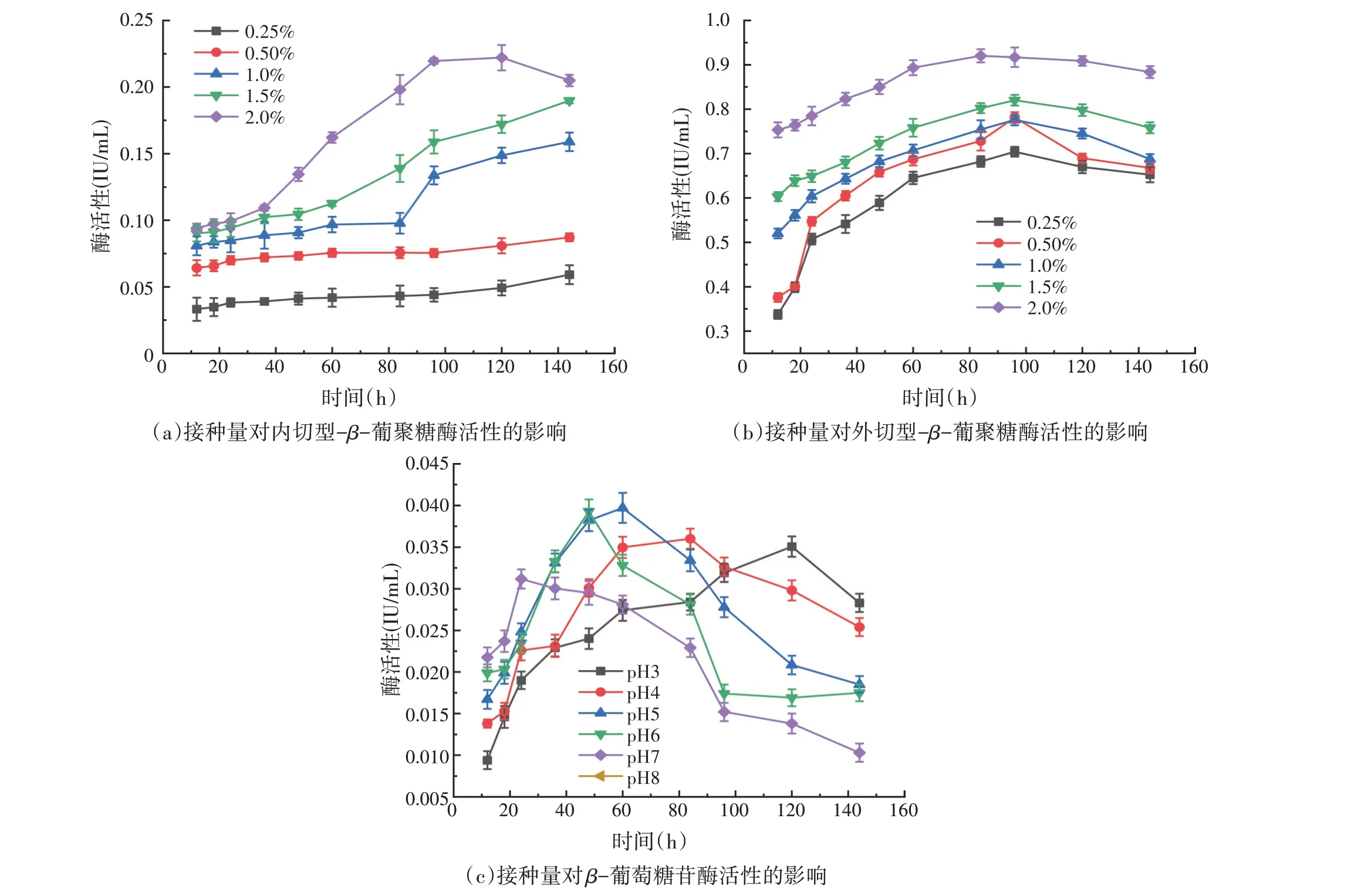
图7 接种量对菌株M1产纤维素酶活性的影响
3 讨论与结论
本研究从牦牛的瘤胃中筛选出了一株产纤维素酶的菌株M1,对其进行了生理生化、16S rDNA 的鉴定,并探究了生长特性和产酶条件。结果表明,菌株M1 是克雷伯氏菌,革兰氏阴性,呈短棒状,无鞭毛。在对菌株M1 产酶条件进行探究时发现,最适产纤维素内切型-β-葡聚糖酶的条件为35 ℃、pH 7、接种量2.0%,最适产纤维素外切型-β-葡聚糖酶的条件为30 ℃、pH 6、接种2.0%,最适产纤维素β-葡聚糖苷酶的条件为30 ℃、pH 6、接种量1.0%;在菌株M1发酵产酶过程中,外切酶活性远远大于内切酶和β-葡萄糖苷酶活性。本研究筛选出了一株肠杆菌属的纤维素酶高产菌株,可作为优良的试验材料,具有易培养、生长快速、基因安全、可进行遗传操作、成本低廉、安全可靠等特点,同时进行了3 种纤维素酶产酶特性探究,为纤维素酶的开发利用提供了依据,以期将分离菌作为添加剂添加到饲料中,提高饲料的消化率及营养价值。

