牡蛎肽对帕罗西汀致雄性小鼠性功能障碍的作用效果及潜在机制
黄倩倩 ,吴海英 ,秦小明
1. 广东海洋大学 食品科技学院,广东 湛江 524088
2. 国家贝类加工技术研发分中心(湛江)/广东省水产品加工与安全重点实验室/广东省亚热带果蔬加工科技创新中心,广东 湛江 524088
男性性行为是一个复杂的生理过程,包括性唤起、阴茎勃起、阴茎进入阴道、射精几个环节,其中任何一个环节出现障碍都称之为性功能障碍;而环境因素、生活习惯、心理因素、药物副作用等均有可能导致男性性功能障碍[1]。而这其中,药物副作用导致的男性性功能障碍需要引起关注。近年来,抑郁症患者比例逐年增加,而抗抑郁药,尤其是5-羟色胺再摄取抑制剂 (SSRIs),如帕罗西汀(PRX) 的临床使用,已被证实会对男性性功能产生不良影响,包括勃起障碍、射精障碍以及性欲异常等,这无疑加大了对抑郁症患者的伤害[2-3]。虽然磷酸二酯酶-5 抑制剂类药物如西地那非 (SDF),已被证明可用于治疗勃起功能障碍 (Erectile dysfunction, ED),但该药物会给患者带来其他副作用[4]。因此,亟需寻求一些无毒副作用的天然活性物质替代药物治疗男性性功能障碍。
人参 (PanaxginsengC. A. Mey.)、荸荠 (Eleocharisdulcis)、淫羊藿 (EpimediumbrevicornuMaxim.)、洋葱 (AlliumcepaL.)等的植物提取物因富含皂苷、类黄酮、三萜类化合物等生物活性物质,已被广泛应用于治疗男性性功能障碍[5-9]。近年来,海洋环境中的动植物同样为药物的发现提供了天然化合物库。郑环宇等[10]研究发现,华贵栉孔扇贝 (Mimachlamysnobilis)肉及其酶解产物可改善半去势大鼠的生殖能力。Qiong 等[11]研究发现,海带 (Laminariajaponica) 多糖对电离辐射损伤的雄性大鼠生殖系统及性能力均具有良好的恢复效果。此外,红海藻 (Rhodophytasp.) 对动物的睾丸功能也有增强作用[12]。海马 (Hippocampussp.) 活性肽与单环刺缢 (Urechisunicinctus) 活性肽同样被证实可增强男性性功能[13-14]。由此可见,开发海洋动植物新产品以改善男性性功能障碍具有较大的应用前景与潜力。
牡蛎又称海蛎子、蚝,肉质鲜美,富含蛋白质、氨基酸、多糖、微量元素等营养物质,被冠以“海洋牛奶”的美誉[15],是我国第一批纳入药食同源的食品之一[16]。牡蛎肉及其提取物具有改善学习记忆[17]、抗皮肤光老化[18]、抗氧化[19]、改善睡眠[20]等生物活性。此外,牡蛎肽 (Oyster peptide,OP) 还可以促进小鼠睾丸间质细胞睾酮与一氧化氮(NO)的产生[21],增强疲劳游泳后雄性小鼠的性行为[22]。本课题组前期研究也发现,牡蛎肉及其酶解产物可以提高半去势大鼠的性能力[23],促进小鼠睾丸间质细胞的睾酮分泌[15],且牡蛎水解产物对雷公藤甲素诱导的雄性小鼠睾丸损伤具有潜在的保护作用[24]。由此可见,牡蛎肽在改善男性性功能活性方面具有较大潜力。但其改善男性性功能障碍的作用效果及机制依然不明确,缺乏足够的理论支持,且关于牡蛎肽对PRX 诱导的性功能障碍的作用效果的相关研究尚未见报道。因此,本研究以牡蛎肽为研究对象,以PRX 口腔灌胃构建雄性小鼠性功能障碍模型,探讨牡蛎肽对雄性小鼠性功能障碍的作用效果及其可能机制;以期为研发出相关的牡蛎产品提供理论依据,并为抗抑郁药的临床使用提供新方案。
1 材料与方法
1.1 材料与试剂
实验原料:牡蛎肽 (生产许可证号:SC1061630 2300695;执行标准:Q/SMN0012S-2021;保质期36 个月;产品批号:20220712B),购自海南盛美诺生物技术有限公司澄迈分公司。
实验动物:64 只健康的SPF 级ICR 小鼠[ (26±2) g],雌雄各半,购自广州市研成生物科技有限公司。动物许可证号SCXK (京) 2019-0010,动物饲养处于无菌环境,温度为22~26 ℃,湿度为50%~60%,明暗交替12 h,自由进食 (C60 辐照实验鼠维持饲料) 和饮水。整个动物实验过程严格按照广东海洋大学动物实验伦理委员会有关规定执行。
实验药品与试剂:盐酸帕罗西汀片 (H10950043)购自中美天津史克制药有限公司;枸橼酸西地那非片 (H20020527) 购自辉瑞制药有限公司;苯甲酸雌二醇注射液 (兽药字163232511)、黄体酮注射液(兽药字163231439) 均购自上海全宇生物科技 (驻马店) 动物药业有限公司;小鼠睾酮 (Testosterone,T) ELISA 试剂盒、小鼠促黄体生成素 (Luteinizing hormone, LH) ELISA 试剂盒、小鼠促卵泡生成素(Follicle stimulating hormone, FSH) ELISA 试剂盒、小鼠雌二醇 (Estradiol, E2) ELISA 试剂盒、小鼠环磷酸鸟苷 (cGMP) ELISA 试剂盒、小鼠磷酸二酯酶5 (PDE5) ELISA 试剂盒均购自江苏酶免实业有限公司; NO、一氧化氮合酶 (NOS)、酸性磷酸酶 (ACP)、碱性磷酸酶 (ALP)、乳酸脱氢酶 (LDH)、超氧化物歧化酶 (SOD)、丙二醛 (MDA) 的测定试剂盒均购自南京建成生物工程研究所;BCA 蛋白浓度测定试剂盒 (增强型)购自上海碧云天生物技术有限公司。分子量所用标品:细胞色素C (分子量12384)、抑肽酶 (分子量6500)、杆菌肽 (分子量1422)、乙氨酸-乙氨酸-酪氨酸-精氨酸 (分子量451)、乙氨酸-乙氨酸-乙氨酸 (分子量189),纯度均≥95%,均购自Sigma 公司。17 种氨基酸标准品均购自Sigma 公司。
仪器与设备:Varioskan Flash 全自动酶标仪(美国Thermo 公司);Waters 2695 高效液相色谱仪(配2487 紫外检测器和Empower 工作站GPC 软件,美国Waters 公司);CKX41 型倒置显微镜 (日本Olympus 公司);正置光学显微镜,日本尼康;JOYN-SXT-06B 脂肪测定仪 (上海乔跃电子科技有限公司);HX204 水分测定仪 (瑞士METTLER TOLEDO 公司);KjeltecTM8200kai 凯氏定氮仪 [福斯华 (北京) 科贸有限公司];3-550PD 马弗炉 (美国Neytech 公司)。
1.2 方法
1.2.1 基本成分测定
按GB 5009.5—2016 凯氏定氮法测定样品粗蛋白含量;按GB 5009.6—2016 索氏抽提法测定粗脂肪含量;按GB 5009.3—2016 常压干燥法测定样品水分含量;按GB 5009.4—2016 高温灼烧法测定灰分含量;按GB/T 9695.31—2008 苯酚-硫酸法测定样品总糖含量。
1.2.2 分子量测定
色谱柱:TSKgel 2000 SWXL 300 mm×7.8 mm;流动相:乙腈/水/三氟乙酸,40/60/0.1 (体积比);检测:UV 220 nm;流速:0.5 mL·min−1;柱温:30 ℃。
1.2.3 游离氨基酸测定
参照GB/T 22729—2008《海洋鱼低聚肽粉》测定牡蛎肽游离氨基酸含量。
1.2.4 动物实验
ICR 雄性小鼠适应性喂养7 d 后随机分为4 组(n=8):空白组 (CN,等体积蒸馏水);模型组 (帕罗西汀,14 mg·kg−1PRX);阳性组 (14 mg·kg−1PRX+7 mg·kg−1SDF);牡蛎肽组 (14 mg·kg−1PRX+500 mg·kg−1OP),对所有实验组小鼠连续口腔灌胃28 d。帕罗西汀与西地那非的给药剂量参考Ademosun 等[25]的研究。笔者课题组前期研究发现牡蛎酶解产物在250、500 和1 000 mg·kg−13 个剂量组中,中剂量组 (500 mg·kg−1) 对雄性小鼠生殖障碍的保护作用效果最佳[26]。因此,参考上述研究结果,本研究仅选用500 mg·kg−1剂量组,探讨牡蛎肽在PRX 导致的性功能障碍中的作用效果。
交配行为实验于末次口腔灌胃结束60 min 后进行。正式交配前48 h,对雌性小鼠肌内注射0.2 mg·只−1的苯甲酸雌二醇注射液,于前4 h 注射1 mg·kg−1的黄体酮注射液,使雌性小鼠处于动情期[27]。实验安排在安静、暗红灯光下的房间里,于晚上20: 00—24: 00 进行,雄性小鼠先置于30 cm×15 cm×15 cm 规格的笼中适应15 min,随后采用高清摄像头记录,从雌性小鼠放进笼子起开始记录,观察并记录前30 min 的交配行为参数,包括骑跨潜伏期 (Mount latency,ML,雌鼠进入笼子至雄鼠第一次出现骑跨行为的时间间隔)、骑跨频率 (Mount frequency,MF,雄鼠发生骑跨行为的次数)、插入潜伏期 (Intromission latency,IL,雄鼠首次插入雌鼠阴道的时间)、插入频率 (Intromission frequency,IF,从雌鼠进入到实验结束时雄鼠总的插入次数)、射精潜伏期 (Ejaculation latency,EL,雄性小鼠首次插入至射精的时间间隔)、射精后间隔期 (Post ejaculation interval,PEL,雄性小鼠射精后至再次插入的时间间隔)[28]。
实验小鼠末次口腔灌胃结束后禁食不禁水12 h,称量并记录各组实验小鼠体质量后摘去眼球取血,随后分别取出小鼠阴茎、精囊腺、睾丸、心脏、胸腔、脾、肝脏、肾脏、肺并用电子天平精确称量,计算脏器系数:
血清激素水平测定:取血后,血液于室温下自然凝固15 min,4 ℃下3 000 r·min−1离心15 min,取血清;按照ELISA 试剂盒说明测定血清中睾酮(T)、促黄体生成激素 (LH)、促卵泡生成激素(FSH) 和雌二醇 (E2) 含量。
阴茎组织指标测定:按照试剂盒说明书制备阴茎组织匀浆液,并测定匀浆中蛋白质含量、NO 含量、NOS 活性、cGMP 含量与PDE5 活性。
睾丸组织指标测定:按照试剂盒说明书制备右侧睾丸组织匀浆液,并测定匀浆中蛋白质含量,ACP、ALP、LDH、SOD 活性以及MDA 含量。
睾丸组织病理切片:将小鼠左侧睾丸分别用甲醛固定液固定、包埋、切片、HE 染色及采集图像。
精子质量:取小鼠左右附睾于装有生理盐水的EP 管中剪碎,摇匀,37 ℃水浴孵育15 min;取一滴稀释液于血球计数板上,在光学显微镜下计数5 个方格中的精子数量,每毫升精子数量等于N×稀释倍数×5×104。另取1 滴稀释液涂片,观察200 个精子,并计数其中有活动能力的精子数以计算精子活率。此外,根据精子快速染色试剂盒说明书对精子进行染色,并使用倒置显微镜观察与捕获染色后的精子图像,并对精子形态进行分析。
1.2.5 数据统计分析
所有数据采用SPSS 27、Excel 2021、GraphPad 9.3 软件进行统计分析及绘图,通过单因素方差分析 (One-way ANOVA) 分析数据,P<0.05 表示差异显著,P<0.01 表示差异非常显著,P<0.001 表示差异极显著,三者均具有统计学意义,所有实验结果均用“平均值±标准差”表示。
2 结果
2.1 牡蛎肽基本成分分析
按照国标方法对牡蛎肽基本成分含量进行测定(n=3),以干基计,牡蛎肽中粗蛋白质量分数最高(70.61%),其次是总糖 (25.75%),粗脂肪质量分数仅为6.17%,灰分和水分质量分数分别为5.06%和6.65%,说明牡蛎肽是一种高蛋白低脂肪的物质,具有较高的营养价值。
2.2 相对分子质量分布与游离氨基酸分析
牡蛎肽的相对分子质量分布情况如图1 所示,主要集中在<1 000 D,含量高达95.66%,其中<500 D 占83.41%,表明该牡蛎肽主要为小分子肽段,具有吸收效率高、能量消耗低的特点[29];因此,可以推断该小分子牡蛎肽具有较好的生物利用率。此外,牡蛎肽游离氨基酸中含人体所需的7 种必需氨基酸 (表1),且必需氨基酸在游离氨基酸总量中占比为49.29%,支链氨基酸占比为21.35%,疏水性氨基酸占比为40.71%。适量补充必需氨基酸可在一定程度上促进机体新陈代谢并增强生育能力[30],补充支链氨基酸可以提高机体的运动能力、减缓疲劳[31]。而疏水性氨基酸则具有较强的抗氧化能力[32]。牡蛎肽游离氨基酸含量及构成说明其具有较高的营养价值。
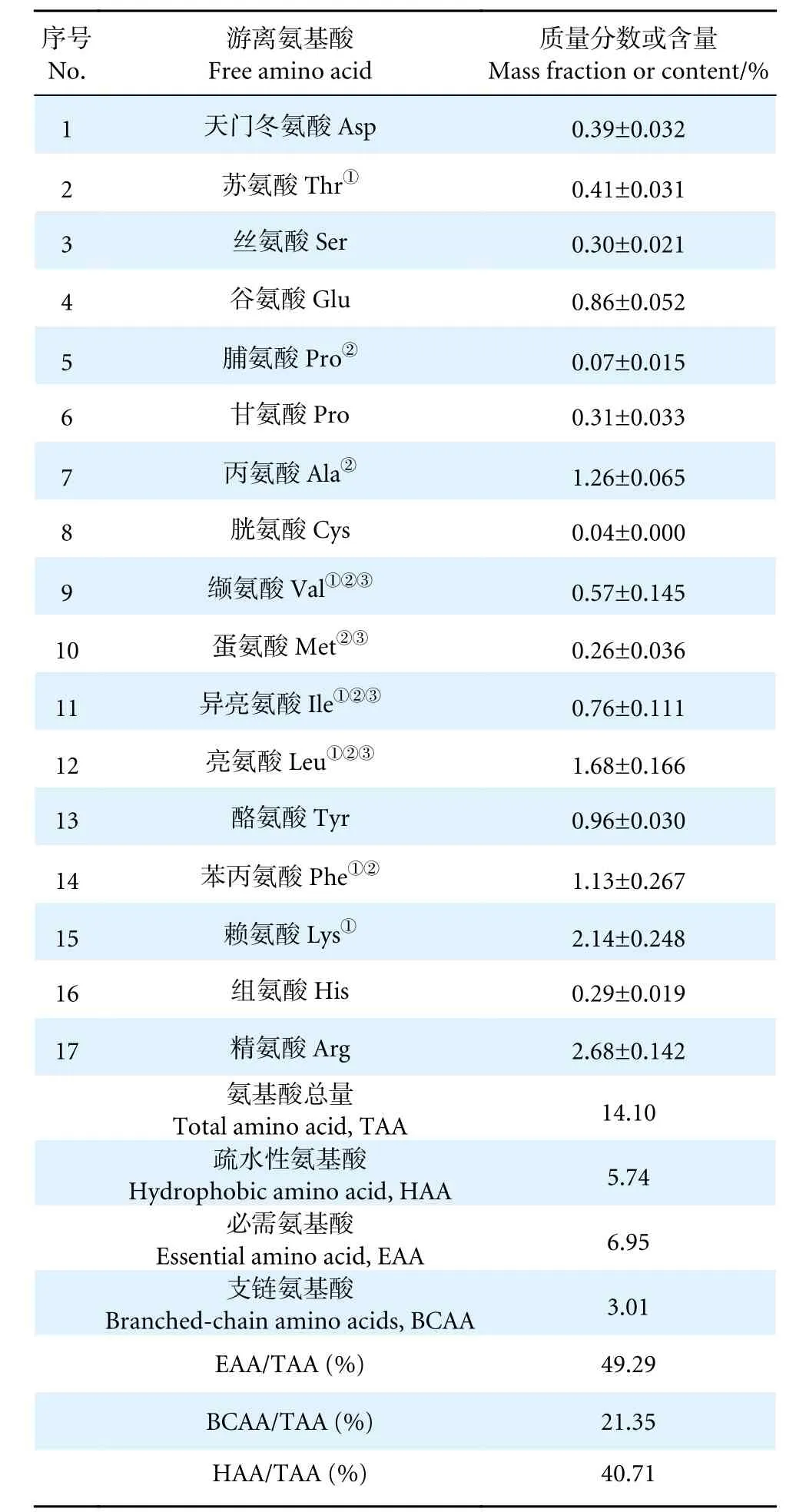
表1 牡蛎肽游离氨基酸含量分析Table 1 Analysis of free amino acid content of oyster peptid
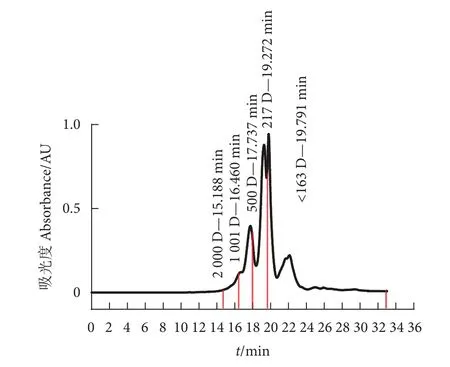
图1 牡蛎肽相对分子质量分布色谱图Fig. 1 Chromatogram of relative molecular mass distribution of oyster peptides
2.3 牡蛎肽对小鼠交配行为的影响
雄性小鼠交配行为实验结果如图2 所示。与CN 组相比,PRX 组小鼠显著延长了ML、IL、EL 与PEL (P<0.001,P<0.001,P<0.05,P<0.01);而经牡蛎肽与SDF 干预后,与PRX 组相比,雄性小鼠ML、IL 与PEL 得到了有效缩短 (P<0.001,P<0.01,P<0.05),但EL 无统计学意义 (P>0.05)。此外,与CN 组相比,PRX 组小鼠MF 和IF 分别显著减少了43.68%和41.54% (P<0.01);而与PRX 组相比,PRX+OP 组分别使小鼠MF 和IF 显著提高了57.14%和50.00% (P<0.01,P<0.05),SDF 作为阳性药物,同样显著提高了MF 和 IF (P<0.05)。
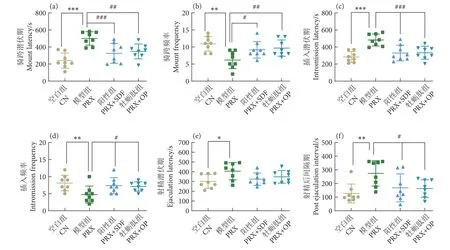
图2 牡蛎肽对小鼠交配行为的影响Fig. 2 Effect of oyster peptid on sexual behavior in mice
2.4 牡蛎肽对小鼠脏器系数的影响
由表2 可知,与CN 组相比,PRX、PRX+SDF 与PRX+OP 组的内脏系数及阴茎系数均无显著性差异 (P>0.05),而PRX+SDF 与PRX+OP 组的睾丸系数与精囊腺系数,相比PRX 组均显著增大(P<0.01,P<0.05)。附性腺器官的质量往往与雄性动物的雄激素活性及性能力相关,雄激素对附性腺器官细胞具有增殖增大的作用,即附性腺器官系数的增大可初步判断样品具有雄激素效应[33]。本研究发现牡蛎肽在一定程度上增大了睾丸系数与精囊腺系数,表明牡蛎肽具有雄激素作用,可通过作用附性腺器官细胞的增殖增大而达到提高雄性小鼠性能力的效果。
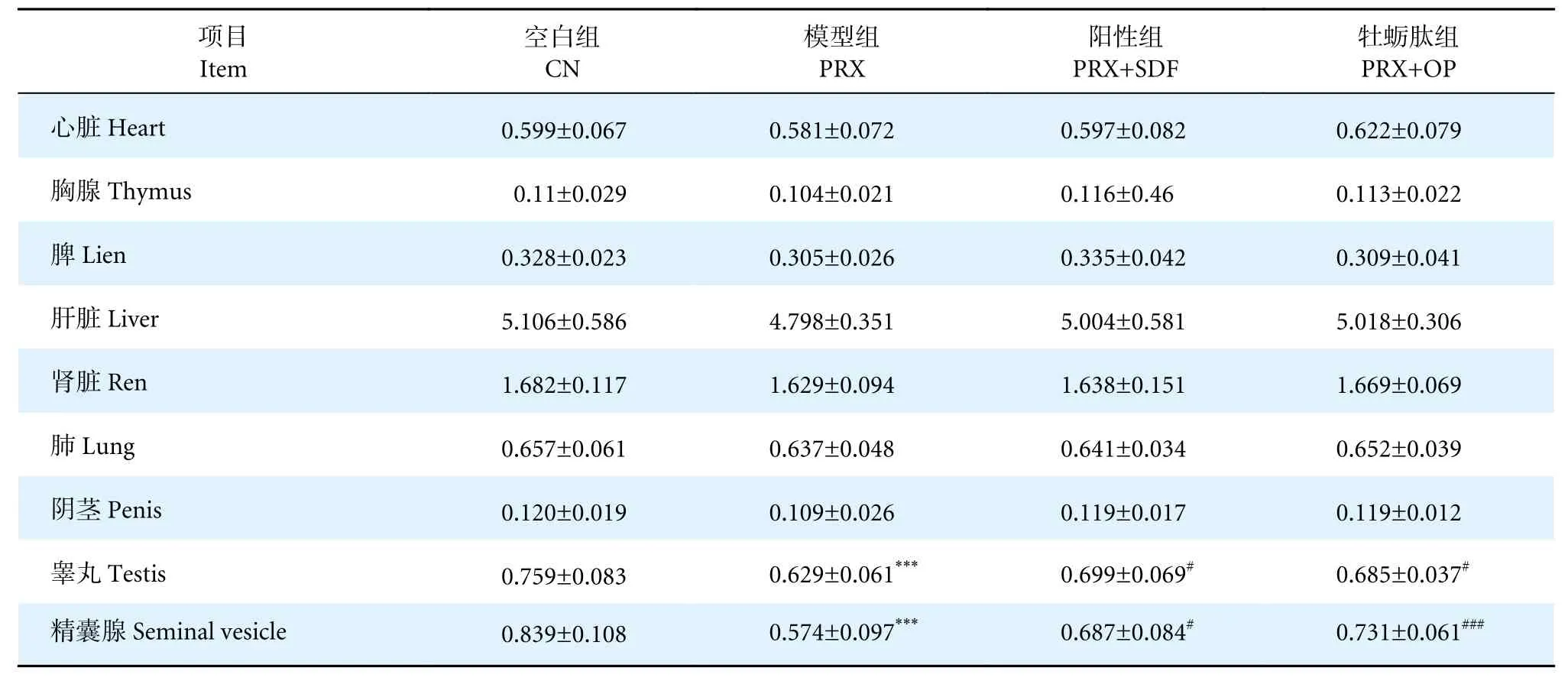
表2 牡蛎肽对脏器系数的影响Table 2 Effect of oyster peptid on organ coefficient%
2.5 牡蛎肽对小鼠血清性激素的影响
血清性激素水平是评价性能力强弱的关键指标,如图3 所示。与CN 组相比,PRX 组T、LH、FSH、E2 浓度显著降低 (P<0.001,P<0.01,P<0.01,P<0.001),显然,PRX 的给药干扰了雄性小鼠的性激素水平。而与PRX 组相比,牡蛎肽与SDF 的给药使雄性小鼠的T、LH 与FSH 浓度恢复至接近CN 组水平 (P<0.001,P<0.01,P<0.05)。此外,与PRX 组相比,PRX+OP 组可使小鼠E2 浓度显著升高 (P<0.01),而PRX+SDF 组E2 浓度则无统计学意义 (P>0.05),可能是牡蛎肽使雄性动物体内芳香化酶活性增强,从而使T 芳香化为E2,而SDF 则无此作用[34]。
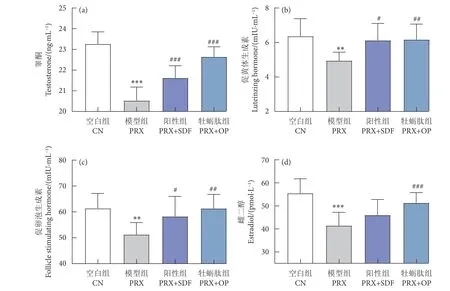
图3 牡蛎肽对血清性激素的影响Fig. 3 Effect of oyster peptid on serum sex hormones
2.6 牡蛎肽对小鼠阴茎组织勃起参数的影响
阴茎组织中的NO 与cGMP 含量,及NOS 与PDE-5 活性是雄性阴茎勃起生理过程中的关键因素。由图4 可知,与CN 组相比,PRX 组NO 含量、cGMP 含量与NOS 活性显著降低 (P<0.001),PDE5活性显著升高 (P<0.001);由此可见,PRX 的给药导致雄性小鼠阴茎勃起障碍。而与PRX 组相比,PRX+SDF 与PRX+OP 组可提高小鼠阴茎组织NO(P<0.01) 与cGMP 含量 (P<0.05),恢复NOS 活性(P<0.05),降低PDE-5 活性 (P<0.01)。说明牡蛎肽可以在NO/cGMP 信号通路上发挥作用,从而改善PRX 导致的勃起功能障碍。
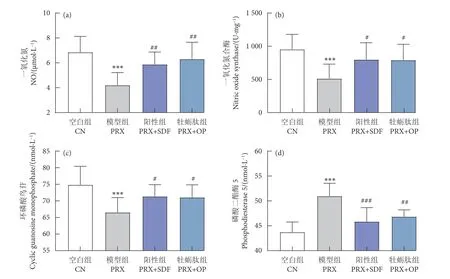
图4 牡蛎肽对阴茎组织一氧化氮、一氧化氮合酶、环磷酸鸟苷、磷酸二酯酶-5 含量或活性的影响Fig. 4 Effect of OP on content or activity of NO, NOS, cGMP and PDE5 in penile tissue
2.7 牡蛎肽对小鼠睾丸组织酶活性及MDA 含量的影响
ACP、ALP 与LDH 是睾丸标志酶,被认为是精子发生及睾丸发育的功能性指标[24]。当睾丸标志性酶活性发生变化时,睾丸功能及精子发生功能会受到相应影响。由图5 可知,与CN 组相比,PRX 组ACP、ALP 与LDH 活性显著降低 (P<0.01),可见PRX 可导致小鼠睾丸标志性酶活性下降。而与PRX 组相比,牡蛎肽与SDF 处理可显著提高ACP 与LDH 的活性 (P<0.01,P<0.05),但牡蛎肽对ALP 活性的影响则无统计学意义 (P>0.05)。
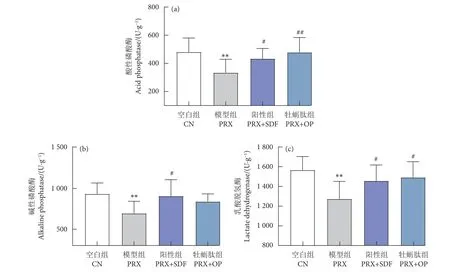
图5 牡蛎肽对睾丸组织标志性酶的影响Fig. 5 Effect of oyster peptid on marker enzymes of testis tissue
氧化应激是导致睾丸损伤及雄性动物性能力低下的重要原因,在PRX 诱导的雄性小鼠性功能障碍模型中也发现了这一现象。由图6 可知,PRX引起脂质过氧化物MDA 含量显著高于CN 组(P<0.01),SOD 活性显著低于CN 组 (P<0.01),可见PRX 可通过破坏小鼠睾丸组织的抗氧化系统而降低其抗氧化能力。经牡蛎肽处理后,与PRX 组相比,MDA 含量显著低于PRX 组 (P<0.01),SOD 活性也得到了显著提高 (P<0.01)。说明牡蛎肽可减缓PRX 引起的睾丸氧化应激损伤。
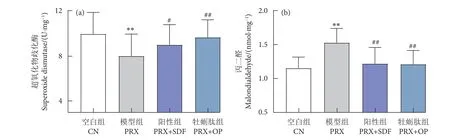
图6 牡蛎肽对睾丸组织抗氧化能力的影响Fig. 6 Effect of oyster peptid on antioxidant capacity of testis tissue
2.8 牡蛎肽对睾丸组织结构及精子质量的影响
由图7 可知,睾丸组织HE 染色切片结果表明,CN 组小鼠睾丸组织内生精小管排列整齐有序,生精细胞数量丰富、形态规则良好;而PRX组小鼠睾丸组织生精小管内生精细胞排列稀松紊乱,细胞数量锐减,管腔内空泡化严重。而经牡蛎肽处理后,生精小管内细胞排列规整、分布均匀,细胞数量明显增加,形态也明显改善。由此可见,牡蛎肽可以减缓PRX 导致的睾丸组织结构损伤。
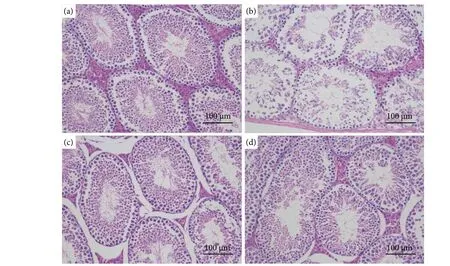
图7 睾丸组织病理分析Fig. 7 Pathological analysis of testicular tissue
精子质量可由精子数量、活率和形态反映出来。如图8 所示,PRX 组小鼠精子数量与活率较CN 组显著下降 (P<0.001);而与PRX 组相比,PRX+SDF 与PRX+OP 组可有效改善精子数量与活率(P<0.01,P<0.001)。此外,由图9 可知,PRX 组小鼠出现大量盘绕尾巴、弯曲尾巴、环颈、无头、无尾等畸形精子;而牡蛎肽处理后,可有效降低精子发生异常。结果表明,PRX 对雄性小鼠精子质量也产生了不利影响,与2.7 所述影响精子发生的几种睾丸标志性酶活性下降的结果及睾丸组织HE 染色切片结果一致;本研究发现也与Saikia等[35]的结果相似。
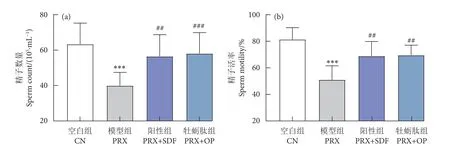
图8 精子数量与活率Fig. 8 Sperm count and motility
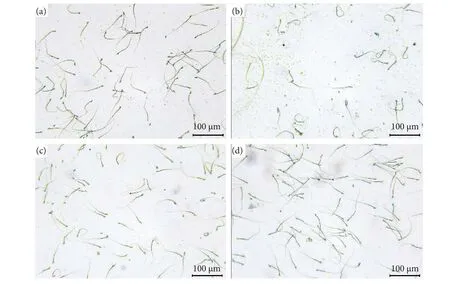
图9 精子形态分析Fig. 9 Sperm morphology analysis
3 讨论
大量研究表明,持续服用抗抑郁药PRX 后会导致雄性动物的性能力下降,包括ML、IL、EL、PEL 的延长,以及MF 与IF 的下降[2],而这些性行为指标是反映雄性动物性能力强弱最直观的指标。在本研究中,雄性小鼠经口腔灌胃PRX 28 d 后,性能力明显下降,而经牡蛎肽干预后,其性能力得到明显改善,与Luo 等[22]研究发现牡蛎肽可以提高疲劳雄性小鼠性能力的结果相似。
性激素具有促进性腺器官生长发育、促进性成熟、刺激性欲等作用,在维持男性性健康中发挥着关键作用[26]。雄性小鼠在服用PRX 后,血清性激素水平显著低于CN 组,可能是PRX 作用后对性腺轴产生了直接的毒性作用,亦或是PRX 对下丘脑或垂体的毒性作用而间接影响了性激素的合成与释放[36]。本研究中PRX 导致的性激素水平下降与已有研究结果[36-38]一致,即持续服用PRX 会导致雄性动物性激素水平紊乱,继而诱发雄性动物性功能障碍。然而经牡蛎肽处理后,雄性小鼠性激素水平可恢复至接近正常水平,说明牡蛎肽可能通过介导“下丘脑-垂体-性腺轴”而调节PRX 导致的雄性小鼠性激素水平紊乱。
此外,本研究通过测定牡蛎肽游离氨基酸含量发现,其精氨酸含量在所有游离氨基酸中占比最高。研究发现,L-精氨酸除可以维持精子功能、改善精子质量,提高血清睾酮浓度外,其亦是NO 的合成前体,在NOS 的作用下参与NO/cGMP 信号通路;当NO 进入到阴茎平滑肌细胞后,可使鸟苷酸环化酶 (Guanylate cyclase, GC) 激活,从而升高平滑肌细胞内的cGMP 浓度,进而降低钙离子(Ca2+) 浓度使平滑肌松弛,最终引起阴茎勃起[39-40]。而PDE-5 则是NO/cGMP 勃起通路中的破坏者,可降解cGMP,导致平滑肌细胞内的cGMP 浓度下降,使阴茎难以勃起[41]。在本研究中,PRX 组中NO 浓度的下降,可能是由于PRX 的作用使得精氨酸酶活性增强,从而使L-精氨酸发生了降解[25];抑或是因为PRX 导致的氧化应激,使得超氧化物与NO 作用形成了过氧亚硝酸盐[42]。而经牡蛎肽处理后,雄性小鼠NO、cGMP 含量与NOS 活性较PRX 组显著提高,PDE-5 活性显著降低,可见牡蛎肽可能作为前体物质提高平滑肌细胞内NO与cGMP 浓度,亦可能作为精氨酸酶与PDE-5 的抑制剂而抑制精氨酸酶与PDE-5 的活性,以达到维持NO 与cGMP 浓度的目的。
精子的发生功能与睾丸标志性酶ACP、ALP和LDH 的活性密切相关,ACP 主要负责睾丸生殖细胞之间的物质交换,促进精母细胞的发育;ALP 主要负责管腔液与精子膜之间的物质交换,以及雄激素在精管周间质与曲细精管之间的转移;而LDH 主要影响精子发生过程中的能量代谢与生物利用度[43]。本研究中PRX 作用后,睾丸磷酸酶与LDH 活性均显著低于正常水平,影响了睾丸的生物功能与代谢活性,导致雄激素与精子细胞能量的生物利用度均降低。然而,在使用牡蛎肽干预后,睾丸标志性酶活性明显增强,说明牡蛎肽具有较强的雄激素效应,在维持睾丸功能与精子发生功能方面发挥着关键作用。
氧化应激是导致男性ED 与生殖障碍的重要原因。Ogunro 和Yakubu[44]发现,PRX 作用后,睾丸组织的抗氧化防御系统遭到严重破坏;Adefegha 等[45]也发现,PRX 会引起睾丸脂质过氧化物MDA 含量与非蛋白硫醇含量升高。由此可见,PRX 的作用会诱导雄性动物产生氧化应激,进而影响男性性功能,这一现象在本研究中PRX 组小鼠睾丸组织SOD 活性较CN 组显著下降,MDA 含量显著升高的结果中也得到了验证。而牡蛎肽作用后,有效减缓了PRX 导致的氧化应激损伤,说明牡蛎肽具有较强的抗氧化能力,这在本课题组前期的大量研究中也有类似发现[24,26]。
综上,牡蛎肽对PRX 导致的雄性小鼠性功能障碍具有潜在保护作用,其作用机制可能与介导“下丘脑-垂体-性腺轴”调节性激素水平、作用NO/cGMP 勃起信号通路、减缓氧化应激损伤有关。本研究为今后研发相关的牡蛎产品提供了理论依据,也为药物PRX 导致的性功能障碍的作用机制研究及PRX 的临床使用提供了新的研究方案。

