构建癌胚抗原、糖类抗原19-9生存模型公式预测结直肠癌患者生存时间*
黄俊强(江门市中心医院检验科,广东江门 529000)
2022年,中国国家癌症中心的统计数据显示,我国结直肠癌(colorectal cancer,CRC)的发病率及死亡率分别高居所有癌症的第二位和第四位,近年来,其发病率和死亡率呈逐年上升趋势[1],因此亟需寻找CRC患者新的预后分层标志物,以准确评估CRC患者的预后。现阶段与CRC相关的生物学标志物研究主要集中在DNA、RNA、微小RNA、表观遗传变化和抗体等[2]方面,上述生物学标志物存在价格昂贵、侵入性强,患者依从性较低等缺点,而常见的血清学肿瘤标志物如血清甲胎蛋白(alpha-fetoprotein, AFP)、癌胚抗原(carcinoembryonic antigen, CEA)、糖链抗原19-9(carbohydrate antigen 19-9, CA19-9)等,由于其侵入性小、价格便宜等优点,已被广泛应用于肿瘤的早期诊断[3];在《中国结直肠癌诊疗规范(2023版)》中也将外周血CEA、CA19-9作为CRC患者诊断和随访的指标,并建议有肝转移的患者应检测AFP[4],但其提示CRC患者预后的价值尚不清楚。因此,本研究通过分别测定CRC患者术前血清CEA、CA19-9水平,进一步联合CEA、CA19-9构建对CRC患者预后的预测模型,并探讨该模型对CRC患者预后和生存的预测价值。
1 材料和方法
1.1研究对象 为随访CRC患者的10年总生存时间(overall survival,OS),本研究收集2010年1月至2011年9月江门市中心医院就诊的313例CRC患者,并随访至2021年2月。包括男177例,女136例,年龄24~89岁。早期(Ⅰ+Ⅱ期)患者180例,晚期(Ⅲ+Ⅳ期)患者133例。其中存在远端转移的病例36例(分别为20例转移至肝、3例转移至肺、2例转移至膀胱、3例转移至腹腔、2例转移至卵巢、6例转移至阑尾等器官)。
1.2病例纳入与排除标准 所有研究对象术前进行肿瘤标志物测定,术前未接受任何治疗,术后均经病理组织学确诊,随访资料完整,并且CRC是唯一的原发肿瘤,无其他继发性肿瘤,无其他各种慢性疾病,排除转移部位为胰腺及有各种炎症的患者。
1.3方法 采集患者住院手术前的晨起空腹静脉血3 mL,以1 000×g离心15 min分离血清,采用电化学发光测定法,按照Beckman Access化学发光免疫分析仪及其配套的试剂(美国贝克曼库尔特公司)说明书检测术前CEA、CA19-9、AFP水平,术后3个月内进行CEA、CA19-9第一次随访检测,所有患者标本均与有效质控品在相同条件下测定,有效质控品严格按照质控品说明书操作,并根据20个数据和3~5个月在控数据设定常用均值和标准差。根据国家卫生健康委员会临床常用免疫学检验项目参考区间[5],CEA参考区间0~5 μg/L,CA19-9参考区间0~34 U/mL,AFP参考区间0~7 μg/L,以检测的水平高于临界值判定为高表达。
1.4统计学分析 采用SPSS 16.0(SPSS,Inc)软件进行统计分析。采用χ2检验分析术前各项肿瘤标志物水平与CRC患者临床病理参数的相关性,CRC患者的生存分析采用Kaplan-Meier法Log-Rank检验进行评价。采用Cox比例风险模型进行多变量分析。对所有P值进行双侧分析,以P<0.05为差异有统计学意义。
2 结果
2.1CRC患者手术前后各项肿瘤标志物与临床病理参数的关系 术前CEA在43.13%(135/313)的CRC患者中表达升高,但只有34.44%(62/180)的Ⅰ+Ⅱ期患者CEA呈高表达,有54.89%(73/133)的Ⅲ+Ⅳ期患者CEA升高。进一步分析发现CEA与年龄,pT、pN、pM分期,临床分期,进展,复发,脉管及神经浸润,转移部位等显著相关(P<0.05),而与其余病理参数无关(表1)。在313例CRC患者中,术前CA19-9升高者占比15.97%(50/313),在早期的CRC患者中,只有10%(18/180)的患者CA19-9升高,而在晚期CRC患者中占比28.57%(32/133)。进一步进行χ2检验分析显示CA19-9与CRC脉管侵犯,pN、pM分期,临床分期,复发,进展等显著相关(P<0.05),但与其余病理参数无相关性。AFP在CRC患者中表达正常。术后CEA升高占比为11.82%(37/313),明显少于术前,且CEA升高与脉管浸润,神经浸润,浆膜浸润,淋巴结转移,远处转移,临床分期,复发,进展,转移部位等因素显著相关(P<0.05)。而术后CA19-9升高占比为3.83%(12/313),其升高与脉管浸润,神经浸润,pN、pM分期、临床分期,复发,转移部位等因素显著相关(P<0.05)。
2.2CRC患者临床病理参数的单因素Kaplan-Meier分析结果 对各项临床病理参数进行单因素生存分析结果显示,CEA升高患者的OS为76.85个月,而CEA正常患者的OS为110.83个月(P=0.000,表2,图1A)。CA19-9升高的患者OS为60.98个月,而CA19-9正常患者的OS为103.36个月(P=0.000,表2,图1C)。随着CRC患者年龄的增长,OS缩短;随着pT、pN、pM分期的进展,OS也缩短(P=0.000,表2)。临床分期为Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期的OS分别为121.14、106.89、85.07、45.78个月,分化程度越差,OS越短(P=0.005),且肿瘤浸润浆膜、脉管、神经的OS比无浆膜、脉管、神经浸润的OS缩短(P<0.05,表2)。
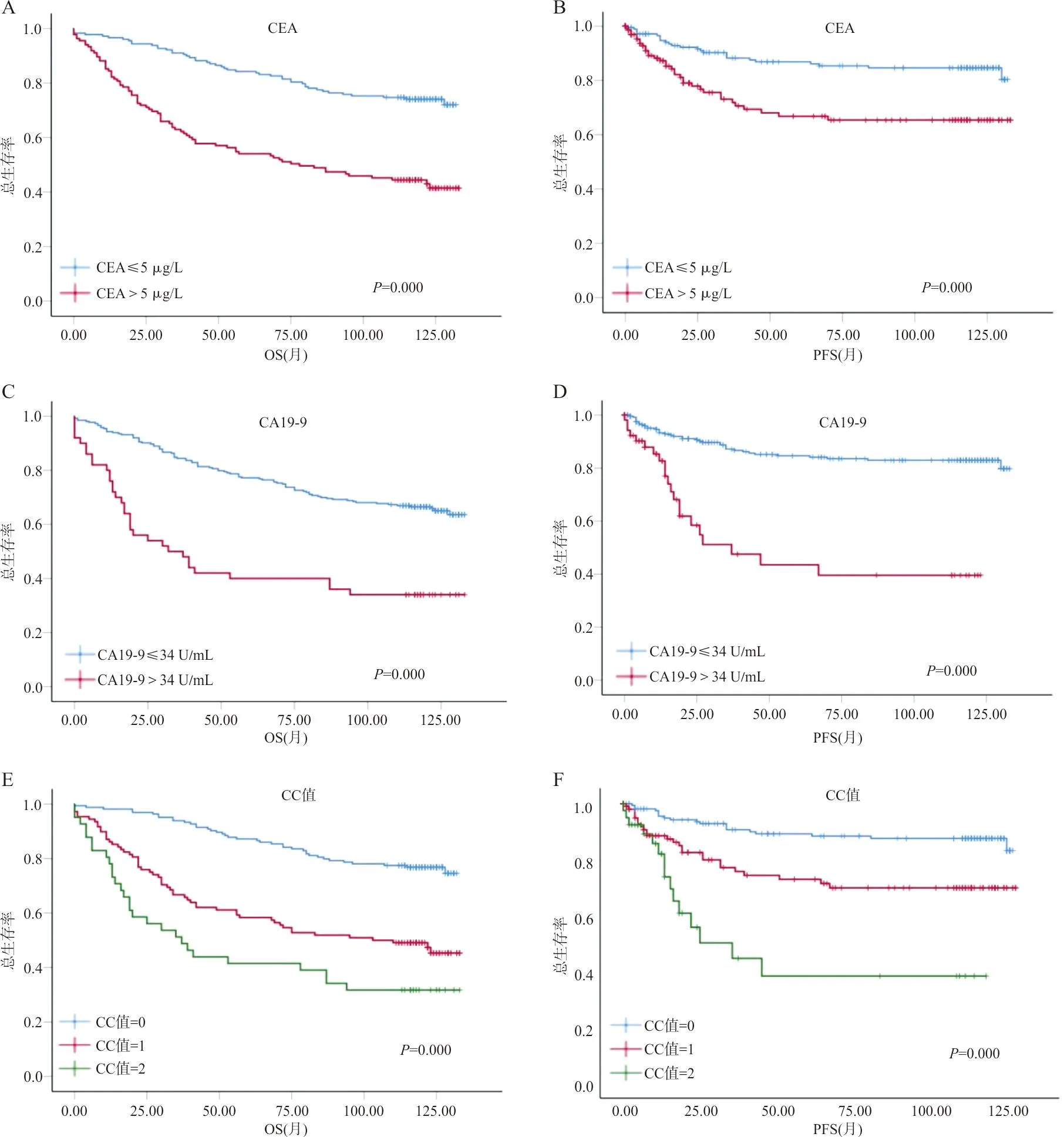
注:A,B,CEA对患者OS及PFS的预测价值;C,D,CA19-9对患者OS及PFS的预测价值;E,F,CC值对患者OS及PFS的预测价值。图1 术前CEA、CA19-9及CC值对CRC患者OS与PFS的预测价值
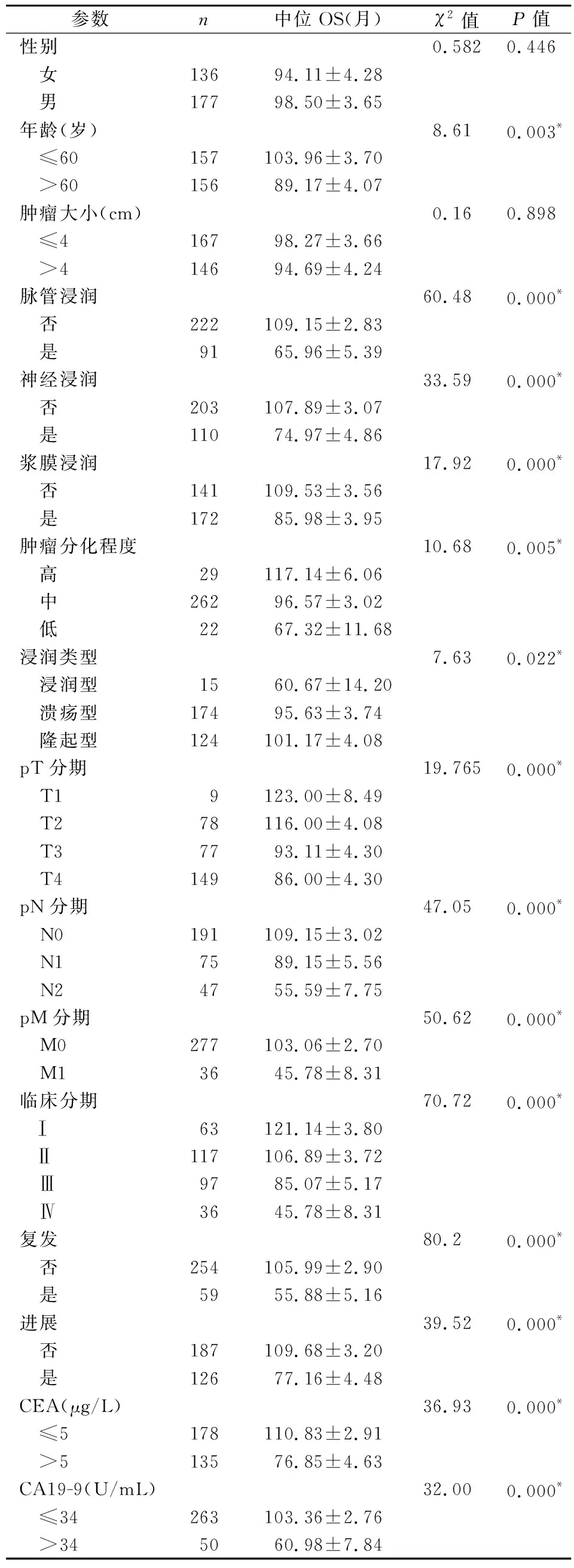
表2 313例CRC患者临床病理参数的单因素生存分析(Log-Rank检验)
2.3CRC患者的独立预后因素分析结果 进一步进行多因素生存分析显示,CRC复发、临床分期、血清CEA、CA19-9均是CRC患者的独立预后因素(表3)。

表3 CRC患者独立预后因素的COX多因素分析
2.4联合CEA与CA19-9建立模型预测CRC患者的预后 基于单因素Kaplan-Meier生存分析和Cox多因素生存分析,本研究联合了CEA和CA19-9两项不良独立预后风险因素,构建了预测CRC患者预后的模型,该模型中将CEA升高评1分,CEA正常评0分,CA19-9升高评1分,CA19-9正常评0分,并设立CEA+C19-9评分值(CC值),公式:CC值=CEA评分+CA19-9评分。根据该模型公式将患者分为3种亚类,亚类Ⅰ:CEA、CA19-9均正常,患者无其中任何一种风险因素,CC值=0;亚类Ⅱ:CEA或CA19-9升高,患者存在其中一种风险因素,CC值=1;亚类Ⅲ:CEA和CA19-9均升高,患者存在其中2种风险因素,CC值=2。运用该模型对CRC患者进行分层,验证这种模型对CRC患者预后的分层效能,经Kaplan-Meier生存分析显示,CC值=2的患者OS仅为61.11个月,CC值=1的患者OS为99.17个月,CC=0的患者OS为119.01个月(P=0.000,图1E),CC值越高,OS越短。无进展生存期(PFS)与OS呈相同趋势,CC值评分越高,PFS越短(P=0.000,图1F)。
3 讨论
CEA是多糖蛋白复合物,CA19-9由唾液糖蛋白和唾液酸糖酯组成,主要存在于肠黏膜上的细胞膜中,当细胞癌变时,导致细胞内一些转化酶的失活或激活,引起细胞膜表面各种糖蛋白的变化,使CEA、CA19-9从各种组织中释放入血液,最后改变血液中CEA、CA19-9浓度[6]。基于这种机制,CEA、CA19-9已经被广泛应用于肿瘤的早期诊断。但有报道显示CEA的特异性较低[7],而CA19-9主要在胰腺癌和消化道肿瘤中呈高表达。为了更准确反映CEA、CA19-9与CRC的关系,本研究中的病例选择均排除可以影响CEA、CA19-9表达的因素,最后发现在本次实验中仅有43.13%的CRC患者存在CEA升高,而CA19-9升高的比例更低,只有15.97%,与之前的研究结果相符。本研究还发现CEA、CA19-9水平与多项临床病理参数相关,术后3个月内CEA、CA19-9异常率明显降低。
本研究进一步发现,CEA或CA19-9升高的CRC患者比正常患者OS缩短,同时发现CEA或CA19-9升高患者PFS也短于CEA或CA19-9正常患者,进一步证实在CRC中,CEA、CA19-9升高可能提示肿瘤的进展或复发,预示着较差的预后。基于此,本研究联合CEA、CA19-9风险因素,提出一种预测CRC患者预后的模型公式,并设立CC值,验证这种模型对CRC患者预后分层的能效,结果发现CC值越高,患者无论是OS还是PFS均越低。在以往的研究中发现,CEA和CA19-9升高是CRC的独立风险因素[8],并在CRC患者化疗中,CEA、CA19-9升高提示更差的预后[9];有学者发现,CEA可以通过诱导单核细胞释放抑制分子[10],并且阻止或干扰早期黏附的过程,干扰NK细胞对肿瘤细胞的裂解,减少肿瘤核心区CD8+T细胞,形成免疫逃逸的作用[11-12];CEA还可以与细胞间或细胞外基质蛋白结合,发挥黏附功能[13],最终促进了CRC的肝转移[14]。另有学者在CA19-9的研究中发现,在恶性程度较高的癌细胞中,由于缺氧等因素导致CA19-9的表达增加,而CA19-9可以作为血管细胞黏附因子——E-选择素的配体,与细胞黏附因子结合,介导循环肿瘤细胞与血管内皮的黏附,促进肿瘤血管的生成,进而促进肿瘤的转移[15]。上述研究均与本研究结果相符,证实CEA、CA19-9在癌症中发挥促癌因子的作用,且能够在癌症中发挥协同作用,共同促进癌症的进展和不良的预后,但它们的相互作用机制仍需进一步研究。综上所述,本研究联合CRC患者术前CEA、CA19-9独立风险因素构建的预测模型可以有效地预测CRC患者预后,且CC值越高提示预后更差。

