北京某医院感染性腹泻患者致泻性大肠埃希菌毒力和耐药特征分析*
马思宇,马立艳,罗虎,周妍妍,王雅轩,苏建荣(. 首都医科大学附属北京友谊医院临床检验中心,北京 00050;2. 北京医院国家老年医学中心,北京 00730;3. 国家卫生健康委临床检验中心,北京 00730;4. 中国医学科学院老年医学研究院,北京 00730)
感染性腹泻是全球性的公共卫生问题,特别在发展中国家,是引起5岁以下儿童发病和死亡的主要原因,而大肠埃希菌是最重要的腹泻病因之一[1]。大肠埃希菌是肠道正常菌群,但一些菌株通过基因水平转移获得毒力因子[2],可经过污染食物引起腹泻,统称为致泻性大肠埃希菌(DiarrheagenicEscherichiacoli, DEC)。根据DEC的定植部位、致病机制及临床症状等的不同,主要分为以下5种:肠致病性大肠埃希菌(EnteropathogenicEscherichiacoli, EPEC),可黏附于宿主肠黏膜上皮细胞并引起擦拭性损伤,不产生志贺毒素,是婴幼儿腹泻的主要病原菌,有高度传染性,严重者可致死。肠出血性大肠埃希菌(EnterohemorrhagicE.coli/Shiga toxin-producing,EHEC/STEC),分泌志贺毒素引起宿主肠黏膜上皮细胞损伤。肠聚集性大肠埃希菌(EnteroaggregativeE.coli,EAEC),其不侵入肠道上皮细胞,但可引起肠液潴留,对人喉表皮样癌细胞Hep-2细胞形成聚集性黏附是其唯一特征。产肠毒素大肠埃希菌(EnterotoxigenicE.coli,ETEC),分泌热稳定性肠毒素或/和热不稳定性肠毒素,引起婴幼儿和旅游者腹泻。侵袭性大肠埃希菌(EnteroinvasiveE.coli,EIEC),侵入肠道上皮细胞引起痢疾样腹泻,侵入上皮细胞的关键基因是侵袭性质粒携带的抗原编码基因及其调控基因,如ipaH基因、ipaR基因(又称为invE基因)[3]。本研究旨在收集北京友谊医院感染性腹泻患者的粪便标本,进行分离培养、鉴定、药敏和测序,了解本院DEC型别、毒力和耐药特征,以期为DEC的监测和临床抗生素的选择提供参考依据。
1 材料与方法
1.1研究对象 收集2021年7月至2022年6月北京友谊医院感染疾病科和儿科就诊的感染性腹泻患者中未服用抗菌药物的患者粪便标本269份,其中腹泻病例定义为24 h内大便次数≥3次,且大便性状有改变(呈稀便、水样便,黏液便、脓血便等)的病例[4]。本研究经首都医科大学附属北京友谊医院医学伦理委员会审核批准(批准文号:2019-P2-273-01),所有研究对象均知情同意。
1.2试剂和仪器 哥伦比亚血琼脂培养基、麦康凯琼脂培养基(赛默飞世尔生物化学制品有限公司),革兰氏染色液(珠海贝索生物技术有限公司),氧化酶试验试剂(重庆庞通医疗器械有限公司),MH琼脂粉(英国Oxoid公司),革兰阴性细菌药敏卡片(法国生物梅里埃股份有限公司),E-test药敏条(郑州安图生物工程股份有限公司),5种致泻性大肠埃希菌核酸多重实时荧光 PCR 检测试剂盒(北京卓诚惠生生物科技股份有限公司),细菌基因组DNA提取试剂盒(北京天根生化科技有限公司)。VITEK MS 微生物质谱检测系统和VITEK 2 compact 全自动微生物生化鉴定系统(法国生物梅里埃股份有限公司),SLAN96-P实时荧光定量PCR仪(上海宏石医疗科技有限公司),Illumina NovaSeq 6000-PE150 平台(美国Illumina公司)。
1.3方法
1.3.1大肠埃希菌分离培养及MALDI-TOF初步鉴定 将新鲜粪便接种于麦康凯平板,35 ℃培养18~24 h。将可疑菌落接种于血平板,生长菌株行革兰染色和氧化酶试验后,应用VITEK MS质谱进行初步鉴定。以大肠埃希菌ATCC 8739为质谱校准菌株。
1.3.2多重实时荧光PCR进行基因分型鉴定 应用细菌基因组提取试剂盒对鉴定为大肠埃希菌的菌株进行基因组DNA提取,DNA模板置于-20 ℃冻存备用。采用多重实时荧光PCR试剂盒检测特征性毒力基因(eae、stx1/stx2、bfpB、ipaH、estIa/estIb、elt、astA、pic、aggR和uidA),并进行DEC分型鉴定。PCR循环参数:预变性95 ℃ 5 min; 95 ℃变性15 s, 60 ℃复性60 s,40个循环;在60 ℃时采集荧光信号。DEC阳性质控菌株为EPEC CMCC 44155、ETEC CMCC 44815、EIEC CMCC 44825以及经测序验证的EHEC、EAEC菌株,以大肠埃希菌ATCC 25922作为阴性对照,灭菌去离子水作为空白对照。根据毒力基因的检出情况,对照表1进行DEC基因分型鉴定[5]。

表1 5种DEC型别判读
1.3.3药敏试验 采用VITEK 2 Compact 配套的革兰阴性细菌药敏卡和E-test条对DEC进行药敏试验。根据美国临床和实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)2022版[6]推荐,选用9类16种抗生素,包括氨苄西林(AMP)、阿莫西林/克拉维酸(AMC)、哌拉西林/他唑巴坦(TZP)、头孢唑林(KZ)、头孢呋辛(CXM)、头孢西丁(FOX)、头孢曲松(CRO)、头孢吡肟(FEP)、头孢他啶(CAZ)、厄他培南(ETP)、亚胺培南(IPM)、庆大霉素(CN)、阿米卡星(AK)、左氧氟沙星(LEV)、四环素(TET)、氯霉素(CHL)、甲氨苄啶/磺胺异恶唑(SXT)。药敏结果判读标准参照CLSI 2022版标准。质控菌株为大肠埃希菌ATCC 25922。
1.3.4全基因组测序与生信分析
1.3.4.1全基因组测序 由安诺优达基因科技(北京)有限公司在Illumina NovaSeq 6000-PE150平台上进行二代测序,每个细菌样本得到约100 bp或125 bp的配对端片段。过滤掉低质量的序列片段后,对序列片段进行拼接,组装成包含细菌全基因组信息的contig[7]。
1.3.4.2生信分析 通过 ResFinder 3.1(https://cge.cbs.dtu.dk/services/ResFinder/)对菌株携带的相关耐药基因进行分析。用 SeqMan 软件对等位基因序列进行拼接和校正,用 MEGA 6.0软件对拼接校正后的序列进行剪切,去掉首位不用的序列。将剪切校正后的序列在E.coliMLST数据库中进行比对,确定菌株的ST序列型[8]。
1.4统计学分析 采用SPSS 20.0软件对数据进行统计分析,本研究中DEC检出株数小于40,故而其抗生素耐药率的比较采用Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1DEC的毒力基因和5种型别检测情况 269份腹泻患者粪便标本共检出DEC 32株,检出率为11.9%。其中EAEC 12株(37.5%),非典型EPEC 11株(34.38%),ETEC 8株(25.0%),EIEC 1株(3.12%),未检出EHEC菌株。具体各型别的构成和毒力基因检出情况见表2。

表2 32株DEC的毒力基因和5种型别的检测结果
2.2药敏试验结果 在32株DEC中,检出1株耐碳青霉烯类(Carbapenem-resistantEnterobacteriaceae,CRE)的EAEC。32株DEC对16种抗生素呈不同程度的耐药,总体耐药率为3.12~53.12%。其中,DEC对氨苄西林、四环素、甲氨苄啶/磺胺异恶唑耐药较为严重,耐药率分别为53.12%(17/32)、43.75%(14/32)和37.5%(12/32);其次为头孢唑林28.12%(9/32),庆大霉素15.62%(5/32);其他抗生素耐药情况相对较低,阿莫西林/克拉维酸、头孢西丁9.37%(3/32),氯霉素6.25%(2/32),哌拉西林/他唑巴坦、头孢他啶、厄他培南、亚胺培南、阿米卡星、左氧氟沙星3.12%(1/32)。32株DEC中有5株菌对16种抗生素均未产生耐药性,占比15.63%。EAEC的多重耐药菌株率达50%。EAEC、EPEC和ETEC 3种型别对左氧氟沙星的耐药率比较差异无统计学意义(F=1.70,P=1.00)。3种型别DEC菌株对16种抗生素的耐药率及多耐药菌株检出率情况见图1。 32株DEC中检出6株ESBLs(+)菌株,占比18.75%,ESBLs(+)菌株的多重耐药菌株的检出率显著高于 ESBLs(-)株,差异具有统计学意义(P=0.042)。2种不同酶型DEC菌株对16种抗生素的耐药率及多耐药菌株检出率情况见图2。
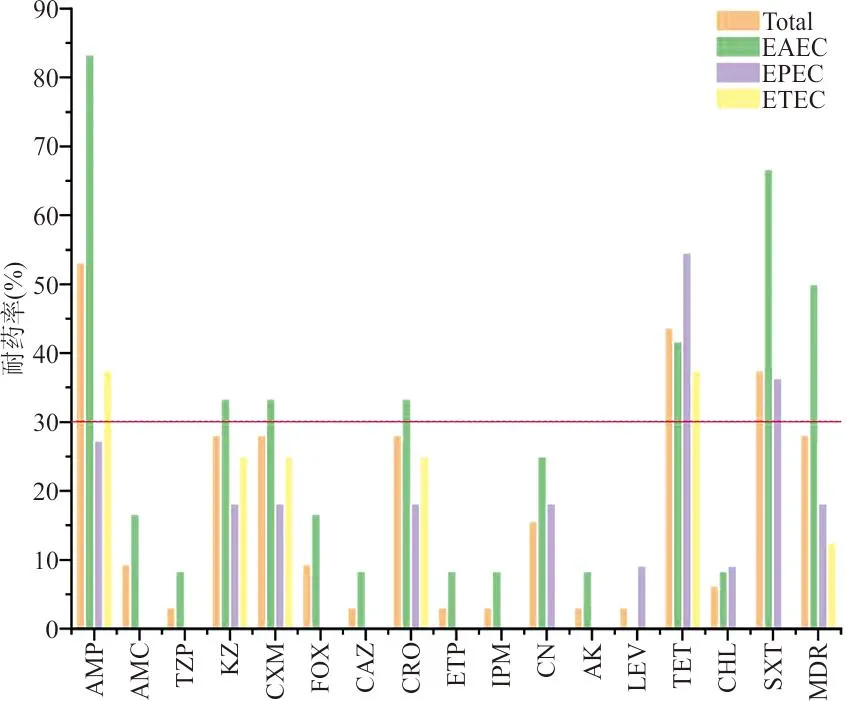
图1 3种不同型别DEC对16种抗生素的耐药率及多耐药菌株检出率情况
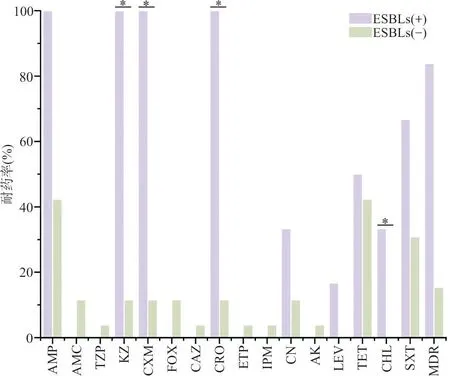
注:*,不同酶型菌株对头孢唑林、头孢呋辛、头孢曲松和氯霉素 4 种抗生素的耐药率以及多重耐药菌株的检出率差异具有统计学意义。图2 2种不同酶型DEC菌株对16种抗生素的耐药率及多耐药菌株检出率情况
2.3CRE耐药基因特征 32株DEC中有1株CRE,应用ResFinder 3.1检测到该株菌的耐药基因分别为AmpC酶基因blaCMY-6,碳青霉烯酶基因blaNDM-1, 氨基糖苷类耐药基因Δant(3″)-Ih-aac(6′)-IId和aadA1,16S rRNA甲基化基因rmtC, 叶酸途径抑制剂类耐药基因sul1,所对应的耐药表型对5类抗生素耐药。结果见表3。

表3 1株CRE致泻性大肠埃希菌的全基因组测序结果
2.4DEC的MLST分型 32株DEC共获得25个ST型。其中12株EAEC分为7个型别,另有1株未分型,最常见的基因型为ST10(33.3%)和ST31(16.7%);11株EPEC分为10个ST型,优势基因型为ST28(18.2%);8株ETEC分为7个ST型,优势基因型是ST3153(25%);1株EIEC的型别为ST99。ST10共有4株(12.5%),ST28、ST31和ST3153各有2株(各占比6.25%),其他21个型别各有1株菌(各占比3.13%)。结果见图3。

图3 32株DEC的MLST结果
3 讨论
DEC是感染性腹泻的主要病原菌之一,本研究中我院DEC的检出率为11.9%,低于北京同仁医院2019年的检出率 (20.31%),原因可能与研究对象的饮食习惯不同相关,如喜冷食、生食更容易引起DEC相关腹泻。在本研究中,毒力基因检测结果显示EAEC、EPEC为主要型别,与全国流行的优势型别相符[9]。多株DEC同时携带多种毒力基因,其中EAEC的毒力基因检出率最高,全基因组测序和生信分析提示EAEC可通过整合获得毒力基因,与全球范围内的腹泻病爆发流行有关[10],需加强监测与防控。EPEC分为典型EPEC和非典型EPEC,是引起婴幼儿腹泻的主要原因。本研究中11株EPEC均携带eae基因,未检测到bfp基因,为非典型EPEC,未检出典型EPEC,与国内外非典型EPEC比典型EPEC更为流行的趋势一致[11]。ETEC主要通过污染食物和水源引起婴幼儿腹泻和成人旅行者腹泻,本研究中ETEC非DEC主要型别,可能与腹泻患者的生存环境条件、卫生状况以及不同检测时期的居民的健康意识、防护意识等有着密不可分的关系。
此外,32株DEC分为25个ST型,显示基因型的高度多态性,EAEC和EPEC的优势型别为ST10和ST28,与其他研究结果一致[12]。不同的是,本研究中ETEC的基因型比较分散,提示不同地区ETEC基因型存在较大差异[12]。MLST分型可以帮助研究人员及时掌握本地区DEC的分子分型情况,后续可以进一步分析菌株之间的遗传和进化关系,并据此对本地区DEC的毒力和耐药传播机制展开深入研究。
本研究中,DEC对氨苄西林、四环素和甲氨苄啶/磺胺异恶唑耐药率超过经验用药预警线,不建议作为经验用药。头孢他啶、厄他培南和亚胺培南对DEC仍保持良好的抗菌活性,此结果与我国多地区的DEC耐药结果相似[13-14],可以作为经验用药的备选药物。全基因组测序分析结果显示ESBLs(+)菌株的质粒携带多种耐药基因,可对β-内酰胺类、氨基糖苷类、喹诺酮类等抗菌药物多重耐药。本研究中,1株EAEC菌株同时携带blaNDM-1、blaCMY-6、Δant(3″)-Ih-aac(6′)-IId、aadA1、rmtC、sul1等多个耐药基因,位于IncFII质粒上,该质粒可在不同菌株、不同菌种之间传递,造成耐药性广泛传播,给临床治疗和感染控制带来困难。

