诊断超声激励微泡空化增强胰腺癌血流灌注的临床研究
邓晴玥 董小小 韩 峰 林庆光 云 苗 李安华 刘 政
胰腺癌是一种恶性程度高、预后极差的消化系统肿瘤,患者5 年生存率不足8%[1]。目前,化疗是无法进行手术切除的局部晚期或合并远处转移的胰腺癌患者的主要治疗手段,然而胰腺癌的化疗面临着化疗抵抗的挑战,也是影响胰腺癌化疗效果的主要因素[2-3]。近年来,大量研究[4-7]表明胰腺癌乏氧、乏血供的微环境是造成其化疗抵抗的重要因素。因此如何改善胰腺癌乏氧、乏血供的肿瘤微环境成为临床亟待解决的问题。本课题组前期实验[8-9]采用诊断超声激励微泡空化治疗动物肿瘤,研究发现低强度、低声压超声激励微泡空化可明显增加肿瘤内部血流灌注,不仅提高肿瘤局部的化疗释药,而且可能改善肿瘤乏血供微环境,为逆转胰腺癌化疗抵抗提供了新思路。基于此,本研究对临床胰腺癌患者实施了低强度超声治疗,探讨诊断超声激励微泡空化对胰腺癌血流灌注的影响。
资料与方法
一、研究对象
选取2018 年7 月至2021 年3 月在中山大学肿瘤防治中心经病理组织学或细胞学证实的胰腺癌患者21 例。纳入标准:①经病理组织学或细胞学证实为无法手术切除的胰腺癌局部晚期(Ⅲ期)伴或不伴远处转移(Ⅳ期)患者,转移灶数量不限;②肿瘤学评估(超声、CT 或MRI)有可测量和可评价的肿瘤病灶;③预计生存期3 个月以上;④体力状况(PS)评分0~1 分。本研究经中山大学肿瘤防治中心伦理委员会批准(C2018-004-01),所有患者均签署知情同意书。
二、仪器与方法
1.仪器及试剂:使用飞依诺Vinno 70 彩色多普勒超声诊断仪,S1-8C 凸阵探头,频率4.5 MHz;配备Vflash 模块,即微泡空化调控组件,在二次谐波造影成像模式下对电子相控阵电路调节,从而可对声波频率、脉冲重复频率、脉冲宽度及脉冲时间等参数进行人为设定,同时配备自适应可变焦域技术,可将超声能量相对聚焦于设置的感兴趣区内。超声造影及空化治疗过程中使用的造影剂均为SonoVue®(意大利博莱科公司),微泡平均粒径约2~4 μm,浓度约1×108/ml。
2.诊断超声激励微泡空化治疗程序
(1)治疗时机:于每次临床静脉滴注化疗药物(白蛋白紫杉醇联合吉西他滨方案、FOLFIRINOX 方案、白蛋白紫杉醇联合替吉奥方案)结束后120 min 内开始治疗。
(2)诊断超声治疗参数:频率1.7 MHz,脉冲重复频率2000 Hz,脉冲长度8.5 cycles,脉冲治疗时间2 s,间隔时间1 s,空化治疗时间30 min。通过声功率调节将机械指数控制在0.25~0.35。
(3)治疗程序:治疗前首先对患者行常规超声检查,胰腺肿瘤声窗较差时可以通过适量饮水改善。确定目标肿瘤后,将其置于影像中央,测量肿瘤大小并观察血供情况;然后行超声造影检查:经肘静脉团注配制好的造影剂混悬液2.5 ml,尾随5.0 ml 生理盐水冲管,固定造影切面后采集肿瘤超声造影动态影像60 s,再动态观察60 s。造影结束后利用造影残余微泡介导超声治疗5 min,随后继续行超声辐照25 min,每5 min 缓慢推注4.0 ml 稀释后的微泡(1.0 ml 造影剂微泡经生理盐水稀释为4.0 ml)。治疗过程中操作者轻微旋转探头,使整个肿瘤均位于感兴趣区。空化治疗结束后,再次行超声造影检查,步骤及方法同前,造影切面及参数与治疗前一致(图1)。超声治疗次数与患者临床化疗周期数相同。
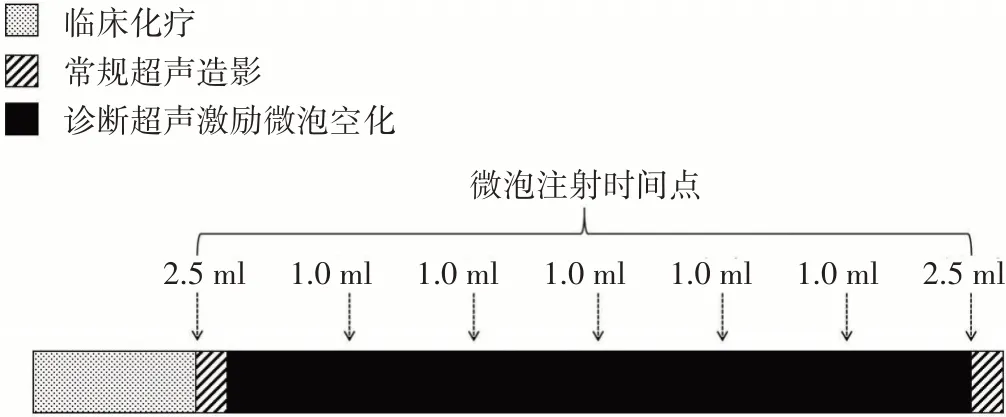
图1 诊断超声激励微泡空化治疗流程图
(4)分析指标:使用仪器自带的动态造影分析软件进行图像分析,以整个肿瘤为感兴趣区,根据超声造影时间-强度曲线获取峰值强度(PI)及曲线下面积(AUC)。
3.临床化疗方案:①白蛋白紫杉醇联合吉西他滨方案,具体为:于第1 天和第8 天静脉注射吉西他滨(1000 mg/m²)和白蛋白紫杉醇(120 mg/m²),21 d 为1 个周期;②白蛋白紫杉醇联合替吉奥方案,具体为:于第1 天静脉注射白蛋白紫杉醇(120 mg/m²),第1~7 天口服替吉奥(60 mg)每日2 次,14 d 为1 个周期;③FOLFIRINOX 方案(甲酰四氢叶酸、氟尿嘧啶、伊立替康、奥沙利铂),具体为:奥沙利铂(85 mg/m²)静脉注射2 h,甲酰四氢叶酸(400 mg/m²)静脉注射2 h,30 min 后通过Y 型连接器加用伊立替康(180 mg/m²)静脉注射90 min,随后静脉推注氟尿嘧啶(400 mg/m²),之后以2400 mg/m²持续输注46 h,每2周1次。
三、统计学处理
应用SPSS 26.0 统计软件,计量资料以x±s表示,两组比较采用配对t检验。P<0.05 为差异有统计学意义。
结果
本研究共纳入21 例胰腺癌患者,共计进行84 次临床化疗联合诊断超声激励微泡空化治疗,均无造影剂过敏、胰腺炎等不良反应发生。
一、患者基本情况
21 例胰腺癌患者年龄平均(58.48±2.04)岁,其中男10 例(47.62%),女11 例(52.38%),体质量指数中位数20.29(18.35,22.40)kg/m²,肿瘤最大径平均(43.38±2.34)mm;其中肿瘤Ⅲ期9 例(42.86%),Ⅳ期12 例(57.14%);白蛋白紫杉醇联合吉西他滨或联合替吉奥方案化疗13 例(61.90%),FOLFIRINOX 方案化疗8 例(38.10%);患者治疗周期平均(4.00±0.30)次,随访时间中位数6.10(3.35,7.70)个月,截至2022 年9 月生存4例(19.05%),死亡17例(80.95%)。
二、治疗前后超声造影时间-强度曲线定量分析结果
治疗后胰腺癌病灶PI、AUC分别为(110.62±2.70)dB、(4863.67±159.77)dB·s,均较治疗前[(109.19±2.64)dB、(4752.76±149.53)dB·s]增加,但差异均无统计学意义(P=0.16、0.33)。见图2,3。

图2 诊断超声激励微泡空化治疗胰腺癌病灶(箭头示)前后超声造影图
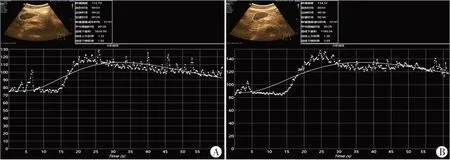
图3 诊断超声激励微泡空化治疗胰腺癌前后超声造影时间-强度曲线图
讨论
胰腺癌是目前公认恶性程度最高的肿瘤。胰腺癌肿瘤中结缔组织增生活跃,造成过度纤维化而形成致密的基质环境,间质液压高,严重影响了化疗药物渗透[10],同时缺血、缺氧的微环境不仅为肿瘤的生长和侵袭创造了条件,也会影响药物进入肿瘤,继而共同对化疗及其他抗肿瘤药物产生治疗抵抗[11-12]。本课题组前期实验[13]采用诊断超声联合微泡增强SD 大鼠Walker-256 肿瘤的血流灌注,结果显示超声空化治疗组肿瘤血流灌注面积增加30.6%,且持续时间长达4 h以上;该实验还发现微泡空化产生的血流灌注增强可能由于微泡空化造成血管内皮损伤诱导的无菌性炎症反应,产生的血管活性前列腺素可造成肿瘤血管扩张和血流加速,产生的炎症介质C5a、LTC4 可增加血管的通透性,进而引起血管扩张。本研究在上述实验研究的基础上,首次采用诊断超声激励微泡空化技术对临床胰腺癌患者肿瘤局部进行辐照,并采用超声造影定量评估其对肿瘤血流灌注的增强效应。
超声造影定量指标中,PI 反映了造影剂到达感兴趣区的最大剂量,与感兴趣区的平均血容量成正比;AUC 反映了一定时间内感兴趣区对造影剂吸收的相对剂量[14-16]。本研究结果显示,诊断超声激励微泡空化治疗后PI 和AUC 均较治疗前有所增加,但差异均无统计学意义,提示诊断超声激励微泡空化治疗晚期胰腺癌患者后,肿瘤的血流灌注量有增加趋势,但这种增加趋势尚未显示出统计学差异。分析原因可能为:①诊断超声激励微泡空化增强实体肿瘤血流灌注是近期研究发现的现象,本课题组前期实验[17]采用低强度超声激励微泡空化联合PD-L1 治疗小鼠MC38 肿瘤,结果显示治疗后PI 和AUC 均较治疗前持续增加,且与对照组比较差异均有统计学意义(均P<0.05),表明诊断超声激励微泡空化可促使肿瘤血流灌注明显增强,且肿瘤血液灌注增加主要是由于血管正常化及血管舒张引起的,而非血管生成。前期动物实验[1]中的肿瘤均为同一批次细胞株移植,异质性小,声窗好且一致,而临床胰腺癌个体差异大,治疗声窗也相对较差,同时胰腺癌过度纤维化的致密微环境使肿瘤内组织间压较高[18],诊断超声激励微泡空化后血管扩张不明显。本研究临床诊断超声激励微泡空化治疗中采用了与之相同的超声治疗参数,因此超声增强效应并未达到实验研究同样的程度。上述原因均可能导致诊断超声激励微泡空化治疗前后肿瘤血流灌注比较差异无统计学意义。后续研究将进一步扩大临床样本量,并在肿瘤空化治疗过程中加入超声空化成像,对治疗过程中的空化现象进行实时监控和量化分析,以确保良好的空化条件[19-20]。②本研究纳入的研究对象均为晚期胰腺癌患者,肿瘤最大径平均(43.38±2.34)mm,中心部多有不同程度的缺血坏死。诊断超声激励微泡空化增强血流灌注的机制在于声孔效应对血管壁产生的机械性“打孔损伤”,使得肿瘤微血管通透性增加[21-22]。其治疗的靶目标是肿瘤微血管,对于肿瘤内部无微血管的坏死区,空化治疗则无法发挥其作用。此外,受仪器造影定量分析软件感兴趣区勾画限制,本研究仅以整个肿瘤区域为感兴趣区进行分析,无法剔除中心部的无增强区域,这也可能是诊断超声激励微泡空化治疗前后肿瘤血流灌注比较差异无统计学意义的另一原因。本研究对胰腺癌组织的过度纤维化情况仍采用与前期实验研究相同的诊断超声治疗参数,可能导致临床试验中肿瘤治疗强度未达到理想的程度。后续研究可适度增加机械指数,观察其对纤维化的胰腺癌组织有无更强的血流增强作用。
综上所述,诊断超声激励微泡空化可能会增加胰腺癌的血流灌注量,有望改善胰腺癌因乏氧、乏血供导致的化疗抵抗问题。上述可能的原因分析为今后临床研究设计提供了思路,通过相应的调整与完善,有望显著增加诊断超声激励微泡空化对胰腺癌的血流灌注量,从而增加肿瘤局部化疗药物浓度,并改善胰腺癌因乏氧、乏血供导致的化疗抵抗问题,从而使临床胰腺癌空化治疗效果有所提升。

