基于CNA35靶向液态氟碳纳米粒的超声分子成像检测糖尿病肾病大鼠肾脏纤维化的实验研究
冯钰瑾 杨晓云 赵 昆 刘 芬 宗美男 王 一
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的晚期微血管并发症之一,透析治疗的DN患者5 年生存率仅约50%,早期检出率低、干预不及时是导致DN 患者高死亡率的主要原因之一[1]。肾脏纤维化是DN 的主要病理表现,也是识别早期DN的关键[1-2]。肾穿刺活检是目前临床诊断DN 的金标准,但其为有创操作,可能引起腰痛、血尿、肾周血肿等并发症。超声分子成像是在超声造影和分子标记基础上发展起来的一种新兴检查手段,其原理是将特定的分子探针结合在液态氟碳纳米粒(fluorocarbon nanoparticles,PFP-NPs)上,从而获得靶向特定抗原或抗体的能力,然后将其通过静脉注入体内,分子探针会靶向结合其配体,继而使PFPNPs 在分子探针高表达区域累积,PFP-NPs 在低强度聚焦超声的诱导下转化为微米级微泡,再通过超声进行检测[3-4],其具有靶向性好、能实时显示病变结构等优势,为组织定性和定量检测提供了一种无创、实时的新型成像技术,具有极好的临床应用前景。超声分子成像的关键在于分子探针的选择。近期研究[5-6]发现了一种可与Ⅰ型胶原特异性结合的新型分子探针——胶原结合蛋白35(CNA35),可用于Ⅰ型胶原的标记。本实验通过探讨CNA35 靶向PFP-NPs 在超声分子成像检测DN 大鼠肾脏纤维化中的应用价值,旨在为临床DN 诊断提供理论依据。
材料与方法
一、主要实验材料及仪器
1.主要材料:二棕榈酰磷脂酰胆碱(DPPC)、二硬脂酰磷脂酰甘油钠盐(DSPG)、二硬脂酰基磷脂酰乙醇胺(DSPE)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-氨基(DSPE-PEG2000-NH2)、3-二甲氨基丙基-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基丁二酰亚胺(NHS)、胆固醇(CH)均购于德国Merck 公司;细胞膜红色荧光探针(DiI)购于美国MCE 公司;全氟正戊烷(PFP)、2-吗啉乙磺酸(2-MES)、PBST 缓冲液均购于阿拉丁控股集团有限公司;含10%胎牛血清的DMEM培养基购于赛默飞世尔科技(中国)有限公司;转化生长因子-β(TGF-β)、HRP 标记二抗、DAB 染色试剂盒均购于英国Abcam 公司;DAPI 染色液、链脲佐菌素(STZ)均购于德国Sigma公司;FITC标记的抗大鼠Ⅰ型胶原蛋白抗体购于美国Arigo公司。
2.主要仪器:旋转蒸发仪(BK-RE-1A,济南程腾生物技术有限公司);超声波处理器(FS-150N,上海生析超声仪器有限公司);倒置荧光显微镜(DMIL,德国徕卡公司);低强度聚焦超声仪(重庆医科大学超声影像学研究所);正置显微镜(Axioscope 5,德国蔡司公司);超声成像系统[东芝Aplio 500,上海电气(集团)公司]。
二、主要实验方法
(一)CNA35靶向PFP-NPs的制备及相关检测
1.CNA35 靶向PFP-NPs 的制备:分别称取10 mg DPPC、4 mg DSPG、3 mg DSPE-PEG2000-NH2或DSPE、3 mg CH 溶解于10 ml 三氯甲烷中,然后再加入100 ml DiI;使用旋转蒸发仪在50℃条件下真空旋转蒸发1 h,除去有机溶剂。加入4 ml PBS 缓冲液,在冰水浴(0~4℃)条件下,使用超声波处理器声振乳化,得到半透明的混悬液,加入液态PFP后,再次使用超声波处理器声振乳化,12 000 g 离心3 次取沉淀,将其加入2-MES 溶液(pH 值为8.0)中混匀即得带有荧光标记的非靶向PFP-NPs 混悬液。另取4 mg EDC、3 mg NHS 溶于1 ml 2-MES 溶液(pH 值为5.2)中,加入50 ml CNA35,冰浴(0℃)条件下置于摇床孵育1 h,然后调节溶液pH 值至8.0,即为CNA35 溶液。取500 ml 上述制备好的带有荧光标记的非靶向PFP-NPs 混悬液,加入CNA35溶液,4℃避光孵育过夜,即得带有荧光标记的CNA35 靶向PFP-NPs 混悬液。将上述带有荧光标记的非靶向PFP-NPs 混悬液和带有荧光标记的CNA35 靶向PFPNPs混悬液于4℃离心取沉淀,即制得带有荧光标记的非靶向PFP-NPs和CNA35靶向PFP-NPs[5]。
2.CNA35靶向PFP-NPs体外靶向性检测及体外超声分子成像观察
(1)体外靶向性检测:将人肾小管上皮HK-2 细胞加入含10%胎牛血清的DMEM 培养基,置于37℃、5%CO2培养箱中培养。当细胞贴壁生长至80%左右时,加入浓度为5 ng/ml TGF-β诱导上皮细胞间充质转化,24 h后将细胞分为非靶向组和靶向组(每组6个复孔),然后分别将非靶向PFP-NPs 和CNA35 靶向PFP-NPs(1×104个/ml)加入细胞培养液中,37℃孵育1 h,弃细胞培养液,PBS缓冲液洗涤3次,加入DAPI染色液进行细胞核染色,并于倒置荧光显微镜下观察非靶向组和靶向组细胞上PFP-NPs荧光信号(即红色区域面积)。
(2)体外超声分子成像观察:取上述1 ml CNA35靶向PFP-NPs 混悬液置入凝胶模具中,低强度聚焦超声仪体外给予超声辐照(工作频率:650 kHz,焦距:125 mm,功率:0.2 W/cm2,辐照时间:60 s),观察并比较辐照前后超声分子成像信号强度。
(二)DN大鼠模型建立
选择健康清洁级6~8 周龄SD 大鼠[北京维通利华实验动物技术有限公司,许可证号:SYXK(京)2022-0026]30 只,体质量180~220 g,单笼饲养,自由饮食,12 h 昼夜节律饲养。其中20 只采用腹腔注射大剂量STZ(65 mg/kg)的方式制备DN 大鼠模型,STZ 注射前禁食、禁水12 h。注射后连续3 d采集尾静脉血检测空腹血糖,当空腹血糖均>16.7 mmol/L,且尿白蛋白>15 μg/ml视为DN 大鼠模型构建成功[7]。本实验经我院动物伦理委员会批准(2022-AE182)。
(三)CNA35 靶向PFP-NPs 体内超声分子成像观察及体内靶向性检测
1.体内超声分子成像观察:将20 只DN 大鼠随机分为非靶向组和靶向组,每组各10只。使用戊巴比妥钠(30 mg/kg)麻醉大鼠,待完全麻醉,使用超声成像系统(LA523 探头,频率5~9 MHz)对比脉冲序列造影模式进行超声成像,非靶向组与靶向组超声成像增益、机械指数、脉冲重复频率、扫描深度、聚焦位置等参数均相同,待图像稳定后,将30 mg/ml 非靶向PFP-NPs和CNA35 靶向PFP-NPs(1×106个/ml)经大鼠尾静脉分别注入非靶向组和靶向组大鼠体内,剂量均为2 ml/kg,随即推注1 ml生理盐水冲管,注射10 min、30 min后于造影模式下观察两组大鼠肾脏,选取固定大小的感兴趣区检测超声分子成像信号强度[7]。
2.体内靶向性检测:于避光条件下处死两组中各5只DN 大鼠并取出肾脏组织,制备冰冻切片,FITC 标记的抗大鼠Ⅰ型胶原蛋白抗体37℃孵育1 h,PBST 缓冲液洗涤后,加入DAPI 染色液进行细胞核染色,并于倒置荧光显微镜下检测PFP-NPs 荧光信号强度及Ⅰ型胶原荧光信号强度。
(四)肾脏组织病理学观察及Ⅰ型胶原免疫组织化学检测
将剩余的10只DN大鼠及10只健康大鼠均处死,取肾脏组织制备石蜡切片,对肾脏组织进行Masson染色,于正置显微镜下观察肾小球、肾小管的纤维化情况(蓝色区域面积,阳性组织被染成蓝色);同时使用抗原修复液对DN 大鼠肾脏组织进行抗原修复,山羊血清37℃封闭2 h,FTTC 标记的兔抗大鼠Ⅰ型胶原蛋白抗体(1∶1000)4℃孵育12 h,PBST 缓冲液洗涤3 次,使用HRP 标记二抗37℃孵育1 h,PBST 缓冲液洗涤3次,使用DAB染色15 min,苏木素复染、封片,于正置显微镜下观察Ⅰ型胶原阳性(即棕黄色染色)情况,采用ImageJ 软件计算Ⅰ型胶原染色面积占比,分析超声分子成像信号强度与Ⅰ型胶原染色面积占比的相关性。
三、统计学处理
应用GraphPad 8.0 统计软件,计量资料以x±s 表示,两组比较采用t 检验。相关性分析采用Pearson 相关分析法。P<0.05为差异有统计学意义。
结果
一、CNA35 靶向PFP-NPs 体外靶向性检测及体外超声分子成像观察
本实验制备的非靶向PFP-NPs 和CNA35 靶向PFP-NPs 平均粒径分别为(268.03±4.73)nm、(277.06±5.62)nm。体外实验结果显示,靶向组人肾小管上皮HK-2细胞上的PFP-NPs荧光信号强度高于非靶向组(388.21±15.28 vs.25.79±3.62),差异有统计学意义(P<0.05)。见图1。CNA35靶向PFP-NPs 经体外低强度聚焦超声辐照后的超声分子成像信号显著强于辐照前。见图2。

图1 靶向组与非靶向组人肾小管上皮HK-2细胞倒置荧光显微镜下观(标尺为100 μm)
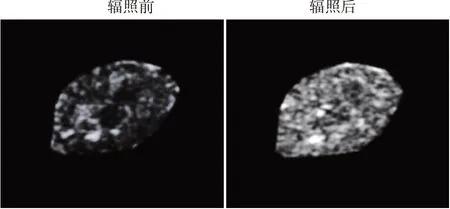
图2 CNA35靶向PFP-NPs体外低强度聚焦超声辐照前后超声分子成像
二、CNA35靶向PFP-NPs体内超声分子成像观察
靶向组DN大鼠静脉注射CNA35靶向PFP-NPs后10 min、30 min 肾脏组织超声分子成像信号强度分别为8.37±1.27、9.73±1.25,均高于非靶向组(1.92±0.25、2.08±1.32),差异均有统计学意义(均P<0.05);且注射后10 min 超声分子成像信号强度与注射后30 min 比较差异无统计学意义。见图3。
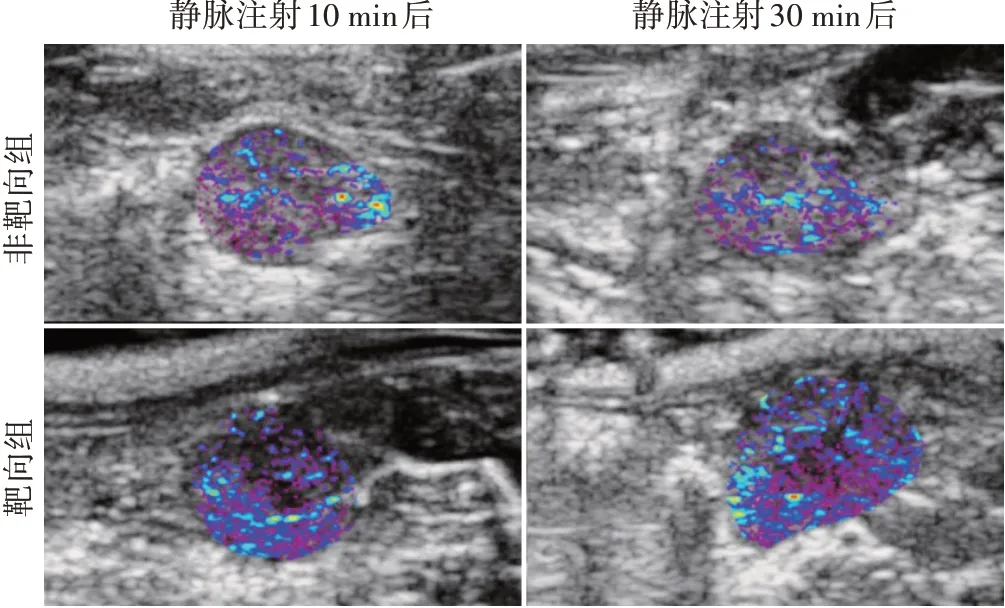
图3 靶向组与非靶向组静脉注射PFP-NPs后10 min、30 min体内超声分子成像
三、CNA35靶向PFP-NPs体内靶向性检测
肾脏组织切片荧光检测显示,靶向组DN大鼠肾脏组织PFP-NPs 荧光信号强度高于非靶向组(946.02±83.55 vs.73.69±21.72),差异有统计学意义(P<0.05);靶向组Ⅰ型胶原荧光信号强度与非靶向组比较差异无统计学意义(969.07±96.67 vs.943.39±106.18),且PFPNPs荧光信号与Ⅰ型胶原荧光信号区域重合。见图4。
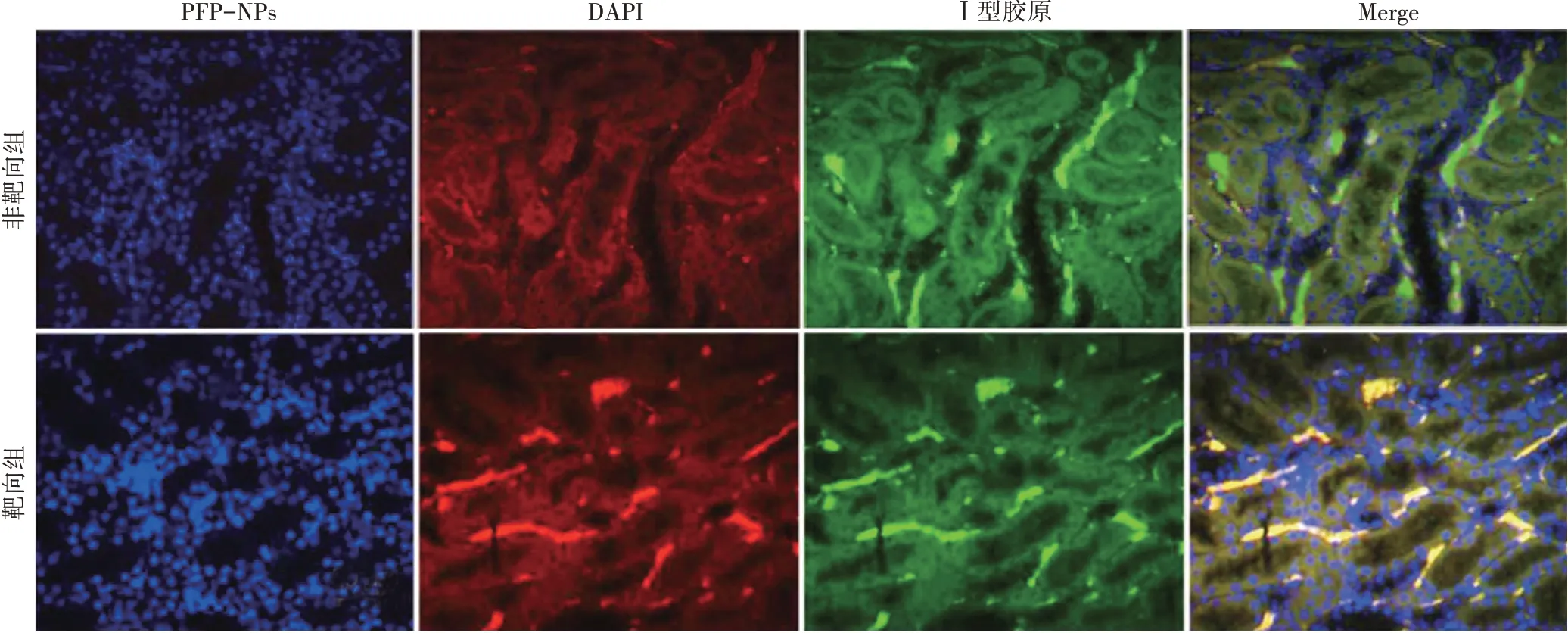
图4 靶向组DN大鼠体内靶向性检测倒置荧光显微镜下观(红色区域为PFP-NPs荧光信号;绿色区域为Ⅰ型胶原荧光信号)。标尺为50 μm
四、DN大鼠肾脏病理检测
Masson 染色显示,DN 大鼠肾脏纤维化面积大于健康大鼠肾脏(1527.69±129.66 vs. 147.81±52.36),差异有统计学意义(P<0.05)。见图5。
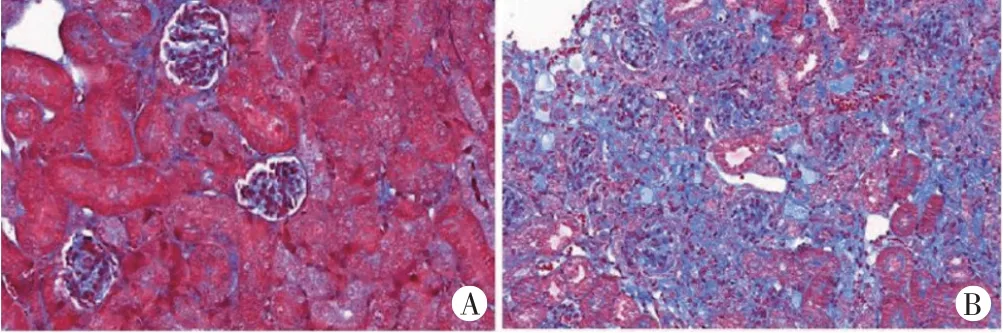
图5 健康大鼠和DN大鼠肾脏病理图(Masson染色,×200)
五、超声分子成像信号强度与Ⅰ型胶原染色面积占比的相关性分析
相关性分析显示,DN 大鼠肾脏超声分子成像信号强度与Ⅰ型胶原染色面积占比呈正相关(r=0.838,P<0.001)。见图6,7。
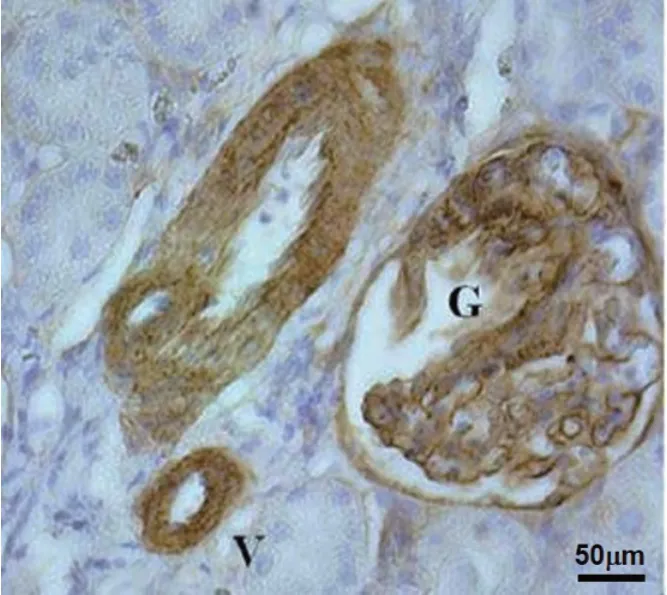
图6 DN 大鼠肾脏组织Ⅰ型胶原免疫组织化学图(G:肾小球;V:肾内血管系统)
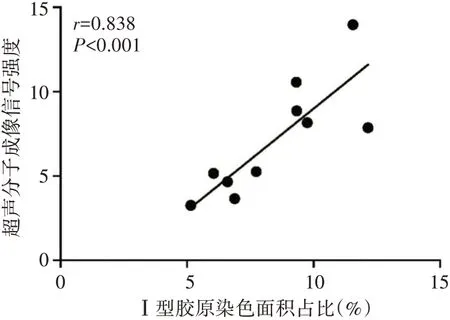
图7 DN 大鼠肾脏超声分子成像信号强度与Ⅰ型胶原染色面积占比的相关性分析散点图
讨论
纤维化是结缔组织在损伤反应中逐渐积累,形成不可修复性器官损伤,并进一步导致器官衰竭的一种病理变化。超声分子成像能够使细胞和亚细胞活动过程可视化,理论上选择合适的分子标记物可实现分子纤维化途径的监测及量化评估[8]。糖尿病患者持续高血糖状态会损伤肾脏,导致肾间质出现炎症细胞浸润,肾小管上皮细胞也会凋亡,而来源于肾小管上皮细胞-间充质转化的肌成纤维细胞将会聚集并使细胞外基质的生成与降解失衡,从而导致细胞外基质过度沉积,进而引发肾脏纤维化[9]。胶原沉积是DN患者肾脏纤维化的典型病理学特征。因此,通过合适的分子探针靶向胶原是DN 分子诊断的重要研究方向。既往实验[10]制备了一种胶原结合蛋白CNA35,其可特异性结合纤维化组织中的胶原蛋白;且体内和体外成像实验显示,CNA35 较目前可用的其他胶原蛋白可视化技术具有更高的空间分辨率。静脉注射CNA35 后,可在肾脏和肝脏观察到胶原蛋白的标记,是目前应用较为广泛的纤维化分子诊断标记物。
液态氟碳是一种全氟碳化合物,稳定性高且具有携氧功能,近年来逐渐应用于超声造影剂,并取得良好的效果。液态氟碳经由磷脂壳层包裹成纳米级的颗粒后,相变阈值与其粒径呈负相关,即粒径越小,其相变阈值越高,反之则越低[11-12]。既往实验[12]指出,PFP-NPs沸点为29℃,但被脂质包裹后,在37℃环境下1 h内粒径未见明显改变。本实验成功制备Dil标记的非靶向PFP-NPs 及CNA35 靶向PFP-NPs,平均粒径分别为(268.03±4.73)nm、(277.06±5.62)nm。TGF-β 能够诱导人肾小管上皮HK-2 细胞间质转化,导致大量胶原沉积[13],因此发生间充质转化的上皮细胞可用于体外检测CNA35 靶向PFP-NPs 的靶向性。体外实验结果显示,靶向组人肾小管上皮HK-2 细胞上PFPNPs 荧光信号强度高于非靶向组(388.21±15.28 vs.25.79±3.62,P<0.05),表明CNA35 靶向PFP-NPs 能够靶向识别胶原蛋白。为了进一步探究CNA35 靶向PFP-NPs 对DN 大鼠肾脏纤维化的诊断效果,本实验利用STZ 诱导构建DN 大鼠模型,结果显示DN 大鼠肾脏组织有大量纤维沉积,与既往实验[14]中DN 兔肾脏病理变化一致,提示成功建立了DN 大鼠模型。分别给予DN 大鼠注射CNA35 靶向PFP-NPs 和非靶向PFP-NPs,结果显示靶向组DN 大鼠肾脏组织中PFPNPs 荧光信号强度高于非靶向组(P<0.05)。进一步对上述大鼠肾脏组织进行Ⅰ型胶原免疫荧光染色发现,PFP-NPs 荧光信号与Ⅰ型胶原荧光信号区域重合,表明CNA35靶向PFP-NPs能够靶向结合DN大鼠肾脏Ⅰ型胶原纤维沉积部位。体内CNA35 靶向PFP-NPs 经超声辐照后,由液态转变为气态,超声分子成像信号较辐照前明显提高,表明其增强了超声分子成像效果[15]。本实验应用超声分子成像观察DN大鼠肾脏,结果显示靶向组DN大鼠肾脏组织注射CNA35靶向PFPNPs 后10 min、30 min 超声分子成像信号强度分别为8.37±1.27、9.73±1.25,均高于非靶向组(1.92±0.25、2.08±1.32),差异均有统计学意义(均P<0.05);且注射后10 min 超声分子成像信号强度与注射后30 min 比较差异无统计学意义;表明CNA35靶向PFP-NPs 能够靶向结合大鼠肾脏胶原高表达部位,实现了对DN 大鼠的靶向超声分子成像。在超声分子成像过程中,未与靶点结合的游离微泡会很快被消除,CNA35 靶向PFP-NPs 多在注射后10 min 即可观察到,且持续至注射后30 min,这为今后单次造影剂注射后双侧肾脏同时成像提供了可能。肾脏纤维化是DN 的基本病理表现,病理学检查是诊断DN 的“金标准”,其主要根据肾脏胶原沉积评估肾脏纤维化程度[16]。本实验相关性分析显示,DN大鼠肾脏超声分子成像信号强度与Ⅰ型胶原染色面积占比呈正相关(r=0.838,P<0.001),表明超声分子成像在DN 诊断中有一定价值。但CNA35靶向PFP-NPs 与肾脏纤维化组织中胶原靶向结合效率仍需进一步探究。
综上所述,CNA35 靶向PFP-NPs 能够靶向结合大鼠肾脏胶原高表达部位,实现了对DN大鼠肾脏纤维化的靶向超声分子成像,为临床DN诊断提供了理论依据。

