超声造影联合MRI融合导航技术在评估肝细胞肝癌消融疗效中的临床价值
张 琪 王 坤 曹佳颖 经 翔 严 昆 董 怡 王文平
近年来,微创技术包括射频消融(radiofrequency ablation,RFA)、微波消融(microwave ablation,MWA)、经皮肝动脉化疗栓塞等[1-3]在无法进行手术切除的肝癌治疗中发挥了越来越重要的作用。《原发性肝癌诊疗指南(2022 年版)》[4]提出消融范围应覆盖包括至少5 mm 的癌旁组织,即达到安全边界,以彻底杀灭肿瘤。消融术后局部肿瘤进展率较高[5],有研究[6-7]显示消融的安全边界与术后局部肿瘤进展密切相关。因此,准确评估HCC 消融的范围能够更好地提高远期疗效,预防局部复发和进展。超声造影(contrastenhanced ultrasound,CEUS)联合MRI 融合导航技术是基于影像融合和定位追踪技术发展的一项实时虚拟导航技术,结合了CEUS 实时显像和MRI 高空间分辨率的特点,为肝癌的术前定位、定性和术中引导微创治疗提供了新途径。对于部分常规超声显示困难的病灶,可在MRI 导航下结合CEUS 清晰显示[8];且CEUS 联合MRI 融合导航技术也可于术中引导以提高完全消融成功率,进一步提高肝癌局部治疗的准确性[9-10]。本研究旨在探讨CEUS 联合MRI 融合导航技术在评估肝细胞肝癌(hepatocellular carcinoma,HCC)消融疗效中的临床应用价值。
资料与方法
一、研究对象
前瞻性选取2020 年9 月至2022 年12 月在我院、天津市第三中心医院及北京大学附属肿瘤医院行消融治疗的HCC 患者77 例,包括RFA 27 例和MWA 50 例。术前将其随机分为CEUS组和CEUS联合MRI导航组,其中CEUS 组46 例(46 个病灶),男37 例,女9 例,年龄31~78 岁,平均(59.8±11.2)岁,包括RFA 14 例和MWA 32例;初发17例,复发29 例;CEUS 联合MRI 导航组31 例(31 个病灶),男28 例,女3 例,年龄37~73 岁,平均(59.5±8.8)岁,包括RFA 13例和MWA 18例;初发12 例,复发19 例。两组一般资料比较差异均无统计学意义。纳入标准:①病理学或临床诊断的HCC患者;②肝内单个病灶且最大径≤5 cm,或肝内2~3 个病灶且最大径≤3 cm,多发病灶选取最大病灶;③自愿接受消融治疗(RFA或MWA)。排除标准:超声造影剂过敏、严重的循环系统或呼吸系统疾病、微创治疗失败、凝血功能异常及术后30 d 未复查MRI 或CEUS 等。本研究经医院医学伦理委员会批准(B2019-113),所有患者均签署知情同意书。
二、仪器与方法
1.仪器及试剂:使用迈瑞Resona R9S、GE Logiq E20、GE E9、西门子Acuson Sequoia、Philips EPIQ5彩色多普勒超声诊断仪,SC6-1U 凸阵探头,频率1~6 MHz;C5-1 凸阵探头,频率1~5 MHz。超声造影剂使用SonoVue(意大利博莱科公司)。
2.检查方法:分别于消融前1 d 及消融后30 d 行CEUS 检查或CEUS 联合MRI 融合导航检查。两组均应用常规超声及CEUS 观察病灶大小、位置、回声、数量、各期增强及消退情况;CEUS 联合MRI 导航组则通过PACS系统先将病灶术前MRI的DICOM图像数据输入至GE E9 彩色多普勒超声诊断仪系统中,再选取动脉期图像进行定位标记。在屏幕上以双幅同时显示超声和MRI 图像。以超声探头确定初始平面,同时在超声和MRI 图像上选取肝内特殊结构作为参照物(一般以门静脉右支、门静脉矢状段或胆囊)进行匹配融合,然后调整图像间的细小差异,使超声与MRI 的图像基本达到一致(误差控制在3 mm内),完成超声图像与MRI 图像的实时匹配,即任意切面的超声图像与定位精确的MRI 图像同步关联且实时同屏左右显示。匹配成功后,静脉注射配制好的超声造影剂SonoVue 2.4 ml,然后团注5.0 ml 生理盐水冲管,持续观察病灶5~10 min,存储CEUS 联合MRI 实时导航的动态图像。记录病灶CEUS各时期的增强及消退情况。所有CEUS图像均由同一具有20 年工作经验的超声科医师进行评估;所有MRI图像均由同一具有15年工作经验的放射科医师进行评估。
3.消融疗效观察内容:以消融后30 d 普美显增强MRI示病灶各期均无增强为完全消融的诊断标准,其中无增强范围超过原病灶周边5 mm 为达到安全边界诊断标准[4],评估两组患者完全消融及达到安全边界情况。
三、统计学处理
应用SPSS 26.0统计软件,计量资料以x±s表示,两组比较采用t检验;计数资料以频数或率表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
结果
一、两组消融前常规超声表现比较
两组消融前常规超声表现比较见表1。

表1 两组消融前常规超声表现比较个
1.病灶大小:CEUS 组消融前病灶最大径为(18.1±7.0)mm,消融后为(31.3±8.4)mm;CEUS 联合MRI 导航组消融前病灶最大径为(20.1±9.9)mm,消融后为(28.4±7.2)mm。两组消融前病灶最大径比较差异无统计学意义;两组消融前、后病灶最大径比较差异均有统计学意义(均P<0.05)。
2.病灶位置:CEUS 组46个病灶中,35个位于肝右叶,11个位于肝左叶;CEUS联合MRI导航组31个病灶中,27 个位于肝右叶,4 个位于肝左叶;两组病灶位置比较差异无统计学意义。CEUS组中,29个病灶位于特殊位置(距离肝包膜、大血管旁、胆囊旁、膈肌<5 mm),CEUS 联合MRI 导航组中,17 个病灶位于特殊位置,两组比较差异无统计学意义。
3.病灶回声类型及边界:CEUS 组中,消融前10 个病灶常规超声表现为等回声,24个表现为低回声,12个表现为高回声;边界清晰31 个,不清晰15 个。CEUS联合MRI 导航组中,消融前8 个病灶常规超声表现为等回声,20 个表现为低回声,3 个表现为高回声;边界清晰21 个,不清晰10 个。两组回声类型及边界比较差异均无统计学意义。
二、两组消融疗效比较
CEUS 组46 个病灶中,39 个完全消融,其中32 个达到安全边界,CEUS 联合MRI 导航组31 个病灶中,27 个完全消融,且均达到安全边界,两组消融疗效比较差异无统计学意义(P=0.063)。CEUS 组中,7 个未完全消融,CEUS 准确诊断5 个;CEUS 联合MRI 导航组中,MRI 诊断3 个未完全消融,CEUS 联合MRI 融合导航技术诊断4 个未完全消融;CEUS 联合MRI 导航融合成功率为100%。见图1。
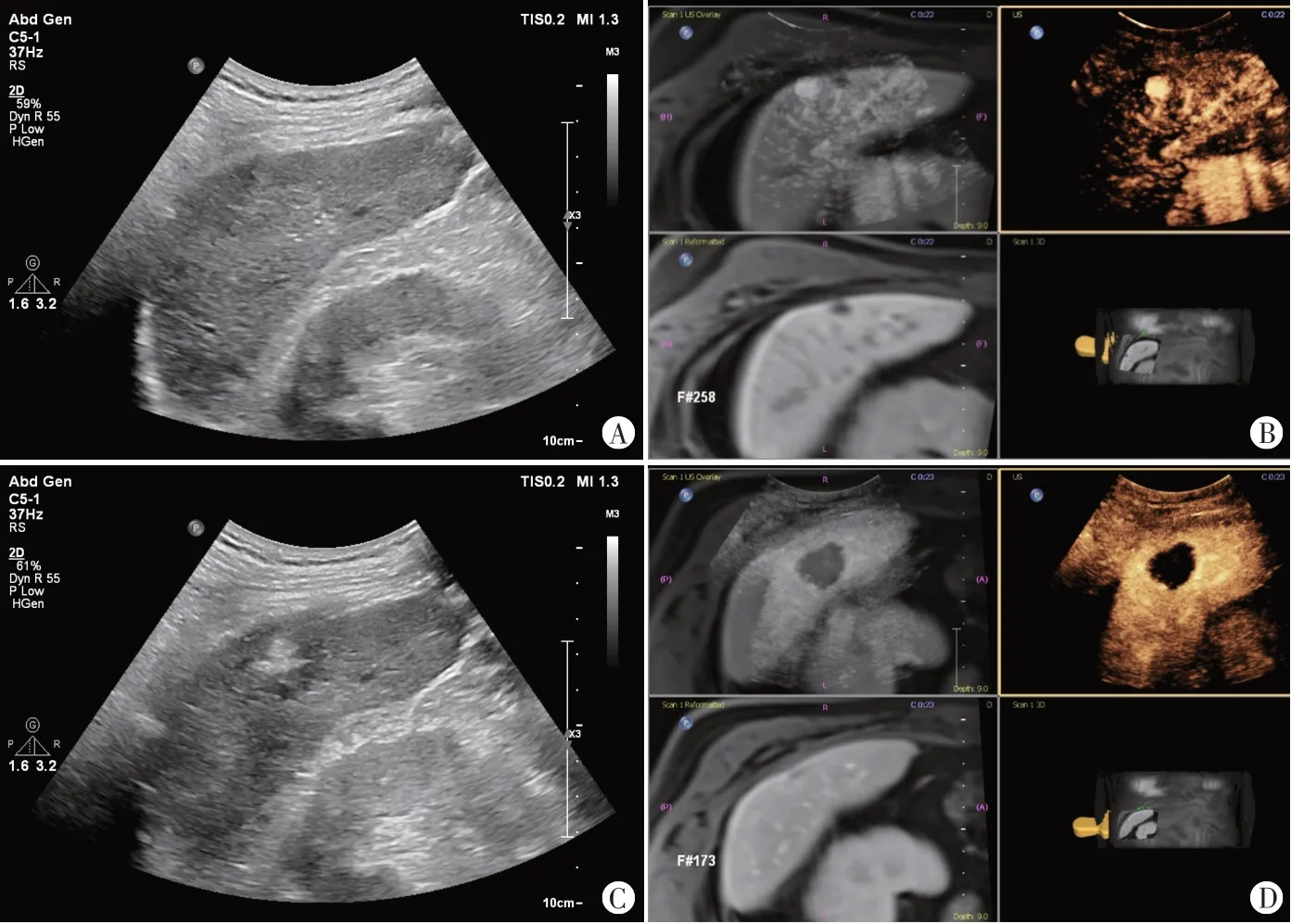
图1 CEUS联合MRI导航组一患者(男,68岁)消融前后影像学对照图
1.位于特殊位置的46 个病灶中,CEUS 组中79.3%(23/29)的病灶达到安全边界,CEUS联合MRI导航组中88.2%(15/17)的病灶达到安全边界,两组比较差异有统计学意义(P<0.001)。
2.消融前二维超声呈等回声或边界不清晰的43个病灶中,CEUS 组中80.0%(20/25)的病灶达到安全边界,CEUS 联合MRI 导航组中88.9%(16/18)的病灶达到安全边界,两组比较差异有统计学意义(P<0.001)。
讨论
近年来,消融治疗被越来越多地应用于一些不能耐受手术的肝癌患者,其具有对肝功能损伤小、创伤小、疗效确切等优点,对一些早期肝癌患者的疗效与手术切除相似。《原发性肝癌诊疗指南(2022 年版)》[4]指出,消融范围应覆盖至少5 mm 的癌旁组织,以达到安全边界,对于边界不清晰、形态不规则的病灶可以适当扩大范围。Laimer 等[6]研究显示,消融未达到5 mm安全边界,HCC 局部进展发生率可高达20%。因此,准确判断是否达到安全边界十分重要。CEUS 凭借其实时动态、高分辨率、重复性高等优点,被越来越多地用于肝癌消融后的疗效评估。研究[11]显示,消融后即刻应用CEUS 可以准确鉴别消融术后病灶周围炎症反应带及病灶残留灶,也可用于消融后的定期随访,有助于发现局部复发病灶及肝内新发病灶。Hai 等[12]研究显示,CEUS 在肝癌局部治疗后检出残留存活病灶的灵敏度、特异度分别为85.0%、94.0%,诊断准确率可达93.5%。但CEUS易受呼吸、肺部气体、病灶深度、严重肝硬化或脂肪肝等因素影响,部分病灶显示不清晰,难以辨别病灶内部增强情况。
影像融合技术包括超声-超声、CT-CT、MRI-MRI、CEUS-CECT 融合成像及CEUS 联合MRI 融合导航技术。超声-超声、CT-CT、MRI-MRI 融合成像一般是将消融术前的病灶图像勾勒出来,放置于消融术后的图像中,观察是否重叠,进而判断是否完全消融。但CT-CT和MRI-MRI 融合成像不能动态观察,且融合所需时间较长,不能重复多次应用。CEUS 联合MRI 融合导航技术可双幅显示,一侧为实时超声图像,另一侧为提前导入彩色多普勒超声诊断仪系统中的MRI 图像,既可以实时显示病灶增强情况,又可以利用MRI高空间分辨率的优点,更好地显示病灶位置。本研究采用的CEUS 联合MRI 融合导航技术可在高组织分辨率的MRI 图像引导下实时、动态、多角度地观察病灶,且重复性好,结合了两种影像学方法的优点,为常规超声难以显示的病灶提供了一种实用可行的检查方法。本研究随机采用CEUS 和CEUS 联合MRI 融合导航两种技术对HCC 消融的疗效进行评估,随机分组而非对同一病灶使用不同的检查方法观察2 次,可使操作者不受单一检查方法的影响,能更客观地比较两种检查方法评估的消融疗效。本研究结果显示,CEUS组46个病灶中,32个达到安全边界,CEUS联合MRI导航组31 个病灶中,27 个完全消融且均达到安全边界,两组消融疗效比较差异无统计学意义(P=0.063)。CEUS 组中,7 个未完全消融,CEUS 准确诊断5 个;CEUS 联合MRI 导航组中,MRI 诊断3 个未完全消融,CEUS 联合MRI 融合导航技术诊断4 个未完全消融;CEUS 联合MRI 导航融合成功率为100%。位于特殊位置的46个病灶中,CEUS组中23个(79.3%,23/29)病灶达到安全边界,CEUS 联合MRI 导航组中15 个(88.2%,15/17)病灶达到安全边界,两组比较差异有统计学意义(P<0.001);消融前二维超声呈等回声或边界不清晰的43个病灶中,CEUS组中20个(80.0%,20/25)病灶达到安全边界,CEUS 联合MRI 导航组中16 个(88.9%,16/18)病灶达到安全边界,两组比较差异有统计学意义(P<0.001)。提示CEUS 联合MRI 融合导航技术优于CEUS,与既往研究[13]结论一致。在CEUS 联合MRI 导航组中,1 个病灶MRI 诊断为完全消融,而CEUS 联合MRI 融合导航技术诊断为未完全消融,可能与病灶体积较大有关,CEUS 在评估体积较大的病灶边缘是否有残留方面更具优势。
本研究的局限性:①入组样本量小,可能存在一定的选择偏倚;②CEUS 联合MRI 导航技术与CEUS 均易受病灶位置、肺气、胃肠道气体等影响,可能导致图像质量不佳;③由于病灶位置深,或受到脂肪肝衰减的影响,CEUS 难以准确显示病灶的实际增强情况;④未进一步探讨CEUS 表现与消融后短期复发的相关性。
综上所述,CEUS 联合MRI 融合导航技术有助于判断HCC 消融的安全边界,尤其对位于特殊位置的病灶及二维超声呈等回声或边界不清晰的病灶消融疗效更佳。

