MOFs基微流控电化学芯片对多种重金属离子的实时在线检测
陈晓萍,王旭潭,刘 宁,汪庆祥,倪建聪,杨伟强,林振宇
(1.闽南师范大学化学化工与环境学院,漳州 363000;2.福建省现代分离分析科学与技术重点实验室,污染监测与控制福建省高校重点实验室,漳州 363000;3.福州大学食品安全与生物分析教育部重点实验室,福建省食品安全分析与检测技术重点实验室,福州 350108)
随着现代工业化进程的加快,环境污染问题日益严重.环境中的重金属容易通过食物链在生命体内累积,对人类生命健康造成重大威胁[1,2].检测重金属污染的方法主要有原子吸收光谱法、原子发射光谱法和电感耦合等离子体质谱法等,但这些方法存在仪器价格昂贵、预处理过程繁琐等不足,难以满足环境污染现场实时、准确检测的要求[3,4].电化学方法具有仪器简单、操作方便、分析速度快、选择性好和可便携等优点,溶出伏安法可用于多种重金属离子的检测[4,5].研究人员通常在传感界面修饰上纳米材料来提高检测的灵敏度.金属有机框架(MOFs)是由金属离子与有机配体配位组成的一种三维有序晶体材料[6~8],具有超大的比表面积、丰富的活性位点和多样的微孔结构,对金属离子具有良好的吸附效果[9~11].采用MOFs 材料修饰的电化学传感器能够有效地富集重金属离子而提高检测的灵敏度[11].如,将ZIF-8 MOF 材料和壳聚糖修饰玻碳电极(GCE)结合,采用溶出伏安法可同时检测Hg2+,Cu2+,Pb2+和Cd2+4种金属离子[11].这类传感技术能实现静态水样中重金属离子的测定,但在流动性水体的测试中依然存在稳定性不足的问题.
微流控分析测试技术能精准控制试剂消耗量、混合速度、驱动及响应等,已在药物研发[12]、电化学能源转化[13]和生命科学[14]等多个研究方向具有重要的应用.2024年,全球微流控产品市场的规模预计将达到173.8亿美元[15],全球企业对微流控芯片技术的研发投入在不断增加.将微流控芯片与便携式电化学检测平台结合,可实现小型化的实验室或现场操作[16~18].当前,利用微流控系统监测重金属主要包括光学和电化学检测方法[4,18].Wang等[19]设计了一种基于微柱阵列工作电极的微流控化学传感器,能够模仿鲨鱼嗅觉纤毛受体细胞的传感功能且有效降低Pb2+检测限到0.8 ppb(~0.0039 μmol/L).Channon等[20]制造了多层微流控电化学碳基传感器,用于灵敏测定Cd2+和Pb2+[检出限分别为1.2 μg/L(0.011 μmol/L)和1.8 μg/L(0.0087 μmol/L)].然而,由于样品溶液是通过纸基的毛细管作用被泵送到检测电极,因此离子测定所需的时间很长.基于微流体流动的通道是纸质微流控的良好替代品,可实现样品溶液的快速流动和检测.Hong 等[21]开发了由Mn2O3多孔纳米材料集成的3D 打印微流控装置,并应用于Cd2+和Pb2+的测定,检出限分别为0.5 μg/L(0.0045 μmol/L)和0.2 μg/L(0.00097 μmol/L).
本文结合微流控技术与电化学溶出伏安法,实现了高通量现场快速检测环境中的多种金属离子污染物.在电化学传感部位修饰上ZIF-8 MOF 纳米材料,利用多孔MOFs 的大比表面积富集待测重金属离子,实现了对流体中Cd2+,Pb2+和Hg2+的实时、灵敏检测.微流控通道所需样液少,且能精准控制待测溶液通过电化学池的流速,从而实现流动性溶液的实时自动化检测.所制备的传感器有望实现污染环境的现场检测和自动化监控;由柔性聚二甲基硅氧烷(PDMS)拓印的微流控通道还有望实现柔性电极的功能.
1 实验部分
1.1 试剂与仪器
六水合硝酸锌[Zn(NO3)2·6H2O]、2-甲基咪唑(2-Methylimidazole)、Nafion117溶液(质量分数5%)、硝酸汞[Hg(NO3)2]、硝酸铅[Pb(NO3)2]和九水合硝酸镉[Cd(NO3)2·9H2O]购自阿拉丁试剂有限公司;聚二甲基硅氧烷(PDMS)购自美国道康宁公司;无水乙醇、氢氧化钠、丙酮、浓盐酸(体积分数37%)、无水醋酸钠、冰醋酸、铁氰化钾(K3[Fe(CN)6])、氯化钾、甲醇、氨水溶液(浓度为25%)、氯化钠、硫酸铁[Fe2(SO4)3]、七水合硫酸锌(ZnSO4·7H2O)、氯化钙、硫酸镁和六水合氯化镍(NiCl2·6H2O)购自西陇科学股份有限公司;高纯氮气和高纯氧气购自佛山市佛伦气体有限公司;氧化铟锡导电玻璃(ITO)购自华南湘城科技有限公司、Ag/AgCl参比电极和对电极铂丝等相关电化学实验用品均购自上海辰华仪器公司;银丝购自昆山盛世景新新材料有限公司;硅胶软管购自南京润泽流体控制设备有限公司;硅片(110)购自广州方导半导体有限公司;混合纤维素酯(MCE)膜(孔径0.22 μm)购自常德比克曼生物科技有限公司.
CHI660E 型电化学工作站(上海辰华仪器公司);FR224CN 型电子天平(上海奥斯豪仪器有限公司);KW-4A型台式匀胶机(中科院微电子);KDC-40型高速离心机(美国瓦里安公司);DM500型徕卡光学显微镜(德国徕卡公司).
1.2 实验过程
1.2.1 微流控模板的制备 以硅片为基底进行光刻加工,制备硅片微流控模板,并采用PDMS拓印出微流控通道.首先在干净的4 英寸硅片[(100)晶面]上旋涂上150 μm 厚的光胶SU8-3050,然后置于95 ℃烘箱内烘干30 min.把预先设计和订购的具有通道图形(2.0 cm×300 μm)的光罩对齐放置在涂有干燥光胶的硅片上,用紫外光照射2 min.然后于65和95 ℃烘箱中分别烘干1和5 min.用AZ 400 K显影剂与水(质量比为1∶1)的混合液浸泡硅片5 min,以除去未曝光的光胶.最后,用足量的异丙醇和去离子水清洗刻蚀好光胶的硅片模板,并用N2气流吹干,再于150 ℃烘箱中烘干5 min.
PDMS 微流控通道的制备:称取质量比为10∶1 的PDMS 单体和PDMS 固化剂,充分搅拌均匀得到PDMS预聚物.放入真空干燥器中抽真空20 min,以除去混合过程产生的气泡.将处理好的PDMS预聚物倒入微流控模板中,置于80 ℃烘箱干燥45 min.用刀片切出一个PDMS模板,用3 mm的打洞笔在通道两端分别打上出口和入口,其中入口作为电化学池.在电化学池两边分别插入1根0.5 mm直径的银丝作为参比电极和对电极.
1.2.2 ZIF-8 MOF的合成 ZIF-8的合成方法较多,采用的溶剂和所得晶体的粒径和形状也不尽相同,表S1列出了不同方法的对比(见本文支持信息).经过对比发现,以甲醇为溶剂的方法得到了菱形十二面体且粒径分布较为均匀,因此本文采用甲醇作溶剂合成ZIF-8 材料[22].将1.79 g 2-甲基咪唑溶解在60 mL 浓度为25%的氨水溶液中,将该溶液缓慢加入含有3.27 g Zn(NO3)2∙6H2O和75 mL甲醇的锥形瓶中,常温下静置20 h.随后,将上述混合物在4000 r/min转速下离心5 min,获得白色固体,将白色固体重新溶解在甲醇中并离心5 min,重复该步骤3次.最后,将离心后的白色固体置于85 ℃的烘箱中干燥12 h.
1.2.3 ZIF-8-Nafion/ITO工作电极的修饰 将ITO电极浸入1 mol/L氢氧化钠乙醇溶液中12 h,然后用去离子水清洗,用丙酮超声5 min,再用无水乙醇超声5 min.将清洗好的ITO 电极保存在无水乙醇中待用.将一定质量的 ZIF-8粉末分散在1.0 mL乙醇溶液中形成分散液A,将溶液A与等体积质量分数为0.5%的Nafion 117乙醇溶液(分散液B)混合并超声30 min,以形成ZIF-8-Nafion分散液C.将打有3 mm孔洞的双面胶粘合在洁净的ITO玻璃上使其仅暴露出直径为3 mm的工作区域.取一定体积的分散液C滴在ITO电极的工作区域,置于室温下直到ZIF-8-Nafion干燥成膜,再用去离子水冲洗电极表面,获得ZIF-8-Nafion/ITO修饰电极.将上述制备好的PDMS微流控通道模板组装到修饰的ITO电极上面即构成一个微流控三电极工作平台.
1.2.4 重金属离子溶液样品的配制 量取5 mL 0.1 mol/L的醋酸-醋酸钠缓冲液(pH=5.5)于电解池中,分别加入10 μL 5 mmol/L 九水合硝酸镉[Cd(NO3)2·9H2O]、硝酸铅[Pb(NO3)2]、硝酸汞[Hg(NO3)2]溶液,置于超声清洗器中超声1 min,使重金属离子分散均匀,从而配制成10 μmol/L 的Hg2+,Pb2+和Cd2+离子溶液.
实际样品溶液的配制:称量552.4 mg醋酸钠固体溶于50 mL的湖水或实验室污水中再加入196.1 mg(约为1.87 mL)冰醋酸,最后加湖水至100 mL,用PH400酸度测定仪(美国科诺工业有限公司)测定其溶液pH值并用盐酸或者氢氧化钠溶液进行微调,最终配制成pH=5.5的醋酸-醋酸钠湖水样品.称取1.0 g 土壤样品置于60 ℃烘箱中干燥2 h,研磨后溶于10 mL 醋酸-醋酸钠缓冲液(0.1 mol/L,pH=5.5)中,所得悬浊液用0.22 μm MCE膜过滤.
1.2.5 电化学检测 电化学CV 曲线在5 mmol/L K3Fe(CN)6,K4Fe(CN)6和0.1 mol/L KCl 的混合水溶液(简称[Fe(CN)6]3-/4-溶液或[Fe(CN)6]3-/4-solution)中测试,扫描电压为-0.2~0.6 V,扫描速率为0.1 V/s(除非特别指明).电化学阻抗谱(EIS)测试的交流电压为10 mV,频率为0.1~106Hz,直流电压为0 V.重金属离子测试在pH=5.5 的0.1 mol/L 醋酸-醋酸钠缓冲液中进行,在DPV 溶出前,需先在-0.9 V的电压下富集120 s(除非特别指明).DPV 溶出电压为-1.05~1.0 V,增幅为0.05 V,脉冲宽度为0.05 s,脉冲周期为0.5 s.每次测试后需在干净的缓冲液中施加+1.0 V 电压30 s 解析重金属离子,然后测DPV直到无明显响应信号为止.
2 结果与讨论
2.1 ZIF-8 MOF及ZIF-8-Nafion的表征
采用XRD,FTIR及SEM技术对合成的MOF进行了表征,结果如图1所示.图1(A)为ZIF-8 MOF材料的XRD谱图,2θ的峰位在 7.26°,10.30°,12.62°,14.60°,16.38°,17.99°和22.04°,分别对应沸石咪唑酯骨架的(110),(200),(211),(220),(310),(222)及(411)晶面(JCPDS 00-062-1030)[22,23].FTIR 谱图[图1(B)]中2932 和3134 cm-1处的吸收带对应咪唑上芳基与脂肪链的C—H 伸缩振动;1376~1580 cm-1处的吸收带对应整个咪唑环的伸缩振动,其中1580 cm-1处的峰可以归属于2-甲基咪唑的C=N 键伸缩振动;693~759 cm-1和949~1307 cm-1处吸收带分别为咪唑环在平面内与平面外的弯曲形变;1460~1143 cm-1和421 cm-1吸收峰分别为C—N键和Zn—N键的伸缩振动[22,23].所得XRD 与红外光谱表征结果与文献[22~24]报道的数据一致.采用SEM 表征了ZIF-8 材料的形貌和元素分布,从图1(C)可以看出,ZIF-8晶体颗粒边缘清晰且呈现正六面体与菱形十二面体的混合物,对晶体颗粒大小进行柱状图及Gaussian函数拟合分析(见支持信息中图S1)得出平均颗粒大小为(74±24)nm,与文献[11,22,23]报道的结果相当.图1(D)~(F)展示了ZIF-8 材料的ZnLα,CKα及NKα的能量色散光谱(EDX)扫描图,可以看出Zn,C,N 3种元素分布相对均匀.

Fig.1 XRD pattern(A),FTIR spectrum(B),SEM image,and Zn Lα(D),C Kα(E),N Kα(F) EDX mappings of ZIF-8 nanocrystals
采用0.5%的Nafion 117乙醇溶液与ZIF-8乙醇溶液混合来修饰ITO电极(其中Nafion乙醇溶液干燥成膜的性能可有效包覆和固定ZIF-8在电极表面[25]).从图S2(A)(见本文支持信息)的XRD谱图可以看出,随着Nafion 的加入谱图在15°~25°处出现一个宽峰,为非晶体Nafion 膜的2θ峰[26],ZIF-8 的特征峰依然存在说明晶体性质未发生本质变化[27].从图S2(B)的FTIR 谱图可以看出,ZIF-8-Nafion 比ZIF-8在1250 cm-1(—CF2)、1062 cm-1(—SO3)、639 cm-1(—C—H)和520 cm-1(—C—F)处增加了透射峰,和文献[28]报道相符.ZIF-8-Nafion 的SEM 照片[图S2(C)]证明了Nafion 包裹的ZIF-8 在电极表面成膜,部分ZIF-8颗粒凸出在膜表面,与Nafion包裹SiO2/SiWA(SiWA为硅钨酸)膜相似[28];其EDX图(见本文支持信息中图S3)表明ZIF-8-Nafion 膜的各元素(ZnLα,NKα,FKα,CKα及SKα)均衡分布在电极表面,即使部分凸起的 ZIF-8颗粒仍通过Nafion与电极紧密结合.
2.2 ZIF-8-Nafion/ITO 工作电极的电化学性能
为了验证ZIF-8-Nafion 修饰ITO 电极(ZIF-8-Nafion/ITO)的导电性,测定了ZIF-8-Nafion/ITO 和Nafion修饰ITO(Nafion/ITO)电极在5 mmol/L[Fe(CN)6]3-/4-溶液中的循环伏安曲线(CV)和EIS谱.从图2(A)可以看出,ZIF-8-Nafion/ITO 修饰电极的阳极峰电流Ipa(120 μA)比Nafion/ITO 的Ipa(6.1 μA)更高;图2(B)所示EIS图也证明Nafion/ITO电极(14.9 kΩ)相对于ZIF-8-Nafion/ITO(409 Ω)具有更高的薄膜电阻.CV 和EIS 表征都证明ZIF-8-Nafion/ITO 比Nafion/ITO 具有更好的导电性,潜在原因是ZIF-8 乙醇溶液和Nafion乙醇溶液的混合(体积比1∶1),将Nafion溶液浓度降低1倍,使得干燥后的Nafion薄膜厚度有效降低从而阻抗减小.图2(C)及其插图显示了ZIF-8-Nafion/ITO随电化学扫速变化的CV图和Ipa及Ipc与扫速平方根v1/2的线性关系,说明氧化还原物质在电极表面的反应是受扩散控制的.图2(D)展示了ZIF-8-Nafion/ITO 和Nafion/ITO 电极对Cd2+,Pb2+及Hg2+的微分脉冲伏安法(DPV)响应,ZIF-8-Nafion/ITO修饰电极对Cd2+,Pb2+及Hg2+的Ipa分别为40.5,55.0 及26.4 μA 而Nafion/ITO 电极仅为20.4,22.0 和7.64 μA.ZIF-8-Nafion/ITO中ZIF-8材料具有大的比表面积,能够通过金属与N和 O原子间的静电交换作用实现对低浓度金属离子(浓度<250 mg/L时)的表面吸附[29].

Fig.2 CV curves of ZIF-8-Nafion/ITO(a) and Nafion/ITO(b) electrodes in 5 mmol/L [Fe(CN)6]3-/4- solution(A),and the associated Nyquist curves(B),scan rate-dependent CV and the peak current vs.v1/2 with v from 0.5,0.3,0.1,0.05,0.03 to 0.01 V/s(C),DPV responses of ZIF-8-Nafion/ITO(a) and Nafion/ITO(b) electrodes to 0.010 mmol/L Cd2+,Pb2+ and Hg2+ in NaAc-HAc buffer(pH=4.5)(D)
2.3 基于微流控通道电化学传感器的工作原理
为了考察MOF多孔材料、微流控技术及电化学方法结合对重金属检测的优越性,设计了以ZIF-8 MOF材料修饰的ITO玻璃作为工作电极的微流控通道电化学池结果如图3所示.首先用光刻硅片的方法制备相关的微流控通道硅片模板,将PDMS 预聚物浇筑在硅片模板上并烘干使PDMS 聚合硬化为PDMS微流控通道,在通道一端打孔3 mm做电化学池并在两端分别接上硅胶导管作为微流控通道的上部[图3(A)].采用ZIF-8-Nafion 溶液修饰ITO 电极的工作区域作为微流控电化学池的下部,随后把PDMS 微流控通道模板组装到工作电极表面,即制成含有三电极系统微型电化学池的微流控芯片[图3(B)及本文支持信息图S4(C)~(E)].微流控技术能够连续不断地泵取容器中的溶液进入芯片中心的电化学池中,并保持电极表面溶液的更新,可以模拟搅动状态下的恒电压金属离子沉积技术,对金属离子在电极表面的富集沉积以及电极的稳定性是有利的;同时ZIF-8多孔材料能够有效地吸附金属离子,因而制备的微流控电化学池可以用来实时、高灵敏地监测流动溶液中重金属离子的浓度[图3(C)].
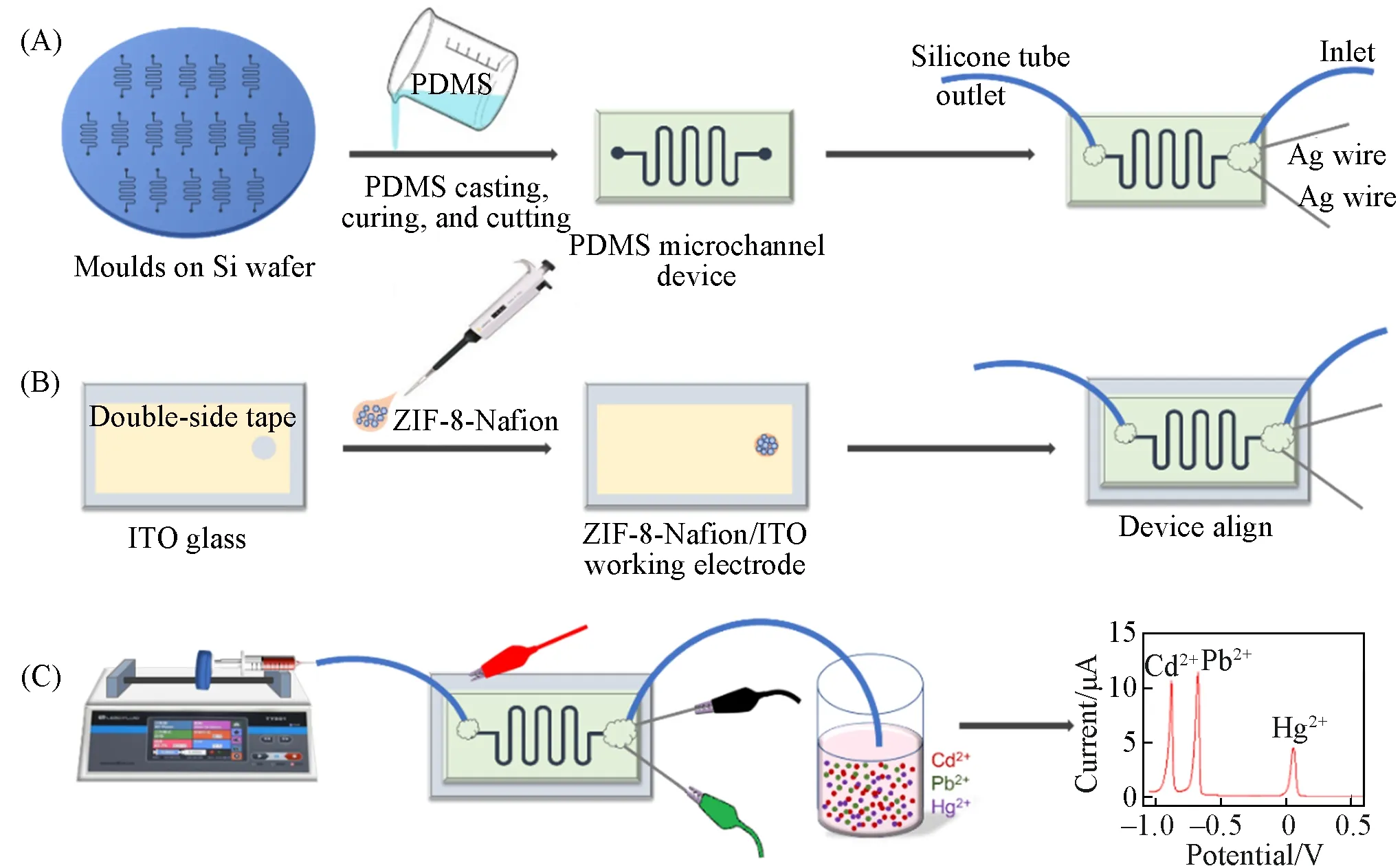
Fig.3 Schematic illustration of the fabrication of PDMS microfluidic channel(A),the PDMS device with ZIF-8-Nafion/ITO working electrode and Ag reference and counter electrodes(B),and using of syringe and pump for microfluidic-control determination of metal ions(C)
2.4 微流控通道的性能验证
微流控通道的硅片模板实物图如图S2(A)所示,其拓印的PDMS 通道宽度为300 μm[图S4(B)].采用具有可逆氧化还原反应的K3Fe(CN)6和K4Fe(CN)6混合溶液对微流控电化学池[图4(A)]进行了电化学可行性验证.采用微流泵控制注射器真空吸微流控通道尾端的硅胶管使K3Fe(CN)6和K4Fe(CN)6混合溶液流入电化学池并同时采用循环伏安法(CV)测试.如图4(B)所示,在溶液流动的状态下K3Fe(CN)6和K4Fe(CN)6探针在微流控电化学池中的氧化还原峰分别在0.270和0.058 V,展现出良好、可逆且稳定的(连续扫描100圈)氧化还原性质.以上结果证明微流控电化学池在待测溶液流动的状态下展现出良好的电化学性能,并能稳定控制流速在30 μL/min工作1 h以上.

Fig.4 Photo of PDMS microfluidic device on an ITO electrode(A),and CV characterization(100 cycles) of the ZIF-8-Nafion/ITO incorporated PDMS microfluidic chip using 5 mmol/L [Fe(CN)6]3-/4- solution(B)
2.5 条件优化及线性关系
电化学实验的参数条件显著影响金属离子的电流响应,因此对ZIF-8的载量、ZIF-8-Nafion溶液的滴涂量、缓冲液pH 值、沉积电位(Ed)和时间(td)等进行了优化.图5(A)~(D)展示了ZIF-8 在0.5%Nafion 乙醇溶液中的载量优化(0~3.0 mg/mL)结果.从图5(A)可以看出,[Fe(CN)6]3-/4-的氧化还原电流先随着ZIF-8载量的增加而增大,当ZIF-8载量为2.0 mg/mL 时最大.随后,随着ZIF-8载量的增加,氧化还原信号开始下降.该CV的响应趋势与EIS得出的薄膜电阻[图5(B)]的趋势一致,说明其氧化还原信号的改变主要是由ZIF-8-Nafion修饰层的电阻改变引起的.采用不同ZIF-8载量的修饰电极对含有0.010 mmol/L Cd2+,Pb2+及Hg2+的醋酸-醋酸钠溶液(pH=4.5)进行检测,发现其金属离子的溶出峰电流Ip[图5(C)和(D)]呈现相同趋势,即在ZIF-8载量为2.0 mg/mL时其峰电流最高.需要注意的是,当ZIF-8 载量为0 时(此时电极表面为纯Nafion 膜),Cd2+,Pb2+及Hg2+的响应信号分别为2.3,4.7 和1.7 μA,说明金属离子可以在纯Nafion膜上沉积,但是ZIF-8的适当引入能够增加金属离子的沉积.

Fig.5 CV curves of ZIF-8-Nafion/ITO electrodes with different ZIF-8 loading concentrations(0,0.5,1.0,1.5,2.0,2.5,and 3.0 mg/mL in 0.5% Nafion ethanolic solution) in 5 mmol/L [Fe(CN)6]3-/4- solution(A),the associated Nyquist curves from EIS measurement(the full curve of Nafion film is shown in Supplementary Information Fig.S5)(B),the DPV responses of above mentioned ZIF-8-Nafion/ITO electrodes to 0.010 mmol/L Cd2+,Pb2+,Hg2+ in NaAc-HAc buffer(pH=4.5)(C),the associated Ip vs.ZIF-8 loading amount(D),Ip vs.ZIF-8 loading volume(E),Ed(F),td(G),and pH(H) optimization results
由图5(E)可见,当滴涂量为28 μL/cm2时Ip响应最高(相应的DPV 曲线见本文支持信息中图S6).ZIF-8具有多纳米孔腔的构造[6~8],对金属离子具有良好的吸附作用,能够实现金属离子在其表面的富集[9~11],因此当ZIF-8滴涂量从4 μL/cm2增加到28 μL/cm2时,Ip逐步增加.随着ZIF-8-Nafion滴涂量的继续增加,其复合膜的电阻作用显著提高,使得电极的导电性降低,Ip也随之降低.从图5(F)可以看出,在Ed=-0.9 V时Cd2+,Pb2+及Hg2+的Ip最高.较低的Ip有助于保证金属离子在电极表面沉积,因此当Ed从-0.6 V降低到-0.9 V时金属离子的Ip不断增加.但是当Ed降低到-1.0 V时,ITO电极中的SnO和SnO2被沉积和溶出(图S6中相应的DPV曲线可以看到很强的Sn2+溶出峰).沉积时间(td)对金属离子的沉积量同样有影响,td过短不利于金属离子的充分沉积,而太长则影响测量的时间和效率.从图5(G)可以看出,td对Cd2+和Pb2+的影响较大而对Hg2+的影响较小,故选择120 s作为最佳td.缓冲液pH值对ITO电极的稳定性、金属离子的水解和沉淀有显著的影响,pH值较低将使ITO的氧化铟锡发生溶解,而较高则金属离子会发生水解沉淀而导致信号下降,由图5(H)可知,pH=5.5为金属离子检测的最佳值.
在最佳的检测条件下,通过对不同浓度的重金属离子进行检测发现,在0.1~100 μmol/L 的浓度(c,μmol)范围内微流控传感器的Ip与Cd2+,Pb2+及Hg2+的浓度呈现良好的线性关系(图6),其线性回归方程分别为
Cd2+,Pb2+及Hg2+的检出限分别为0.055,0.0025及0.0016 μmol/L(S/N=3).该法的检出限低于重金属污染管控标准(Cd2+,Pb2+及Hg2+的要求分别为2.7,103.6和6.5 μmol/L),所以该传感器的灵敏度满足检测要求[30].

Fig.6 DPV responses of different concentrations of Cd2+,Pb2+ and Hg2+ using ZIF-8-Nafion/ITO-based PDMS microfluidic devices(A) and the corresponding Ip vs.c with straight lines of linear fit of the scatters(B)
2.6 微流控传感器的检测性能
采用200 μmol/L 的Ni+,Mg2+,Na+,K+,Fe2+,Zn2+,Ca2+,Cl-,SO42-及NO3-考察了干扰离子对传感器检测信号的影响.如图7(A)和(B)所示,3种金属离子的Ip值基本保持不变,Ip相对标准偏差(RSD)均低于6.0%,说明电极具有良好的抗干扰能力.测定了6 个独立微流控电化学池对金属离子的DPV(图S7,见本文支持信息)和Ip值[图7(C)],发现不同电极之间的重现性良好(3 种离子Ip值的RSD<10%).为探究证微流控器件流动状态对重金属离子检测的影响,首先在微流控电化学池溶液静止的条件下连续进行金属离子测定,发现Ip值随着扫描圈数的增加而递减(图S8,见本文支持信息),说明小电化学池(体积为28.3 μL)中溶液的静止状态不利于金属离子的沉积.而在溶液流动的状态下,对同一支传感器进行连续富集和DPV 扫描5次[图7(D)],3种离子Ip的RSD 值<3.0%,说明流动的溶液有利于电极表面溶液的更新,提高了电极的稳定性;对同一传感器进行连续15 天的测试[隔天一测,图7(E)],其第15天的Ip值仍然分别保留了首次检测值的90%,92%和97%,证明了传感器具有良好的稳定性.传感器的再生性能对实时检测不同浓度的重金属离子具有重要作用.通过对同一微流控电化学池连续实时测试5,20 和10 μmol/L 的流动溶液,发现传感器在测量20 μmol/L 高浓度溶液之后对10 μmol/L的低浓度溶液还具有准确的响应[图7(F)],证明该类型传感器具有良好的再生性能,可用于实时监测重金属离子浓度的变化.
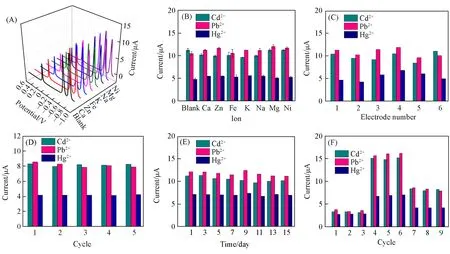
Fig.7 DPV responses(A) and Ip of the as-fabricated devices to 10 µmol/L Cd2+,Pb2+ and Hg2+ with interfering ions(B),Ip of 6 separated PDMS devices(C),Ip of the 5 continuous cycles(D),Ip of determination using a PDMS device for 15 d with 1 d interval(E),and Ip of the real time determination of 5,20,and 10 µmol/L Cd2+,Pb2+ and Hg2+ in buffer solutions(F)
采用微流控传感器对湖水、土壤和实验室污水样品进行检测.通过对空白缓冲溶液的测定发现,湖水样品含有0.705 μmol/L Pb2+和0.133 μmol/L Hg2+.不同浓度(5,20和50 μmol/L)的加标检测结果和加标回收率如表1所示(实验室污水样品检测结果列于表S2,见本文支持信息).加标回收率在91.4%~108%之间,证明该微流控电化学平台具有良好的实际样品检测能力,具有广泛的应用前景.

Table 1 Determination of Cd2+,Pb2+ and Hg2+ in lake water and soil
3 结论
构建了基于ZIF-8 MOF基修饰ITO电极的微流控电化学检测传感器,并将其用于电化学同时检测Cd2+,Pb2+及Hg2+.基于具有大比表面积的丰富微孔ZIF-8材料吸收和固定多种重金属离子、微流控技术使得待测溶液大通量地通过活性工作电极表面以及电化学恒电位富集和溶出伏安法的多重优势,实现了同时对多种金属离子的高灵敏检测.该类传感器对Cd2+,Pb2+及Hg2+在0.1~100 μmol/L的浓度范围内具有良好的检测性能,检出限分别为0.055,0.0025及0.0016 μmol/L(S/N=3).同时,研制的传感器体积小、样品需求量低、便于携带及实现现场实时快速监测,具有潜在的应用前景.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20230395.
感谢闽南师范大学化学化工与环境学院高凤副教授在实验过程的探讨与方案制定,为后续项目顺利进行提供了可行性.

