新型吡唑乙酰胺类琥珀酸脱氢酶抑制剂的设计、合成及抑菌活性
王晓斌,董 雪,王瑞颖,张 娟,王濛琪,张宗群,杨婷玉,许梦寒
(1.江苏海洋大学药学院,江苏省海洋药物活性分子筛选重点实验室,2.海洋工程学院,海洋工程技术研究中心,连云港 222005;3.南京农业大学理学院,江苏省农药学重点实验室,南京 210095)
农用杀菌剂在保护农作物免受植物病原真菌侵扰方面发挥着极其重要的作用[1,2].然而,农用杀菌剂的广泛应用也逐渐暴露了两个亟待解决的问题:(1)部分杀菌剂存在对非靶标生物毒性较大、对环境危害严重的弊病,因与人们逐渐增强的生态环保意识相冲突而被限制使用[3~5];(2)一些杀菌剂长期及不当的使用导致病原真菌迅速产生抗药性,从而制约了我国重大农业病害防控工作的有效开展[6~8].因此,创制应用效果更好、对非靶标生物选择性更强且对环境安全系数更高的绿色杀菌剂对保障我国的粮食安全和促进农业的可持续发展具有重要意义[9,10].
琥珀酸脱氢酶(SDH)是位于真菌线粒体电子传递链上的一类膜蛋白复合物,其活力的强弱对真菌生存所需能量的获取和存储有着重要的影响,是抑菌剂创制领域广受关注的靶标之一[11~13].自1966年以来,先后共有24个琥珀酸脱氢酶抑制剂(SDHIs)被开发用作农用杀菌剂,其分子的核心药效团为芳基甲酰胺结构,特别是氟代吡唑甲酰胺单元在维持SDHIs 广谱高效抑菌活性方面起到了重要作用[14~16].然而,过于相似的分子结构会使SDHIs在长期施用后产生较严重的交互抗性[17,18].近期,研究人员发现氟吡菌酰胺(Fluopyram)、氟唑菌酰羟胺(Pydiflumetofen)和Isoflucypram 等含三元或四元柔性酰胺链的SDHIs[结构见Scheme 1(A)]对因使用萎锈灵(Carboxin)、啶酰菌胺(Boscalid)和吡噻菌胺(Penthiopyrad)等含二元酰胺键的SDHIs[结构见Scheme 1(B)]而产生抗性的菌株依旧保持良好的抑制活性[19~22],这使得对SDHIs酰胺键进行柔性改造成为高效广谱杀菌剂开发的重要策略[23,24].

Scheme 1 Representative SDHIs bearing a flexible amide linkage(A) or commercialized SDHIs bearing a dualistic amide linkage(B)
鉴于柔性酰胺链在SDHIs 抑菌活性方面展现的独特优势,本文将吡唑甲酰胺杀菌剂结构中的甲酰胺单元替换为柔性更为出众的乙酰胺连接链,合成了一系列潜在靶向真菌SDH 的新型吡唑乙酰胺分子(结构见Scheme 2).随后,采用菌丝生长速率法测定了吡唑乙酰胺目标分子对水稻纹枯病菌(Rhizoctonia solani)、小麦赤霉病菌(Fusarium graminearum)和草莓灰霉病菌(Botrytis cinerea)的抑制活性,并运用SDH酶活力测试和分子对接技术初步探讨了高活性分子对真菌SDH的潜在作用方式.
1 实验部分
1.1 试剂与仪器
三氟乙酰乙酸乙酯、溴乙酸乙酯、溴乙烷、氢氧化钠、取代苯胺和O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸(TBTU),分析纯,上海泰坦科技股份有限公司;甲基肼水溶液(质量分数为40%),瑞士Adamas公司;BC0955型琥珀酸脱氢酶测试盒,北京索莱宝科技有限公司.
BRUKER-400型核磁共振波谱仪(NMR),德国Bruker公司;Triple TOF 5600 plus LC/MS/MS型高分辨质谱仪(HRMS),美国ABSciex 公司;SMP-50 型全自动数字熔点仪,英国Bibby 科学有限责任公司;ZF-1A 型三用紫外分析仪,上海勤科分析仪器有限公司;OSB-2100 型旋转蒸发仪,日本EYELA 公司;ELX800型酶标仪,美国Bio-Rad公司.
1.2 实验过程
1.2.1 中间体2-[5-羟基-1-甲基-3-(三氟甲基)-1H-吡唑-4-基]乙酸(2)的合成 在100 mL 乙醇中加入14.62 mL(0.10 mol)三氟乙酰乙酸乙酯,16.58 g(0.12 mol)碳酸钾和1.66 g(0.01 mol)碘化钾,常温下搅拌10 min后加入16.63 mL(0.15 mol)溴乙酸乙酯,加热至回流并反应8 h.减压蒸馏除去多余乙醇,所得残渣用乙酸乙酯溶解,经水洗除去钾盐,再次减压蒸馏得到含2-(2,2,2三氟乙酰基)琥珀酸二乙酯(中间体1)的黄色液体.将上述黄色液体溶于100 mL乙醇,加入13.24 mL(0.10 mol)甲基肼水溶液后加热回流反应8 h;加入8.00 g(0.20 mol)氢氧化钠后再次回流反应4 h.减压蒸馏除去多余乙醇,残渣用水溶解后用乙酸乙酯洗涤.随后用盐酸调节水相体系pH值为2,以乙酸乙酯萃取,用无水硫酸钠干燥,经减压蒸馏得到中间体2白色粉末.
1.2.2 中间体2-(5-乙氧基-1-甲基-3-(三氟甲基)-1H-吡唑-4-基)乙酸(5)的合成 将8.94 g(0.04 mol)中间体2溶于100 mL甲醇,加入少量浓硫酸后加热回流反应8 h,经减压蒸馏除去多余甲醇,所得残渣用乙酸乙酯溶解,经水洗除去硫酸,用无水硫酸钠干燥,再次减压蒸馏得到2-[5-羟基-1-甲基-3-(三氟甲基)-1H-吡唑-4-基]乙酸甲酯(中间体3).在100 mL 乙腈中加入9.53 g(0.04 mol)中间体3、4.48 mL(0.06 mol)溴乙烷和6.63 g(0.05 mol)碳酸钾,加热回流反应10 h;经减压蒸馏得到含2-[5-乙氧基-1-甲基-3-(三氟甲基)-1H-吡唑-4-基]乙酸甲酯(中间体4)的黄色油膏.将上述黄色油膏加入质量分数为5%的氢氧化钠溶液(64.00 mL)中,加热反应2 h后用盐酸调节体系pH值为2,用乙酸乙酯萃取,经无水硫酸钠干燥,减压蒸馏得到中间体5白色粉末.
1.2.3 目标化合物6a~6j的合成 化合物6a~6j的合成路线见Scheme 3(A).将0.76 g(3.00 mmol)中间体5加入15 mL氯化亚砜中,搅拌并加热至回流反应8 h.经减压蒸馏除去多余氯化亚砜后,所得残渣用25 mL 二氯甲烷溶解,加入3.00 mmol 取代苯胺和1.25 mL(9.00 mmol)三乙胺,常温下搅拌10 h 后用水洗涤,有机相用无水硫酸钠处理,经减压蒸馏除去多余二氯甲烷,所得残渣用质量分数为95%的乙醇溶液重结晶,得到目标产物6a~6j.

Scheme 3 Synthetic routes of target compounds 6a—6j(A) and 6k,6l(B)
1.2.4 目标化合物6k 和6l 的合成 化合物6k 和6l 的合成过程见Scheme 3(B).将0.67 g(3.00 mmol)中间体2,3.00 mmol取代苯胺和1.25 mL(9.00 mmol)三乙胺加入25 mL二氯甲烷中,搅拌10 min后加入1.16 g(3.60 mmol)TBTU,常温下继续搅拌反应10 h.所得反应液经水洗涤,无水硫酸钠干燥,减压蒸馏及乙醇(质量分数为95%)重结晶得到目标产物6k和6l.
1.2.5 中间体2 和5 及目标分子6a~6l 的表征 化合物结构经1H NMR,13C NMR,19F NMR 和HRMS 确证.中间体2和5及目标分子6a~6l的的理化性质和表征数据如表1和表2所示,相关谱图见本文支持信息图S1~图S56.
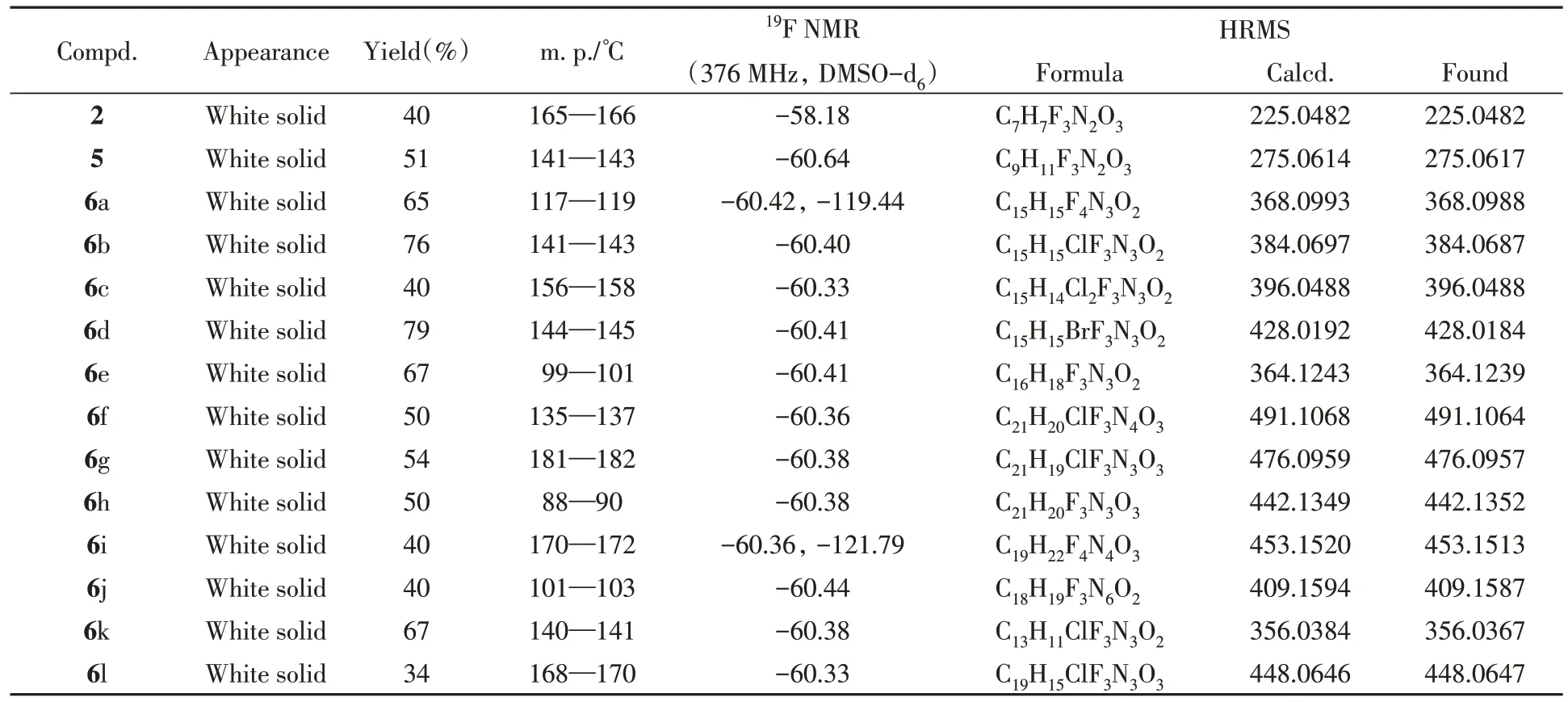
Table 1 Appearance,yields,melting points(m.p.),19F NMR and HRMS data of compounds 2,5 and 6a—6l

Table 2 1H NMR and 13C NMR data of compounds 2,5 and 6a—6l
1.3 抗植物病原真菌活性测试
以农用杀真菌剂噁霉灵(Hymexazol)和氟吡菌酰胺为阳性对照,采用菌丝生长速率法测定了目标分子6a~6l对水稻纹枯病菌,草莓灰霉病菌和小麦赤霉病菌的抑制效果[25~27].上述菌株由南京农业大学江苏省农药学重点实验室提供.
1.4 水稻纹枯病菌SDH的提取及活力测试
参照文献[23,24]方法提取水稻纹枯病菌的SDH,并利用琥珀酸脱氢酶测试盒测定了目标分子6l对水稻纹枯病菌SDH的抑制活性.
1.5 同源模建和分子对接
参照文献[23,24]方法构建了水稻纹枯病菌SDH 蛋白,并基于此蛋白模型进行了目标分子6l 与SDH的分子对接研究.
2 结果与讨论
2.1 目标化合物的合成及结构表征
如Scheme 2所示,三氟乙酰乙酸乙酯在碳酸钾作用下与溴乙酸乙酯发生亲核反应,生成的含三氟乙酰基的琥珀酸二乙酯随即在碱性条件下与甲基肼发生环化作用,得到吡唑乙酸类中间体2.中间体2与甲醇发生酯化反应,所得产物依次与溴乙烷和氢氧化钠溶液发生反应,得到另一个含有吡唑乙酸骨架的中间体5.中间体5与氯化亚砜发生氯代反应后,在三乙胺存在下与取代苯胺发生酰胺化反应得到目标分子6a~6j.此外,在含三乙胺的二氯甲烷中,中间体2在TBTU 作用下与取代苯胺发生酰胺化反应得到目标分子6k和6l.所构建分子6a~6l的结构通过1H NMR,13C NMR,19F NMR和HRMS方法进行确证,相关结构数据列于表1和表2,相应谱图见本文支持信息图S9~S56.
以目标分子6b 的表征数据解析为例进行具体分析.在化合物6b 的1H NMR 谱图中,δ10.27 处的单峰为酰胺键上质子氢的信号峰;δ7.59 和7.36 处的双峰分别为苯胺邻位和间位质子氢的信号峰;δ4.26和1.31处的四重峰和三重峰是吡唑5位乙氧基质子氢的信号峰;δ3.71和3.54处的单峰分别为吡唑1位甲基和吡唑4位亚甲基质子氢的信号峰.在化合物6b的13C NMR谱图中,δ168.55处的吸收峰为酰胺羰基碳的信号峰;δ122.12 和139.49 处的四重峰为三氟甲基和吡唑3 位碳的信号峰;δ152.67和99.41处的吸收峰分别是吡唑5位和4位碳的信号峰;δ138.49~121.14处的吸收峰为苯环碳的信号峰;δ71.82和15.60处的吸收峰为吡唑5位乙氧基碳的信号峰;δ35.19和29.40处的吸收峰分别是吡唑4位亚甲基和吡唑1位甲基碳的信号峰.在化合物6b的19F NMR谱图中,δ-60.40处的吸收峰为三氟甲基氟的信号峰.化合物6b的HRMS谱图显示,[M+Na]+离子峰的吸收信号为m/z384.0687,与其分子式C15H15ClF3N3O2[M+Na]+的计算值m/z384.0697十分接近.
2.2 目标分子的抑菌活性
为考察苯胺上取代基类型对抑菌活性的影响,首先合成了目标分子6a~6j,并采用菌丝生长速率法测定了上述10个分子在药剂质量浓度为50 μg/mL时对水稻纹枯病菌,小麦赤霉病菌和草莓灰霉病菌的抑制活性.测试结果(表3)表明,化合物6b,6g和6h在药剂质量浓度为50 μg/mL时对水稻纹枯病菌的抑制效果最优,抑制率分别为35.33%,37.11%和40.00%,与对照药剂噁霉灵和氟吡菌酰胺保持相当.同时,化合物6b,6d和6g在药剂质量浓度为50 μg/mL时对小麦赤霉病菌的抑制效果较明显,抑制率分别达到16.92%,20.59%和26.97%.此外,化合物6b,6g和6h在药剂质量浓度为50 μg/mL时对草莓灰霉病菌也展现出较明显的抑制效果,抑制率分别达到28.49%,20.70%和20.43%.上述抑菌测试结果表明,在苯胺苯环的对位引入氯原子和4-氯苯氧单元能显著改善分子骨架的抑菌活性.
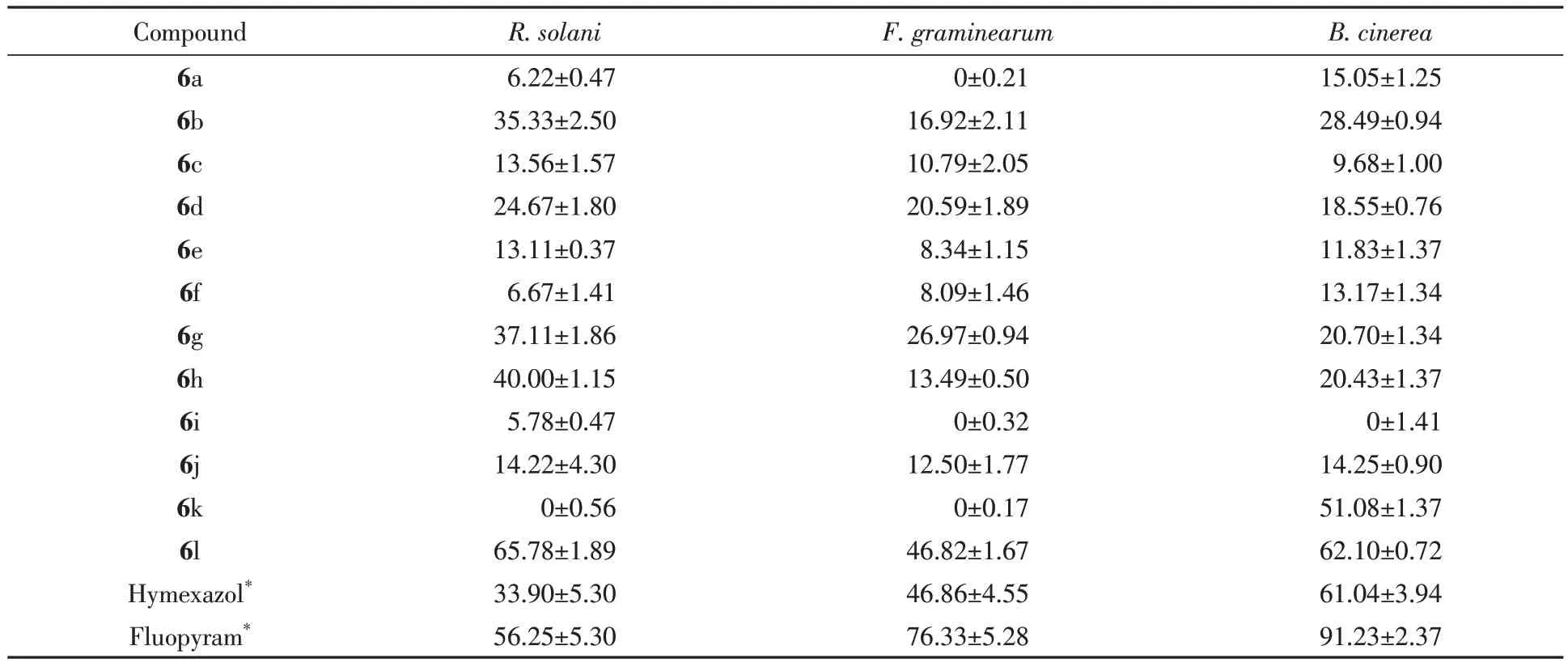
Table 3 Antifungal activities of compounds 6a—6l at 50 µg/mL
为探索吡唑5 位取代基类型对抑菌活性的影响,在保留苯环对位氯原子和4-氯苯氧单元的基础上,构建并测定了目标分子6k和6l在药剂质量浓度为50 μg/mL时对3种测试真菌的抑制活性,结果如表3所示.抑菌测试结果表明,化合物6l在药剂质量浓度为50 μg/mL时对水稻纹枯病菌,小麦赤霉病菌和草莓灰霉病菌的抑制效果(65.78%,46.82%和62.10%)均优于化合物6g(37.11%,6.97%和20.70%).同时,化合物6k 在药剂质量浓度为50 μg/mL 时对草莓灰霉病菌的抑制效果(51.08%)也显著优于化合物6b(28.49%).上述结果表明,将改善分子吡唑5位的乙氧基替换为羟基能显著改善所得分子的抑菌效果.化合物6l在药剂质量浓度为50 μg/mL时对水稻纹枯病菌的抑制效果(65.78%)显著优于对照药剂噁霉灵和氟吡菌酰胺(33.90%和56.25%).抑菌活性测试结果(图1和表4)表明,化合物6l 对水稻纹枯病菌的半最大效应浓度(EC50)值为19.92 μg/mL,其活性显著优于对照药剂噁霉灵(76.74 μg/mL)和氟吡菌酰胺(40.36 μg/mL).
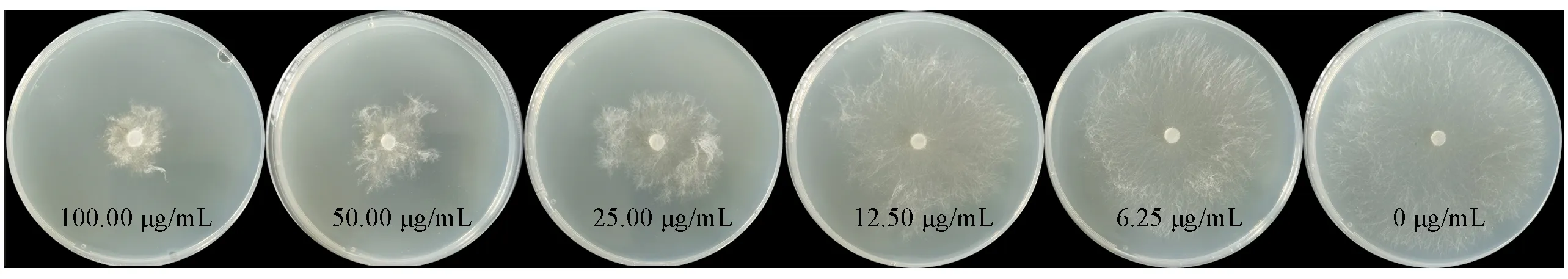
Fig.1 Anti-R.solani effects of compound 6l
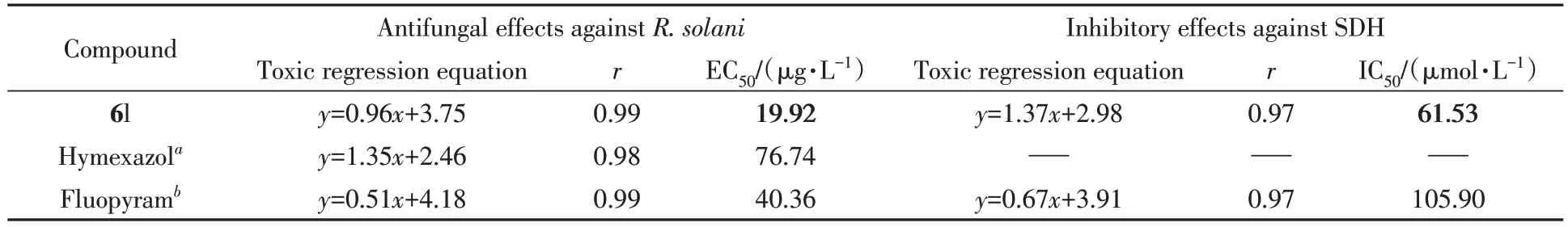
Table 4 Inhibitory effects of compound 6l against R.solani and their SDH
2.3 化合物6l与水稻纹枯病菌SDH的分子对接研究
为探究SDH 是否为化合物6l 分子的潜在作用靶标,测定了化合物6l 对水稻纹枯病菌SDH 的抑制效果.由表4结果可见,化合物6l对水稻纹枯病菌SDH的半数抑制浓度(IC50=61.53 μmol/mL)要明显优于氟吡菌酰胺(105.90 μmol/mL),证实真菌体内的SDH是化合物6l抑菌活性发挥的潜在作用靶标.随后,通过同源模建的方法获得了水稻纹枯病菌SDH的蛋白模型,并运用Autodock 4.2.6程序进一步探究了化合物6l分子与水稻纹枯病菌SDH的潜在作用方式(图2).分子对接研究结果表明,化合物6l分子和氟吡菌酰胺以近似相同的构象嵌入琥珀酸脱氢酶上的活性口袋中,同时这两个活性分子与周围残基的相互作用方式也基本相同.如,残基ARG 81和TYR 128通过氢键与化合物6l 和氟吡菌酰胺发生相互作用,残基ILE 230,ILE 78,VAL 82借助Pi-Alkyl和Alkyl的方式与上述两个活性分子发生相互作用.上述作用方式在一定程度上维持了化合物6l分子对植物病原真菌的抑制活性.其次,化合物6l分子中的二苯醚单元以Alkyl和Pi-Alkyl的方式与残基ILE 78,VAL 82和PHE 121发生作用,这可能是含二苯醚单元的目标分子对植物病原真菌抑制活性明显优于其它目标分子生物活性的重要原因.此外,化合物6l中的吡唑5位羟基通过氢键与残基TYR 128发生作用,这可能是含羟基的吡唑乙酰胺分子在抑菌表现方面优于含乙氧基吡唑乙酰胺分子的重要原因.
3 结论
鉴于酰胺链柔性改造在新型SDHIs创制方面展现的独特优势,将吡唑甲酰胺杀菌剂结构中的甲酰胺单元替换为柔性更为出众的乙酰胺连接链,构造了一系列潜在靶向真菌SDH 的新型吡唑乙酰胺分子.经1H NMR,13C NMR,19F NMR和HRMS确证分子结构后,采用菌丝生长速率法测定了上述分子对植物病原真菌的抑制活性.通过抑菌活性测试发现了具有广谱抑菌特性的二苯醚联吡唑乙酰胺分子6l,其在药剂质量浓度为50 μg/mL 时对水稻纹枯病菌,小麦赤霉病菌和草莓灰霉病菌的抑制率(65.78%,46.82%和62.10%)与对照药剂噁霉灵(33.90%,46.86%和61.04%)保持相当.生物活性测试结果表明,化合物6l 对水稻纹枯病菌的EC50值为19.92 μg/mL,抑菌活性明显优于对照药剂噁霉灵和氟吡菌酰胺(76.74 μg/mL 和40.36 μg/mL).SDH 酶活力测试结果证明真菌体内的SDH 是化合物6l抑菌活性发挥的潜在作用靶标,其对水稻纹枯病菌SDH的IC50值(61.53 μmol/mL)要明显优于氟吡菌酰胺(105.90 μmol/mL).进一步的分子对接研究表明,化合物6l分子中的二苯醚单元能以多种方式与靶标口袋内的氨基酸结合,对分子抑菌活性的发挥起到关键作用.研究结果表明,二苯醚联吡唑乙酰胺分子对植物病原真菌具有较显著抑制作用,具备作为优势抑菌先导结构进行深度发掘的潜力.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20230444.

