后处理厂红油可能组分丁醇及其衍生物与HNO3的绝热量热研究
徐晓琴,刘 巍,余勇斌,吴瑞才,唐双凌
南京理工大学 环境与生物工程学院,江苏 南京 210000
以磷酸三丁酯(TBP)为萃取剂的PUREX流程是湿法后处理工艺的典型代表[1]。TBP具有良好的化学稳定性和耐辐照稳定性[2],但其降解产物的成分复杂且不易去除,TBP在酸催化作用下的逐级水解和放射线作用下的辐照分解而降解,降解产物对萃取过程的影响较大。文献[3]表明TBP的主要降解反应是水解生成磷酸二丁酯(HDBP)和丁醇,丁醇可以硝化(产生硝酸丁酯)或氧化(产生羧酸),酮类和醛类的形成可能是醇氧化反应中生成羧酸的中间产物,所有的降解产物都可以进行热裂解,最终生成N2、CO2等气体产物。
后处理过程中红油的形成和随后的分解会导致爆炸性的热失控[4-9],关于“红油”的形成是一个复杂过程,丁醇及其衍生物都有可能是形成红油的组分之一,当这些物质处于HNO3等强氧化剂的环境中时,在一定温度下可能会发生热失控现象,分解出大量的气体产物和热量,当气体产物和热量大量积累时可能会导致爆炸事故的产生,所以了解丁醇及其衍生物与HNO3体系的放热行为是非常必要的。
绝热加速量热仪(ARC)在研究物质稳定性能和安全评估方面有一定的优势[10-11],相比差热分析、热重分析等方法有更高的测试灵敏度,能够获得压力数据。在进行红油组分的量热研究时,也不能忽略丁醇及其衍生物带来的热危险性。关于醇类与HNO3在后处理体系的放热反应已有学者研究[12],但酮类和醛类物质与HNO3的热稳定性研究甚少。当反应体系达到零氧平衡时,理论上体系放热完全,因此本工作拟以丁醇、丁酮、丁醛、丁酸为标准样品,采用ARC重点研究在零氧平衡条件下丁醇等组分与HNO3体系的放热行为及研究HNO3浓度对丁醇-HNO3体系的影响,通过测试结果进行分析,并对体系进行热安全评估。
1 实验部分
1.1 试剂及仪器
HNO3,质量分数为68%,南京化学试剂有限公司;丁醇,分析纯,成都市科隆化学品有限公司;丁醛/丁酸,分析纯,上海阿拉丁生化科技有限公司;丁酮,分析纯,国药集团化学试剂有限公司。
ARC-ES绝热加速量热仪,英国THI公司,精度0.005 ℃/min,温度范围25~450 ℃,压力范围0~13.8 MPa。
1.2 实验过程及测试条件
进行ARC实验正式测试前对仪器进行校准与漂移测试。本工作是在反应体系达到零氧平衡条件下、有机物质量分数相同时进行ARC测试,具体测试条件见表1。ARC参数设置如下:起始温度:35 ℃;终止温度:250 ℃;等待时间:10 min;温升阶梯:5 ℃;反应腔体加热速率:10 ℃/min;温度检测灵敏度:0.02 ℃/min;最大压力:200 kPa;样品池类型全部为哈氏合金小球。

表1 样品测试条件Table 1 Testing conditions of various samples
1.3 测试数据校正及动力学参数计算
1.3.1测试数据校正 在放热反应中产生的热有三种用途,即加热样品、容器或样品球以及周围环境。加热试样所消耗的热量取决于样品质量和比热。容器加热所用热量的比例称为热惰性因子[13-14](φ),可表示为:
(1)
式中:mb和ms分别表示样品容器和样品的质量,g;cp,b和cp,s分别表示容器和样品的比热容,J/(g·℃)。
1.3.2动力学参数[14]ARC测试中样品的自加热温度和测量值之间的关系为式(2)。
Δθad=θf-θ0=φΔθad,s
(2)
式中:θf为样品的最高反应温度,℃;θ0为样品的起始反应温度,℃;Δθad为样品的绝热温升值,℃;Δθad,s为反应系统的实际绝热温升值,℃。ARC的温升速率方程表示为式(3)。
(3)
(4)
式中:mθ,s,反应系统的温升速率,℃/min;θf,s,反应系统的放热段最高温度,℃;θ为反应系统的温度,℃;t为反应时间,min;k为反应速率常数,min-1;n为反应级数。根据测试所得到的初始分解温度、反应的最高温度以及不同时刻反应体系的温度和温升速率,由式(4)可求得不同温度下的反应速率常数k。由Arrhenius方程可得k的对数形式(式(5))。
(5)

1.4 危险性评估方法
在实际测量中,对于某些分解热很大的物质,其放热终点很难测得。为了更好地反映热失控反应发生的难易程度,对化学物质的危险进行评估和评级。尚文娟等[15]提出一种新的自反应性化学物质的热危险性综合评估指数(THI指数)。某特定的自反应性物质的热风险可以通过THI指数进行定量描述。
THI=αβ=e-0.000 8(θ0-4.628 6)1.290 4×[1-e-0.574 9(-ΔH-0.046 5)0.650 1]
(6)
式中:α,与初始反应温度θ0相关的无量纲值,其值随着θ0减小而增大;β,与反应热-ΔH相关的无量纲值,其值随着-ΔH增大而增大。
故将所测样品通过绝热量热实验得到的绝热特性参数起始反应温度θ0和反应热-ΔH,代入式(6),就可得到各组样品的热危险性综合评估指数。THI指数将分级标准分为5个等级,热危险分级标准列入表2[15]。

表2 热危险性分级标准[15]Table 2 Grading criteria of thermal risk assessment[15]
2 结果与讨论
2.1 丁醇/丁酮等纯物质的绝热量热测试结果与分析
在探究丁醇、丁醛、丁酮及丁酸与HNO3放热反应行为前,对丁醇等纯物质进行ARC测试,恒定样品质量1 g左右,具体测试结果示于图1。由图1可知:在温度为35~250 ℃,所测样品体系均没有发生自放热现象,这说明在测试温度范围内四种组分自身均具有较好的热稳定性,不会发生自放热分解反应,同时可以看出,在温度范围内四种物质压力均有明显的变化,这是因为样品球内气体受热膨胀导致。
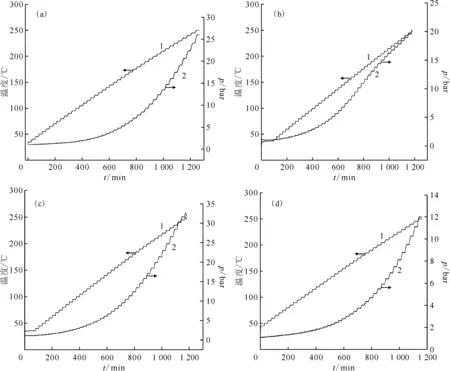
1——温度变化曲线,2——压力变化曲线
2.2 丁醇与不同浓度HNO3的绝热量热测试结果与分析
丁醇与不同浓度HNO3溶液的ARC测试得到的温度曲线、升温曲线、压力曲线、升压曲线示于图2。由图2(a)可见:丁醇与不同浓度HNO3反应时,体系的温度变化趋势基本相同,在短时间内自放热温度达到最大值,而后自放热程度减弱,曲线变得平缓;丁醇与2.0 mol/L HNO3反应时体系自放热反应起始温度为55.4 ℃;继续增加HNO3浓度,即3.0、4.0、5.0、6.0 mol/L时,自放热反应起始温度依次为45.7、40.2、35.5、35.2 ℃,这说明HNO3浓度越高,丁醇与HNO3发生自放热反应的起始温度越低,自放热反应越容易发生。同时,从图2(b)和图2(d)可以看出,随着HNO3浓度增加,丁醇-HNO3体系自放热时的最大升温速率、最大升压速率均呈现逐步增加的趋势;结合压力曲线(图2(c))也可以看出,压力曲线的趋势和温度曲线基本相同,当HNO3浓度为2.0 mol/L时,体系自放热温度能达到123.7 ℃,最大压力达到34 bar(1 bar=105Pa);当HNO3浓度为6.0 mol/L时,丁醇-HNO3的自放热发生剧烈反应,20 min内,体系的绝热温升达到100.0 ℃,而后放热变得平缓,整个自放热段的绝热温升为141.4 ℃;结合温升曲线(图2(b))可以看出,体系的最大升温速率达到376 ℃/min,放热反应生成大量气体产物,最大压力达到70 bar,比HNO3浓度为2.0 mol/L时,增加2倍左右;若继续增加HNO3浓度,体系的危险性会进一步增加,甚至出现热失控现象。
HNO3浓度,mol/L:——2.0,——3.0,——4.0,——5.0,——6.0
丁醇与不同浓度HNO3测试数据、校正之后的数据以及动力学计算结果汇总列于表3。

表3 丁醇与HNO3体系的热分解特性参数Table 3 Thermal decomposition characteristic parameters of butanol and nitric acid
从表3可知:HNO3浓度越高,体系的放热量越大,反应越剧烈,这与图2显示的特征一致;HNO3浓度达到6.0 mol/L时,自放热反应释放1 047.3 J/g的热量,导致绝热温升为141.4 ℃,经热惰性因子校正后,计算得到的绝热温度升高至261.6 ℃。此外,从丁醇与HNO3体系的反应级数看出HNO3浓度的改变可能并未改变体系的反应历程;同时从表观活化能数据可见,HNO3浓度越高,体系的表观活化能越低,反应越容易进行,体系的稳定性越差,也就意味着危险性越大。
2.3 丁醇/丁醛/丁酮/丁酸与HNO3的绝热测试结果分析
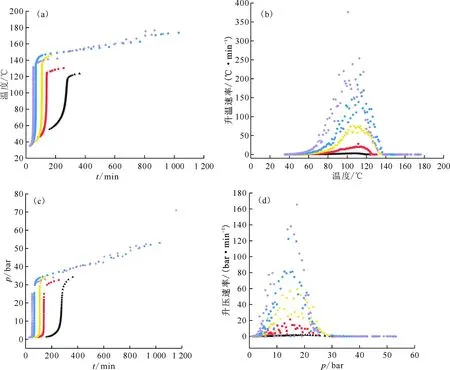
选择HNO3浓度为4.0 mol/L时,通过对丁醇及其衍生物与HNO3反应的ARC测试数据绘制升温曲线、压力曲线、升温速率以及升压速率曲线,示于图3。从图3可知:丁醇及其衍生物分别与4.0 mol/L HNO3反应时,均存在不同程度的放热反应;其中,丁醛-HNO3体系放热最剧烈,其次是丁醇-HNO3体系,再次是丁酮-HNO3体系,丁酸-HNO3体系最后;丁醇-HNO3体系在40.2 ℃左右时开始发生放热,自反应放热段最高温度达到145.7 ℃,最大升温速率为75.8 ℃/min,结合图3(c)可知,体系压力变化趋势从放热温度开始逐步增加,变化幅度明显,在3.5 h内,压力从1 bar升高到34 bar左右。丁醛-HNO3体系在72 ℃开始自放热,体系温度出现急剧升高的现象,温度升高约118.4 ℃,压力显著增加。考虑到安全方面,实验过程中丁醛样品质量在0.14 g左右,若样品质量足够大时,可能会发生急剧的热失控反应,甚至导致爆炸。丁酮-HNO3的反应能够在较短的时间内发生急剧的温度上升,压力增加幅度也较明显。丁酮与HNO3体系的升温速率随温度的变化呈现先升高后降低的趋势,升温速率最大达到30.0 ℃/min。从温度曲线可以看出,丁酸-HNO3体系在小于140 ℃未观察到放热点,因此图中也未显示出相关数据点,丁酸与HNO3反应时在零氧平衡条件下的绝热温升达到83.2 ℃,在高温条件下也具有一定的危险性。

组分:——丁醇,——丁醛,——丁酮,——丁酸
丁醇、丁醛等四种组分与4.0 mol/L HNO3的ARC测试的实测数据、校正之后的数据以及动力学计算结果列入表4。从表4可知:从放热数据看出,放热量大小顺序为:丁醛>丁醇>丁酮>丁酸;其中,丁醛与HNO3反应时放热最剧烈,反应热量最大,释放了776.6 J/g的热量,样品室和样品温度升高118.4 ℃,考虑到热惰性因子φ,经校正计算得到绝热温升为194.2 ℃;丁醇、丁醛、丁酮及丁酸与HNO3体系的反应级数分别为5.0、6.2、3.6、5.0,结合表观活化能数据可知,表观活化能越低,反应越容易进行。

表4 丁醇及其衍生物与HNO3的热分解特性参数Table 4 Thermal decomposition characteristic parameters of butanol and its derivatives and nitrate acid
2.4 热危险评估
根据所测得的热力学数据,计算得出表1样品1—8的THI指数,具体数值列入表5。从表5可知:对于样品1—5,随着HNO3浓度增加,丁醇-HNO3体系的THI数值逐渐增加,危险等级从3级升高到4级,这说明增加HNO3浓度会使体系反应更剧烈,危险性增加;丁醇、丁醛与4.0 mol/L HNO3反应体系的THI指数分布在4等级,危险性在较高级别;丁酮、丁酸与4.0 mol/L HNO3反应体系的THI指数均分布在3等级,危险性在中等级别。
2.5 反应机理讨论
后处理废液中常见的反应类型有水解、辐射分解、氧化、硝化和热解等,这些反应类型在一定温度下可能会发生热失控现象;本工作选择的是HNO3等强氧化剂环境,故可能会存在氧化和硝化等放热反应,同时在绝热环境中时,体系放热产生的热量会加剧反应剧烈程度。
本研究体系中,HNO3可作为硝化和氧化剂与丁醇直接反应;丁醇与HNO3发生酯化反应生成硝酸丁酯,生成的硝酸丁酯在室温下极不稳定,会分解产生丁醛、氢气和亚硝酸等物质;丁醇最终被氧化为丁酸可能存在两种路径[16]:其一,当浓硝酸存在时,丁醇经丁醛中间体而后氧化生成丁酸,由上述实验可知,丁醛具有很高的反应性,使体系的危险性加剧,释放大量热量;其二,在稀硝酸条件下,丁醇经过亚硝酸丁酯中间体转化为丁酸。这些放热反应和易燃、易爆物质都可能导致体系发生热失控反应,严重时可导致爆炸。
后续工作将继续通过红外光谱仪和气质联用仪等化学分析手段对丁醇及其衍生物与HNO3体系的反应产物进行进一步研究,确定其主要的反应机理。
3 结 论
通过ARC研究了丁醇、丁醛等红油可能组分与HNO3的放热行为,对结果进行分析,同时以丁醇为例,研究了HNO3浓度对丁醇-HNO3体系的放热反应的影响,得到如下结论。
(1) 丁醇、丁醛、丁酮及丁酸四种物质在35~250 ℃内具有较好的热稳定性,不会发生自放热分解反应。
(2) 绝热条件下,随着HNO3浓度增加(2.0~6.0 mol/L),丁醇-HNO3体系的自放热反应的起始温度越低,放热量越高。
(3) 在零氧平衡条件下,丁醇、丁醛、丁酮、丁酸与4.0 mol/L HNO3反应均有明显放热,其中丁醛与HNO3反应时放热最剧烈,放热量为776.6 J/g,放热量大小顺序为丁醛>丁醇>丁酮>丁酸。
(4) 通过THI指数法对反应体系进行危险性评估,结果发现:随着HNO3浓度的增加,丁醇-HNO3体系的THI数值逐渐增加,危险等级从3级升高到4级,这说明HNO3浓度的增加会使反应更剧烈,危险性增加;丁醇、丁醛与HNO3反应体系的THI指数分布在4等级,危险性在较高级别;丁酮、丁酸与HNO3反应体系的THI指数均分布在3等级,危险性在中等级别。

