军事航空噪声性隐匿性听力损失C57小鼠模型的构建与评价
姜一弘,张 敏,朱 靖,王 菲,郑泽宇,刘玉辉,李聪聪,张卓儒,畅 通,王小成
(空军军医大学:1航空航天医学系航空航天临床医学中心,航空航天医学教育部重点实验室,2西京医院空勤科,3基础医学院学员三大队,陕西 西安 710032;4空军杭州特勤疗养中心疗养五区,江苏 无锡 214125)
隐匿性听力损失(hidden hearing loss,HHL)是近年来受到人们广泛关注的一种新型听力损失类型。患者主诉聆听困难,特别是噪声环境下言语识别困难,但听阈检测基本正常[1]。前期研究初步认为,HHL是一种可恢复的暂时性毛细胞损伤,其主要病理基础可能是耳蜗带状突触受损和毛细胞功能异常,但到目前为止,HHL的确切发病机制和病理基础尚不完全清楚,需要进行深入研究[2]。
军事航空噪声主要由军用飞机的自旋翼、涡轮发动机、传动系统等产生,军事航空噪声强度高,容易导致部队官兵听觉系统受损。由于长期暴露于高性能战机产生的高强度噪声环境中,航空兵部队空勤和地勤人员极易罹患军事航空噪声性听力损失[3]。
高强度噪声导致听阈显著升高,发生永久性阈移即噪声性耳聋。研究证实中等强度噪声暴露会导致HHL[4-5]。近年来,HHL的机制和防治研究成为了国内外听觉领域研究的热点,但目前仍无成熟的军事航空噪声性HHL C57小鼠动物模型[6-10]。本研究拟通过比较不同强度和不同时间军用直升机噪声暴露前后听功能和内耳形态上的差异,建立军事航空噪声性HHL C57小鼠动物模型,为进一步探究其致病机制和防护措施提供参考模型。
1 材料与方法
1.1 材料
1.1.1 实验动物 实验所用动物为4周龄雄性C57BL/6J小鼠,购于空军军医大学实验动物中心,实验前无噪声暴露史。小鼠饲养于普通洁净动物房,自然光照,室温21~25 ℃。实验前适应性喂养1周。所有实验操作均得到空军军医大学实验动物福利与伦理委员会批准(许可证号:20220331)。
1.1.2 实验试剂和仪器 戊巴比妥钠(Sigma,美国);速眠新Ⅱ注射液(华牧动物保健品有限公司,中国);TritonX-100(MP Biomedicals,美国);PBS(Biosharp,中国);即用型山羊血清(BOSTER,中国);兔抗CtBP2抗体(1∶200,Abcam,英国);山羊抗兔二抗(1∶200,Proteintech,美国);含DAPI抗荧光淬灭封片液(Beyotime,中国);音箱(广州声霸智能科技有限公司);功放(广州声霸智能科技有限公司);声级计(广州宏诚集业电子科技有限公司);脑干诱发电位仪(Otometrics,丹麦);体视显微镜(宁波舜宇仪器有限公司);共聚焦显微镜(Zeiss,德国)。
1.2 方法
1.2.1 实验分组 实验前对C57小鼠进行听性脑干反应(auditory brainstem response,ABR)检测,筛选听阈正常的小鼠作为实验对象。而后将小鼠随机分为4组,每组30只,分别给予不同强度的噪声暴露:105 dB 2 h,110 dB 2 h,110 dB 4 h,115 dB 4 h。将噪声暴露前的小鼠作为对照组,根据噪声暴露后不同时间点每组又分为4个亚组,即噪声暴露后1 d组(NE-1 d)、噪声暴露后7 d组(NE-7 d)、噪声暴露后14 d组(NE-14 d)、噪声暴露后28 d组(NE-28 d)。
1.2.2 噪声暴露 将采集的我国航空兵部队某型军用直升机噪声作为实验噪声,将实验组小鼠置于鼠笼中,音箱位于鼠笼两侧,噪声暴露前用声级计测试噪声强度,确保每只小鼠活动范围内声压级相差<3 dB。实验组小鼠接受相应强度的噪声刺激;对照组小鼠除不给予噪声刺激,其他条件与实验组相同。
1.2.3 ABR测试 采用10 g/L戊巴比妥钠(0.3 mL/100 g)联合10 mL/L速眠新Ⅱ(0.04 mL)腹腔注射小鼠进行麻醉,麻醉后清除双耳耵聍。测试时将记录电极插于小鼠颅顶正中双耳连线中点皮下,参考电极插于双耳耳后皮下,接地电极插于尾部正中。
实验采用短声(click)和短纯音作为刺激声,刺激频率为21次/s,滤波带宽300~3 000 Hz,持续时间10 ms,叠加1 024次。短纯音选取频率点为1、2、4、8 kHz,刺激声强度从80 dB SPL开始,以10 dB SPL为间隔递减,直至辨认不出Ⅲ波后,再向上检测5 dB SPL,可辨认出Ⅲ波的最低刺激声强即为小鼠的听力阈值。同时于click 80 dB SPL条件下记录Ⅰ波波幅及Ⅰ波潜伏期。
1.2.4 耳蜗样本取材 小鼠以颈椎脱臼法处死,断头,剪开颅骨,去除脑组织,取出耳蜗。将小鼠耳蜗置于盛有40 g/L多聚甲醛溶液的培养皿中,在体视显微镜下修剪去除多余骨质和组织,去除镫骨,开放卵圆窗。用注射器针头在蜗顶打孔,将多聚甲醛溶液分别从蜗顶小孔和卵圆窗灌注入耳蜗,反复灌注3次。将灌注后的耳蜗放入盛有40 g/L多聚甲醛溶液的EP管内,于4 ℃冰箱固定过夜。
将固定好的耳蜗放入100 g/L的EDTA中脱钙3 d,每日更换新的EDTA溶液。将脱好钙的耳蜗转移到1×PBS溶液中,在体视显微镜下去除周围骨质、前庭膜和盖膜,由蜗顶至蜗底分离并取下完整的耳蜗基底膜,修剪掉多余的组织后,切分为底回、二回、三回、顶回,置于96孔板内用于后续实验。
1.2.5 免疫荧光染色 取出分离好的耳蜗基底膜,加入适量的10 mL/L Triton X-100打孔1 h,而后用1×PBS缓冲液漂洗3次,每次10 min。使用即用型山羊血清室温封闭1 h后,向样本中加入兔抗CtBP2抗体(ab128871,Abcam,英国),并于4 ℃冰箱孵育24 h,1×PBS缓冲液漂洗3次,每次10 min。向每个孔内加入适量的山羊抗兔二抗(cy3,SA00009-2,Proteintech,美国),室温下避光孵育2 h,1×PBS缓冲液漂洗3次,每次10 min,使用移液管将基底膜移至载玻片上。在体视显微镜下区分正反后,正面朝上,滤纸吸干多余水分,滴上适量含DAPI的抗荧光淬灭封片液,盖上盖玻片。将封好的玻片置于黑盒内,于4 ℃冰箱内暂存。
1.2.6 共聚焦和带状突触计数 使用共聚焦显微镜对耳蜗基底膜铺片进行观察,选用的放大倍数为63倍的油镜,激发光波长分别为405 nm和561 nm。从底回、二回、三回、顶回的每回基底膜选取1个视野进行观察并拍照,对视野内CtBP2抗体特异性标记的带状突触进行计数,每个耳蜗内毛细胞的带状突触平均数=视野内带状突触数量/内毛细胞数量。

2 结果
2.1 噪声暴露前后ABR阈值变化
click处的ABR结果显示,与对照组相比,105 dB 2 h军用直升机噪声暴露1 d后测得小鼠听阈升高,但随时间推移有所恢复,噪声刺激前与刺激后各时间点听阈变化差异无统计学意义;110 dB 2 h噪声暴露1、7 d后测得小鼠听阈明显升高(P<0.01,P<0.05),但随时间推移逐渐恢复,至噪声暴露后28 d可恢复至暴露前水平;110 dB 4 h和115 dB 4 h噪声暴露1、7、14 d后测得小鼠听阈出现明显升高(P<0.01),暴露后28 d后差异仍具有统计学意义(P<0.05,图1)。

NE-1 d:噪声暴露后1 d组;NE-7 d:噪声暴露后7 d组;NE-14 d:噪声暴露后14 d组;NE-28 d:噪声暴露后28 d组。n=12。aP<0.05,bP<0.01vs对照组。
图1 噪声刺激前后各组小鼠click处ABR阈值变化
1 kHz处ABR结果显示,在4种噪声暴露条件下,暴露后1 d小鼠该频段听阈均明显升高(P<0.01),110 dB 2 h噪声后14 d可恢复至暴露前水平,105 dB 2 h和110 dB 4 h噪声后28 d可恢复至暴露前水平,而115 dB 4 h噪声后28 d仍不能恢复至暴露前水平(P<0.05,图2A)。2 kHz处ABR结果显示,105 dB 2 h、110 dB 4 h和115 dB 4 h噪声后1 d小鼠该频段听阈均明显升高(P<0.01),105 dB 2 h噪声后14 d、110 dB 4 h噪声后28 d可恢复至暴露前水平,而115 dB 4 h噪声后28 d仍不能恢复至暴露前水平(P<0.05);110 dB 2 h噪声后1 d小鼠该频段听阈有升高,但与暴露前听阈无统计学差异(图2B)。4 kHz处ABR结果显示,105 dB 2 h噪声后小鼠该频段听阈与噪声前无统计学差异;110 dB 2 h、110 dB 4 h和115 dB 4 h噪声后1 d小鼠该频段听阈均明显升高(P<0.01),110 dB 2 h噪声后14 d、110 dB 4 h噪声后28 d可恢复至暴露前水平,而115 dB 4 h噪声后28 d仍不能恢复至暴露前水平(P<0.05,图2C)。8 kHz处ABR结果显示,105 dB 2 h噪声后1 d小鼠该频段听阈明显升高(P<0.05),噪声暴露后7 d即可恢复至暴露前水平;110 dB 2 h、110 dB 4 h和115 dB 4 h噪声后1 d小鼠该频段听阈均明显升高(P<0.01),110 dB 2 h噪声后14 d、110 dB 4 h噪声后28 d可恢复至暴露前水平,而115 dB 4 h噪声后28 d仍不能恢复至暴露前水平(P<0.05,图2D)。
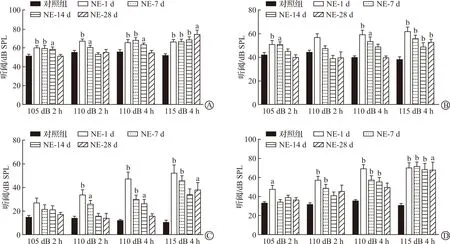
A:噪声刺激前后各组小鼠1 kHz处ABR阈值变化;B:噪声刺激前后各组小鼠2 kHz处ABR阈值变化;C:噪声刺激前后各组小鼠4 kHz处ABR阈值变化;D:噪声刺激前后各组小鼠8 kHz处ABR阈值变化。NE-1 d:噪声暴露后1 d组;NE-7 d:噪声暴露后7 d组;NE-14 d:噪声暴露后14 d组;NE-28 d:噪声暴露后28 d组。n=12。 aP<0.05,bP<0.01 vs 对照组。
2.2 Ⅰ波波幅变化
各组噪声暴露前后,click 80 dB SPL处Ⅰ波波幅变化情况见图3。105 dB SPL军用直升机噪声暴露2 h,1 d后小鼠ABR Ⅰ波波幅明显降低(P<0.05),但在噪声后28 d恢复至暴露前水平;110 dB 2 h、110 dB 4 h、115 dB 4 h组在噪声暴露1 d后ABR Ⅰ波波幅明显降低(P<0.01),且至噪声后28 d仍无法恢复至暴露前水平(P<0.05)。

NE-1 d:噪声暴露后1 d组;NE-7 d:噪声暴露后7 d组;NE-14 d:噪声暴露后14 d组;NE-28 d:噪声暴露后28 d组。ABR:听性脑干反应。n=12。 aP<0.05,bP<0.01 vs 对照组。
2.3 Ⅰ波潜伏期变化
各组噪声暴露前后click 80 dB SPL处Ⅰ波潜伏期变化情况见图4。105 dB SPL军事航空噪声暴露2 h,噪声后1 d小鼠ABRⅠ波潜伏期延长,但变化幅度较小,差异无统计学意义,而后听阈随时间推移有所恢复;110 dB 2 h和110 dB 4 h噪声暴露1 d后小鼠ABR Ⅰ波潜伏期延长(P<0.05),至噪声后28 d可恢复至暴露前水平;115 dB 4 h噪声暴露后ABR Ⅰ波潜伏期同样表现为先延长后恢复,但仅在噪声暴露后7 d潜伏期与暴露前相比差异有统计学意义(P<0.01)。

NE-1 d:噪声暴露后1 d组;NE-7 d:噪声暴露后7 d组;NE-14 d:噪声暴露后14 d组;NE-28 d:噪声暴露后28 d组。ABR:听性脑干反应。n=12。 aP<0.05,bP<0.01 vs 对照组。
2.4 带状突触计数
ABR检测结果显示,110 dB 2 h噪声暴露后,小鼠的听功能变化最符合HHL的听力学表型。因此本研究进一步使用DAPI染料标记毛细胞核排列情况,使用荧光特异性标记螺旋神经节与内毛细胞间的突触前膜蛋白CtBP2对带状突触进行计数,以从形态学角度验证该模型的有效性。带状突触数量在噪声暴露后1 d明显降低,而后随着时间的推移有所恢复(图5)。

NE-1 d:噪声暴露后1 d组;NE-7 d:噪声暴露后7 d组;NE-14 d:噪声暴露后14 d组;NE-28 d:噪声暴露后28 d组。
经过统计分析发现,整个耳蜗的带状突触密度明显下降,但不同位置的带状突触密度下降程度不同(图6)。

NE-1 d:噪声暴露后1 d组;NE-7 d:噪声暴露后7 d组;NE-14 d:噪声暴露后14 d组;NE-28 d:噪声暴露后28 d组。n=6。 aP<0.05,bP<0.01 vs 对照组。
底回带状突触密度在噪声暴露前为(15.03±0.70)个,暴露后1 d降至(9.62±0.62)个,差异具有统计学意义(P<0.01),至噪声后28 d仍无法恢复至暴露前水平(P<0.01);二回带状突触密度由噪声暴露前的(19.66±1.05)个降至暴露后1 d的(9.09±0.99)个,差异显著(P<0.01),且至噪声后28 d仍无法恢复至暴露前水平(P<0.01);三回带状突触密度噪声暴露前为(16.65±0.95)个,暴露后1 d降至(6.95±0.41)个,下降显著(P<0.01),至噪声后28 d仍无法恢复至暴露前水平(P<0.01);顶回带状突触密度噪声暴露前为(11.77±0.69)个,暴露后1 d降至(7.47±0.48)个,下降显著(P<0.01),且至噪声暴露后28 d仍无法恢复至暴露前水平(P<0.05)。统计分析结果显示,噪声暴露后耳蜗的带状突触密度明显下降,且随时间推移均无法恢复至暴露前水平,但位置不同下降幅度有所差异。
3 讨论
近年来,随着新型武器装备的发展,军事噪声所致听力损失的发病率大幅升高,军人由于其职业特殊性,常需长期暴露在不同类型军用装备产生的噪声环境中,极易导致不同程度的听力损失[11]。HHL作为近年来的研究热点,其病理基础主要是带状突触受损和毛细胞功能异常,但确切的发病机制仍不清楚[12]。与以往研究较多的噪声性耳聋不同,HHL主观检查上不存在听力障碍,但这种听力的隐匿性损害可以在耳蜗中积累,一方面导致其对耳毒性药物、老龄化等耳损伤因素易感性增加,另一方面其可表现为言语分辨率差、耳鸣和听觉敏感等,对生活和工作造成显著影响[13]。
ABR是通过头皮电极记录的从内耳耳蜗到大脑皮层听觉中枢不同平面对于瞬态声刺激信号的一系列短潜伏期听觉诱发反应。这些反应波通常在受刺激后10 ms内出现,其中Ⅰ波、Ⅲ波及Ⅴ波最易辨别,且出现率较高,以往文献中多用Ⅲ波出现的最小噪声刺激强度作为小鼠的听阈[14]。本研究分别检测并比较各组噪声暴露前后click,1、2、4、8 kHz处ABR阈值,同时记录click 80 dB SPL处ABR Ⅰ波波幅和Ⅰ波潜伏期。结果显示,各噪声暴露条件后小鼠均表现为ABR Ⅰ波波幅降低和Ⅰ波潜伏期延长,但click处听阈变化各不相同。105 dB 2 h军用直升机噪声暴露后C57小鼠听阈无显著性阈移;110 dB 4 h和115 dB 4 h军用直升机噪声暴露后小鼠听阈发生永久性阈移;而110 dB 2 h噪声暴露后C57小鼠听阈则发生暂时性阈移,符合HHL的听阈变化特征。而由于小鼠在不同频率下的听阈特点不同,虽然1、2、4、8 kHz处的小鼠噪声后听阈变化趋势与click处相同,但噪声对小鼠听阈中高频段影响更显著,且较低频段处(1、2 kHz)数据易受干扰,波动较大,导致部分结果无统计学意义。在此后研究中将尽量排除ABR测试时环境的干扰因素,同时增大样本数量,以明确较低频处小鼠听阈的差异和变化情况。
耳蜗带状突触是耳蜗内毛细胞与Ⅰ型听神经纤维末梢间的突触连接,负责声音信号向中枢的高效传输。研究表明,噪声暴露后耳蜗带状突触的病变包括数量减少、形态异常、位置改变等[15]。本研究通过比较噪声暴露前后耳蜗带状突触密度的改变,验证110 dB 2 h军事航空噪声暴露建立军事航空噪声性HHL C57小鼠模型的有效性。结果表明,110 dB 2 h军用直升机噪声暴露后,耳蜗基底膜不同部位的带状突触密度均出现明显下降,但处于不同位置的带状突触数量下降幅度有所差异,符合HHL的内耳形态学变化特征。由此我们认为,110 dB SPL军用直升机噪声暴露2 h可作为军事航空噪声性HHL C57小鼠模型的理想建模参数。
本研究通过比较多种噪声暴露条件后C57小鼠听功能和内耳形态学的变化特征,确定了C57小鼠军事航空噪声性HHL模型的理想刺激条件,成功构建了军事航空噪声性HHL C57小鼠模型,为今后进一步开展军事航空噪声性HHL的致病机制和防护措施的相关研究奠定了基础。

