间充质干细胞衍生的细胞外囊泡在调控心肌缺血再灌注损伤中的研究进展*
谭景锐, 江永鑫, 王诗源△
(1山东中医药大学,山东 济南 250000;2江高镇卫生院,广东 广州 510080)
缺血性心肌病是我国致死率最高的疾病,且随着人民生活水平的改善其的发病率仍在不断攀升[1]。以经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)和冠状动脉旁路移植术为代表的血运重建策略是挽救缺血性心肌病患者生命、改善患者远期生存质量的有效手段,特别是随着技术的进步和设备的革新,PCI手术的适用范围不断扩大,已经成为最主要的血运重建手段,显著降低了急性心肌梗死(acute myocardial infarction, AMI)患者的住院死亡率[2-3]。然而,值得注意的是再灌注策略带来的缺血/再灌注(ischemia/reperfusion, I/R)损伤也逐渐被研究人员重视,国际上已经把该类情况定义为手术相关性心肌梗死或手术相关性心肌损伤,并指出该类损伤与患者的远期预后关系密切[4]。因此对于I/R 损伤的治疗成为了改善血运重建术后患者远期预后的有效靶点。
细胞外囊泡(extracellular vehicles, EVs)衍生于神经酰胺和/或转运所需的内体分类复合体依赖性途径,在经历多囊泡体融合后,绝大多数的细胞以胞吐的方式将EVs 分泌至各组织微环境或体液(血液、脑脊液、唾液等)中[5-6]。随后EVs主要通过与细胞膜融合、内吞、配体-受体相互作用等途径被受体细胞内化,将其负载的蛋白、核酸、代谢物等物质暴露于受体细胞的胞质中,其中一些小分子发挥了细胞间信息传递因子的作用[7-9]。
间充质干细胞(mesenchymal stem cells, MSCs)具有相对易获得、高纯度、多谱系分化和强大的增殖能力等特点,通过移植MSCs或其衍生物已经被作为一种潜在的抗I/R 损伤策略被广泛研究[10-11]。MSCs包括多种多功能干细胞,广泛存在于脂肪、脐带和骨髓等多种组织中,传统观点认为其主要功能是向成骨细胞、软骨细胞和脂肪细胞等细胞分化,然而越来越多的研究表明MSCs 还通过直接相互作用和旁分泌(直接分泌、产生EVs 等)的形式参与了多种病理生理过程[12-15]。其中EVs 具有低免疫原性和易穿透性等特点,因此当前MSCs 衍生的EVs(MSC-EVs)及其携带物在心肌I/R 发生过程中对损伤心肌的调控作用也成为了研究的焦点[16]。
同时,以中草药为代表的天然药物在治疗I/R 损伤引起的心血管疾病方面具有独特的优势,且既往已展现了较好的临床疗效[17-18]。利用天然药物及其有效成分预处理获得的MSC-EVs 治疗心肌I/R 损伤已经成为一种提高MSC-EVs疗效的可行策略。本文将围绕MSC-EVs 在减轻心肌I/R 损伤中的作用以及天然药物预处理的MSC-EVs 在干预心肌I/R 损伤中的研究进展进行综述,为进一步的干细胞和天然药物减轻心肌I/R损伤的研究提供一定的借鉴。
1 MSC-EVs 在心肌/I/R 中对多种病理途径的调控作用
1.1 MSC-EVs 调控细胞凋亡对心肌I/R 损伤的影响 凋亡作为一种最经典的细胞程序性死亡是组织响应缺血或氧化等刺激时发生细胞丢失的主要死亡形式[19]。在凋亡的过程中蛋白激酶B(protein kinase B, PKB/AKT)/核因子κB(nuclear factor-κB, NF-κB)信号通路及其下游的经典凋亡途径Bcl-2/Bax/caspase-3 信号轴发挥了主要的调控作用[20-21]。有研究显示,脂肪组织来源干细胞(adipose-derived stem cells, ADSCs)的EVs(ADSC-EVs)能够缓解I/R 诱导的小鼠心功能降低,抑制心肌细胞凋亡和细胞肥大[22]。虽然细胞肥大被认为是心肌细胞丢失后存活细胞适应收缩期室壁张力的代偿性反应,然而肥大的心肌细胞也是室壁运动异常、顺应性差并最终导致心力衰竭的重要原因[23]。机制研究表明,ADSCEVs 中的miR-221/222 能够通过调控AKT/NF-κB 信号通路抑制I/R 条件下的心肌细胞凋亡,同时萤光素酶报告基因实验结果显示,P53 上调凋亡调节因子(p53-up-regulated modulator of apoptosis, PUMA)和ETS 原 癌 基 因1(ETS proto-oncogene 1, ETS-1)是miR-221/222 直接靶点,miR-221/222 通过抑制PUMA和ETS-1 也参与了心肌细胞凋亡和细胞肥大的抑制。因此逆转心肌细胞凋亡和细胞肥大成为了减轻心肌I/R 损伤的有效协同策略。Sun 等[24]的研究显示,骨髓MSCs(bone marrow MSCs, BMSCs)的EVs(BMSC-EVs)也通过调控Bcl-2/Bax/caspase-3 凋亡途径抑制了缺氧/复氧(hypoxia/reoxygenation, H/R)条件下心肌细胞(模拟体内心肌I/R 环境)的凋亡。体内和体外研究均提示BMSC-EVs 对心肌细胞的保护作用依赖于miR-486-5p,而磷酸酶及张力蛋白同源物(phosphatase and tensin homolog, PTEN)是miR-486-5p 的直接作用靶点。研究认为BMSC-EVs 通过miR-486-5p抑制心肌细胞的PTEN 表达,从而激活磷脂 酰 肌 醇3- 激 酶(phosphatidylinositol 3-kinase,PI3K)/AKT信号通路及其下游Bcl-2/Bax/caspase-3通路抑制凋亡过程。因此,利用MSC-EVs 对心肌细胞凋亡的调控有望成为心肌I/R损伤的治疗策略。
1.2 MSC-EVs 调控细胞焦亡对心肌I/R 损伤的影响 核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)炎症小体/caspase-1/消皮素D(gasdermin D, GSDMD)是细胞焦亡的经典途径。NLRP3 炎症小体由NLRP3、含caspase 募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain, ASC)和caspase-1 组成,该途径在I/R 条件下激活,焦亡执行蛋白GSDMD能够被NLRP3炎症小体中的活化caspase-1 切割裂解,GSDMD 切割后的N 端(GSDMD-N)可组合嵌入细胞膜中诱导心肌细胞肿胀、膜破裂、炎症因子释放,进而发生细胞炎性死亡[25]。而越来越多的研究表明MSC 来源的EVs能够通过抑制细胞焦亡改善多组织的再灌注损伤[26]。Yue 等[14]的研究显示,GSDMD基因是miR-182-5p 的直接作用靶标,BMSCs依赖于EVs 中的miR-182-5p 抑制心肌细胞GSDMD表达而发挥保护心肌细胞的作用,随后研究人员使用MSC-EVs 干预H/R 的心肌细胞或尾静脉注射MSC-EVs入I/R小鼠体内,研究MSC-EVs对心肌细胞再灌注损伤的作用,结果表明MSC-EVs 能够通过miR-182-5p 下调GSDMD 的表达抑制I/R 诱导的心肌细胞焦亡从而减轻心肌再灌注损伤,同时该研究显示miR-182-5p 抑制了炎症小体相关蛋白ASC 和caspase-1 的表达但对NLRP3 的表达没有影响,这表明BMSC-EVs 中的miR-182-5p 通过调 控NLRP3 的结合蛋白而抑制NLRP3 炎症小体,从而发挥抑制心肌细胞焦亡的作用。此外,也有研究表明,BMSC-EVs 能通过miRNA 直接调控NLRP3 的表达从而影响焦亡过程。Tang 等[27]报告了BMSC-EVs 能够依赖于miR-320b 而抑制H/R 诱导的大鼠心肌细胞焦亡过程,NLRP3基 因 是miR-320b 的 直 接 靶 点,BMSC-EVs 通过miR-320b 直接抑制了H/R 条件下心肌细胞的NLRP3/caspase-1 途径,减轻了心肌细胞焦亡和再灌注损伤。这些研究表明,BMSC-EVs 对I/R 状态下心肌细胞焦亡过程的调节具有多成分、多靶点的特点。
1.3 MSC-EVs 调控细胞铁死亡对心肌I/R 损伤的影响 铁死亡是一种依赖于铁离子的氧化性细胞死亡形式,其在细胞死亡具体途径中不同于坏死、凋亡和自噬[28]。铁死亡发生时细胞内的谷胱甘肽依赖性抗氧化系统被破坏(如谷胱甘肽过氧化物酶4 下调),脂酰CoA 合成酶4 等脂质活化酶上调导致脂质活性氧的堆积,从而诱导细胞氧化性死亡[29]。同时,以氧化应激为主要病理机制之一的心肌I/R 损伤也存在着铁死亡的参与[30]。Zhang 等[31]使用BMSC-EVs 能够将lncRNA miR9-3 宿主基因(miR9-3 host gene,miR9-3hg)递送给H/R 条件下的小鼠心肌细胞并抑制铁死亡过程,miR9-3hg 通过靶向结合Pumilio RNA结合家族成员2(Pumilio RNA binding family member 2, PUM2),抑制其表达;过氧化物氧还酶6(peroxiredoxin 6, PRDX6)被证实是保护细胞免于铁死亡的重要蛋白之一,蛋白免疫共沉淀实验显示PUM2 与PRDX6 蛋白之间存在相互作用;而在使用BMSCEVs 抑制心肌细胞的PUM2 后PRDX6 的表达量升高,可见BMSC-EVs 通过miR9-3hg 靶向调控心肌细胞的PUM2/PRDX6 信号通路抑制H/R 诱导的心肌细胞铁死亡,从而减轻再灌注损伤[32]。Song 等[33]报道了二价金属转运体1(divalent metal transporter 1,DMT1)在I/R 小鼠心肌中显著上调并且DMT1 的过表达促进了心肌细胞的铁死亡过程;萤光素酶报告基因实验提示DMT1 是miR-23a-3p 的直接靶点;人脐带MSCs(human umbilical MSCs, hUMSCs)的EVs(hUMSC-EVs)干预H/R 心肌细胞能够显著抑制心肌细胞DMT1 的表达并抑制铁死亡过程,机制研究提示hUMSC-EVs 携带的miR-23a-3p 抑制了心肌细胞DMT1,下调了细胞铁死亡,进而减轻H/R损伤。
1.4 MSC-EVs 调控细胞自噬对心肌I/R 损伤的影响 自噬是一个高度保守的细胞内程序,其主要有3种形式(巨自噬、微自噬和分子伴侣介导的自噬),其中以巨自噬在疾病中的作用被研究得最为广泛和深入[34]。细胞能够通过自噬将细胞质中老化和损伤的成分(蛋白、脂质、受损细胞器等)回收降解,因此在一定范围内自噬主要作为一种细胞存活机制,然而它也会在一些无法代偿的致命性刺激下促进细胞的死亡,被称为自噬细胞死亡[35-37]。而自噬的动态平衡对于缺血性心肌病中心肌细胞的最终走向也至关重要。BMSCs与H9C2心肌细胞共培养能够抑制H/R诱导的心肌细胞凋亡和自噬活性;进一步的研究提示miR-143-3p 在BMSC-EVs 中高表达,BMSC-EVs 能够通过miR-143-3p 靶向抑制心肌细胞检查点激酶2(checkpoint kinase 2, CHK2)的表达,CHK2 与自噬效应蛋白beclin-1 形成的CHK2/beclin-1 信号通路在促进自噬中发挥重要作用,因此miR-143-3p 对CHK2/beclin-1 通路的抑制保护心肌细胞免于再灌注下过度自噬导致的损伤[38-39]。在抗I/R 损伤的研究中,除了保护心肌细胞以改善心功能外,通过改善心脏微血管内皮细胞(cardiac microvascular endothelial cells,CMECs)以维持对缺血区域的供血也是治疗I/R 的重要策略[40]。Diao等[41]的研究表明,hUMSC-EVs能够通过lncRNA UCA1 (urothelial cancer associated 1)竞争性与CMECs的miR-143结合,从而上调由miR-143抑制的Bcl-2/beclin-1 信号轴,因此抑制了CMECs 的凋亡和自噬过程,并增强细胞活力。这体现了MSCEVs能够通过多途径对心脏微环境中的多种细胞产生保护作用,在I/R的防治中具有较高的应用潜力。
1.5 MSC-EVs 调控巨噬细胞M1/M2 极化对心肌I/R损伤的影响 越来越多的研究表明,I/R 损伤伴随着心脏微环境中的炎症级联反应,其中巨噬细胞在调控心脏微环境的炎症中发挥重要的作用[42]。在损伤早期巨噬细胞主要以促炎表型的M1为主,发挥去除细胞碎片的作用,而后巨噬细胞逐渐向抗炎表型M2极化,M2 在分泌抗炎性因子的同时还分泌诸多生长因子参与了伤口的愈合和瘢痕组织的形成过程[43-44]。Zhao等[45]观察到,心肌注射BMSC-EVs除了显著改善I/R 小鼠心功能、减少心肌梗死面积外,还显著抑制了心肌组织的炎性浸润,同时心肌组织和血清的促炎因子白细胞介素6 的水平降低而抑炎因子白细胞介素10 水平升高。进一步的研究表明,BMSC-EVs能够被巨噬细胞内化并依赖于miR-182 促进巨噬细胞的M2 极化,其具体机制为BMSC-EVs 中的miR-182能够直接作用于Toll样受体4的转录本而抑制其表达,进而下调了髓样分化因子88/NF-κB 信号通路并上调PI3K/AKT 信号通路从而促进巨噬细胞M2 极化,最终发挥调控I/R 条件下心肌组织炎症平衡、减轻再灌注损伤的作用。此外,Shen等[46]发现,心肌注射BMSC-EVs能够通过调控巨噬细胞的M2极化改善I/R 模型小鼠心功能,而抑制BMSCs 的miR-21-5p 表达后这种功效被抑制,提示BMSC-EVs调控心肌中巨噬细胞的M1/M2 平衡也与miR-21-5p 密切相关。这些研究表明,MSC-EVs 对巨噬细胞M1/M2 平衡的调控依赖于多种EVs 成分的协调作用,而这种动态平衡影响了心肌I/R损伤的程度,因此利用MSC-EVs调控巨噬细胞从而减轻I/R损伤需要更全面的视角。
MSC-EVs 调控多种病理途径以减轻心肌I/R 损伤的总结见图1。
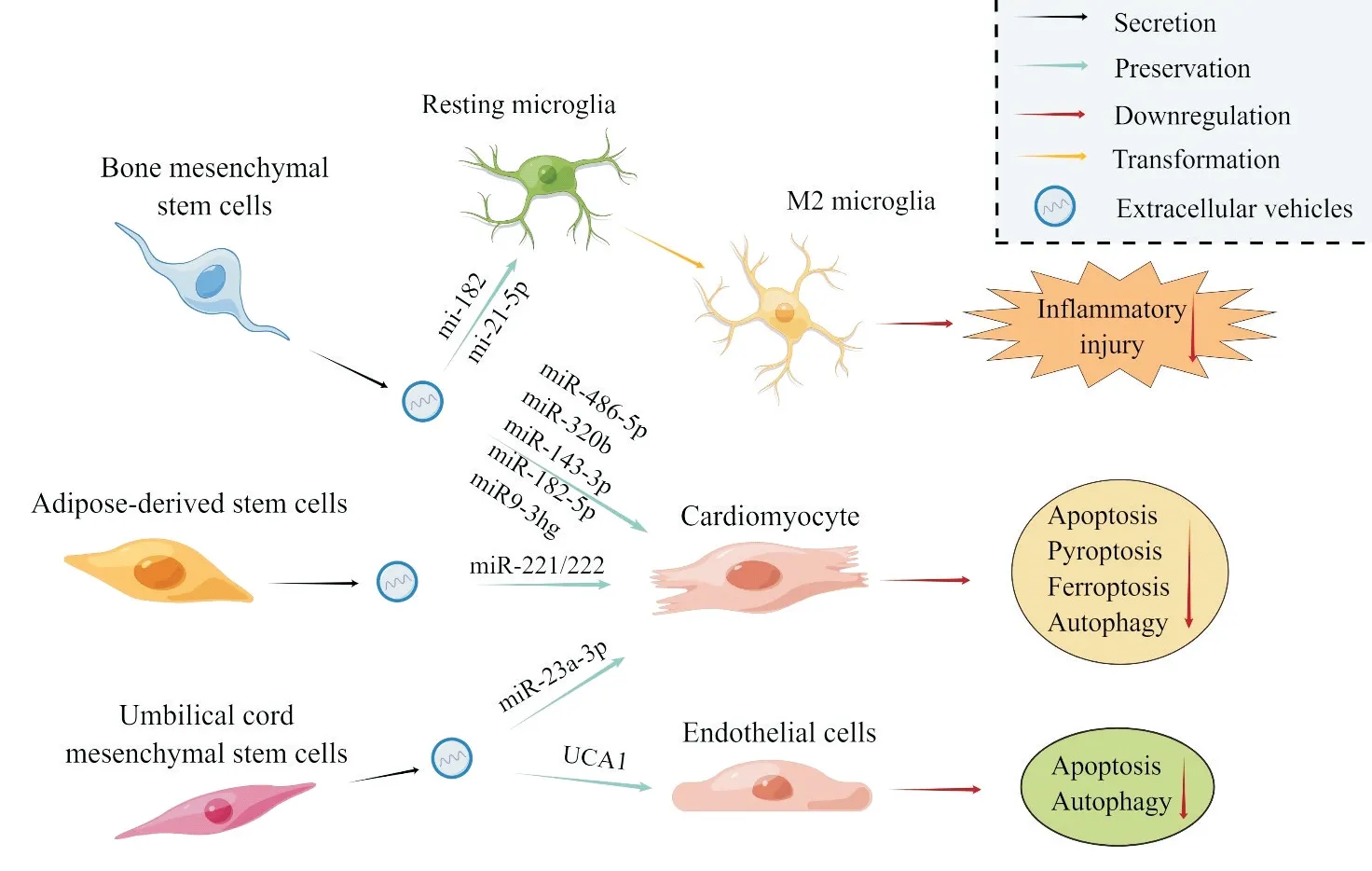
Figure 1. Mesenchymal stem cell-derived extracellular vehicles attenuate myocardial I/R injury by regulating multiple pathological pathways.图1 间充质干细胞外囊泡通过调控多种病理途径减轻心肌I/R损伤
2 天然药物干预MSC-EVs对心肌I/R损伤的调控
虽然天然药物直接应用于治疗疾病的疗效已经有诸多循证依据,但部分成分口服利用度差、细胞摄取率低、活性成分不稳定等问题,限制了天然药物制剂的标准化应用和研究[47-48]。然而,通过天然药物及其有效成分干预MSC 获得的富含天然药物成分的EVs不仅可利用EVs的特点有效解决上述问题,并且具有促进MSC-EVs的分泌、提高对心肌I/R损伤的疗效等多种优势。Deng 等[49]报道,与BMSCs 共培养能够提高H/R条件下心肌细胞活力并抑制细胞焦亡,经鸢尾素(irisin)预处理的BMSCs(irisin-BMSCs)对细胞活力的保护作用更加明显,而使用EVs分泌抑制剂后irisin-BMSCs保护心肌细胞的能力显著降低,表明irisin-BMSCs是通过EVs提高心肌细胞的抗细胞焦亡和氧化应激能力。随后以分离irisin-BMSCs所得的EVs(irisin-BMSC-EVs)干预H/R 条件下的心肌细胞证实了这一结论,同时机制研究显示irisin-BMSC-EVs 通过抑制NLRP3炎症小体途径发挥调控心肌细胞焦亡和氧化应激的作用。另外,Fu 等[50]报道,BMSC-EVs接受冬凌草素预处理后其保护心脏的效果尤为明显,机制研究显示BMSC-EVs能够上调I/R模型大鼠心肌或H/R 条件下H9C2 心肌细胞自噬相关蛋白(beclin-1、ATG13等)表达,下调凋亡相关蛋白(Apaf1、Bax等)表达,从而抑制心肌细胞凋亡。而冬凌草素预处理能够加强BMSC-EVs对I/R条件下上调心肌细胞自噬和下调细胞凋亡的作用,从而减轻了心肌再灌注损伤。
3 结语
随着研究的不断深入,MSCs及其EVs在心肌I/R损伤中的重要作用被不断发现。而与依赖于MSCs的归巢能力不同,MSCs 衍生的EVs 具有直接携带有效成分参与病变组织调控的优势。此外,天然药物的干预具有促进EVs分泌、提高MSC-EVs中治疗成分多样性和负载量等优势。在本综述中,MSC-EVs通过调控多种细胞的多种生物途径对I/R损伤的心肌产生保护作用,并且天然药物的干预能够提高MSC-EVs 对于心肌I/R 损伤的疗效。然而,BMSC-EVs 和天然药物活性成分对心肌I/R 损伤的调控仍然是一个多途径、多靶点的过程,当前研究仍缺乏全面的了解并且尚未应用于临床,因此需更多研究人员进行更多的临床前研究,发掘BMSC-EVs和其天然药物干预衍生物更大的临床价值,丰富临床中防治心肌I/R损伤的策略。

