光照强度对原位藻细胞组分生长及生物柴油性能的影响
谢 月,陈志鹏,葛士建,阳 成,邱 爽
(南京理工大学 环境与生物工程学院,江苏 南京 210094)
日益增长的能源需求和日趋严峻的全球变暖是现代社会面临的两大挑战。微藻光合效率高且能将污水中氮、磷等元素作为营养物质转化为蛋白质、多糖、色素等生物质,因而受到广泛关注[1]。此外,微藻相对于农田作物,对栽培空间要求低且有较高的脂质含量。生物柴油是一种可再生且可生物降解的燃料,它排放更少的二氧化碳且不含硫和芳烃,具有环境可持续性和生态友好性等优点。研究表明,藻类生物柴油的生产能力是大豆和油菜等油料作物的40倍[2],因而微藻生物柴油被认为是传统化石燃料的替代品之一。因此在污水中培养微藻具有实现污水处理和生物质生产双重目标的可行性。然而,目前微藻培养成本较高(水源和氮磷等营养物质通常占总成本的10%~30%)[3],限制了其大规模生产及市场应用。微藻生长受环境因素影响较大,包括光强、温度、pH和二氧化碳浓度等[4,5]。其中,光强是影响微藻生长的关键因素之一。微藻细胞进行光合作用,为碳固定提供能量,这一过程中二氧化碳被转化为碳水化合物和蛋白质并释放氧气。光强对微藻细胞的影响主要分为光限制、光饱和、光抑制3个阶段。在光限制阶段,藻细胞生长速率随光强增强而提高;光饱和阶段藻细胞生长速率则趋于稳定;然而,过度光照则会导致微藻光合器官发生光氧化损伤、藻细胞生长速率下降,即为光抑制阶段。
有文献报道,微藻对光强变化的响应表现在多个方面,例如调控叶绿素循环、改变类胡萝卜素含量或暗呼吸速率等生理适应以及改变细胞密度、体积及类囊体膜数量等形态适应,从而导致藻类细胞代谢效率/途径的转变,最终产生生物量及胞内组分(色素、蛋白质、脂肪酸等)的变化[5,6]。例如,有研究表明[7],当光强从120 μmol/(m2·s)增加至280 μmol/(m2·s)时,Chlorellavulgaris生物量浓度下降了56%。与此相反,Chlorellasp.在400 μmol/(m2·s)光强下达到51.36 mg/(L·d)中性脂质的生产力,是40 μmol/(m2·s)光强下的3.34倍[8]。由此可见,这些研究:(1)基于特定微藻对光强的生理响应,缺乏可比性和参照性;(2)大多采用商业藻种及人工配置的营养液,然而商业藻种在复杂污水水质中活性较低,而从污水中富集的原位藻具有有效适应系统环境的潜力,近年来对于原位藻污水处理的研究多有报道。然而,这些研究多集中于如何从污水中分离原位藻、原位藻处理污水的可行性以及如何提高原位藻污水处理效率等方面[9-12],光强对原位藻的影响则并不明确。因为光能是微藻生长的唯一能量来源,所以微藻反应器中的光强分布对原位藻的生长速率和产量有着巨大的影响。因此,对基于污水水质培养的原位藻对光强生理响应的系统研究很有必要。课题组前期研究已证实700 μmol/(m2·s)光强下小球藻自絮凝效率是54 μmol/(m2·s)下的4.3倍[13],然而在光强对原位藻生长、光合活性及细胞组分和基于细胞组分对生物柴油性能的影响等方面则缺乏系统研究。此外,前人对50~800 μmol/(m2·s)范围内光强对微藻生长及细胞组分的影响多有研究[8,14-16],研究光强范围较小、光强值较低。且南京5月份正午水域环境光强可达到900~1 500 μmol/(m2·s),同时有文献报道,夏季光强在900 μmol/(m2·s)以上[17]。因此本文选取较高光强1 000 μmol/(m2·s),以探究高光强(尤其春夏季节白天)对原位藻的影响。
54 μmol/(m2·s)是大部分微藻光照培养箱的光照强度,适宜微藻的生长。在本文中与1 000 μmol/(m2·s)的光强形成对照。因此本研究以污水中分离出的原位小球藻为对象,选取54 μmol/(m2·s)和1 000 μmol/(m2·s) 2个光强,从微藻生长、光合活性、藻细胞胞内/外组分等角度,探究了微藻对光强的生理响应变化,并通过对原位藻生物柴油性能评价,推测光照条件对微藻生物燃料生产的调控作用。
1 试验材料与方法
1.1 污水原位藻的培养
所用藻种为本实验室从污水中分离的原位藻Chlorellasp. (GenBank:MN906179.1)。正式试验前,在模拟市政污水中培养Chlorellasp. 6个周期以上,每个周期约6天,以达到稳定的活性。以500 mL锥形瓶(300 mL工作体积)为光生物反应器,于冷光源植物培养箱(25 ℃,14 h光照:10 h黑暗,54 μmol/(m2·s))中进行原位藻培养。模拟市政污水及锥形瓶均灭菌(121 ℃,20 min)后使用。模拟市政污水配方如下:NaAc(230.77 mg/L)、NH4Cl(114.64 mg/L)、KH2PO4(21.95 mg/L)、微量元素[13](1 mL/L)。
1.2 光强影响试验
为研究不同光强对污水原位藻的生长及细胞组分的影响,在冷光源植物培养箱中,以相同型号光强板,设置低光强(Low light intensity,LI)组54 μmol/(m2·s)、高光强(High light intensity,HI)组1 000 μmol/(m2·s),以光强测定仪(HS1010A,中国)测定光照强度,其他培养条件同1.1。对1.1中培养至对数生长期的原位藻进行离心采收(5 000 r/min,10 min,25 ℃),用无菌水将藻泥清洗3次后接种至新鲜的模拟市政污水中,控制初始细胞密度在5×105个/mL。接种过程于超净台(SW-CJ-1FD,苏净集团苏州安泰空气技术有限公司,中国)中完成,且所用试验耗材及模拟市政污水均经灭菌处理,以避免细菌污染。
1.3 原位藻测定方法
1.3.1 原位藻生长与pH
本研究用光学显微镜(CX31,奥林巴斯,日本)以细胞计数法监测原位藻生长状况。以pH计(FiveEasy Plus,Metter Toledo,美国)测定藻液pH。
1.3.2 原位藻叶绿素
本研究以甲醇法提取原位藻细胞的叶绿素[18]。首先,取10 mL藻液离心,弃上清后将藻泥重新悬浮在等量体积(10 mL)的甲醇中,继而在黑暗条件下提取叶绿素(于烘箱45 ℃下恒温孵化24 h)。离心混合溶液后取上清液,采用分光光度法测定652 nm和665 nm处吸光度(Unico UV-2100分光光度计)。分别以式(1)和式(2)计算叶绿素a(Chlorophyll a)和叶绿素b(Chlorophyll b)的含量
Chlorophyll a:Chl-a(mg/L)=
16.72A665-9.16A652
(1)
Chlorophyll b:Chl-b(mg/L)=
34.09A652-15.28A665
(2)
式中:A652和A665分别为652nm和665 nm波长下的吸光度。
1.3.3 原位藻光合作用参数
光合作用参数用叶绿素荧光仪系统(Water PAM,Walz GmbH,德国)测定[13]。具体操作步骤为:取3 mL藻液暗适应15 min,继而将藻液充分混合,以软件(Wincontrol-3,Walz GmbH,德国)测得藻细胞光合系统II(Photosystem II,PSII)潜在的最大量子产量Fv/Fm和相对电子传输率rETR。
1.4 原位藻细胞组分测定方法
1.4.1 原位藻胞外聚合物
采用离心法提取原位藻的胞外聚合物(Extracellular polymer substances,EPS)。取10 mL藻液离心(8 000 r/min,10 min),上清液以0.45 μm滤膜过滤,滤液即为原位藻的EPS。EPS中的蛋白质以牛血清蛋白为标准品用二喹啉甲酸(Bicinchoninic acid,BCA)法测定,多糖用葡萄糖为标准品用苯酚-硫酸法测定[13]。
1.4.2 原位藻胞内组分
试验结束时以离心法对微藻采收,超纯水清洗藻泥3次后以液氮速冻而后用冻干机真空冻干48 h得到藻粉。准确称取10 mg藻粉,加入3 mL 2 mol/L NaOH,充分混匀1 min后于80 ℃水浴30 min,待冷却至室温后用超纯水定容至100 mL,离心后取上清用BCA法测定蛋白浓度,即为胞内蛋白含量。准确称取10 mg藻粉,加入20 mL HCl及20 mL超纯水,充分混匀1 min后沸水浴20 min,待冷却至室温后以超纯水定容至100 mL,离心后取上清用苯酚-硫酸法测定多糖浓度,即为胞内多糖含量[19]。
三酰甘油(主要组成成分为脂肪酸)是微藻胞内的主要储存油脂,因此本研究通过测定脂肪酸含量表征原位藻胞内油脂。采用一步甲酯化法对藻粉进行预处理[20],即称取20 mg藻粉至玻璃试管中,加入2 mL 2%硫酸-甲醇后混匀,而后于水浴中(80 ℃,2.5 h)完成甲酯化。冷却至室温后加入提取液(1 mL超纯水:3 mL正己烷),混匀后静置待溶液分两相,用胶头滴管取上层含甲酯化脂肪酸的有机相至新试管中。共提取3次,合并收集上层液体,即为脂肪酸甲酯混合溶液。将其用玻璃棉及无水硫酸钠脱水后氮气吹干,再加入2 mL正己烷以提取产物。用气相色谱(GC-2014,日本)进行脂肪酸甲酯测定[20]。通过对比混标(Supelco 37 Component FAME Mix,item No. 47885-U,Sigma-Aldrich)的保留时间进行定性,通过混标的标准曲线计算对应脂肪酸的含量。
1.5 原位藻生物柴油性能评价
以脂肪酸组分计算原位藻生物柴油性能,包括皂化值(Saponification value,SV)、碘值(Iodine value,IV)、十六烷值(Cetane number,CN)、平均不饱和度(Average unsaturation,AU)、运动粘度(Kinematic viscosity,KV)、比重(Specific gravity,SG)、浊点(Cloud point,CP)和高热值(High heating value,HHV),分别由式(3)~(10)计算得到[21]
SV=∑(560Ni/MWi)
(3)
IV=∑(254NiDi/MWi)
(4)
CN=(46.3+5458/SV)-0.225IV
(5)
AU=∑(DiNi)
(6)
KV=-0.6316AU+5.2065
(7)
SG=0.0055AU+0.8726
(8)
CP=-13.356AU+19.99
(9)
HHV=1.7601AU+38.534
(10)
式中:Ni、MWi和Di分别代表第i种脂肪酸成分的质量百分比、分子量和双键数。以美国ASTM D6751、欧盟EN 14214和中国GB/T 25199-2017标准评价生物柴油性能。
1.6 数据分析方法
采用软件GraphPad Prism 8进行数据统计分析,并用t检验判定组间是否存在显著性差异(p<0.05表示差异显著)。
2 结果与讨论
2.1 光强对原位藻生长的影响
2.1.1 细胞数及藻液pH变化
图1是原位藻6天内在低光强和高光强下细胞数及藻液pH的变化曲线。
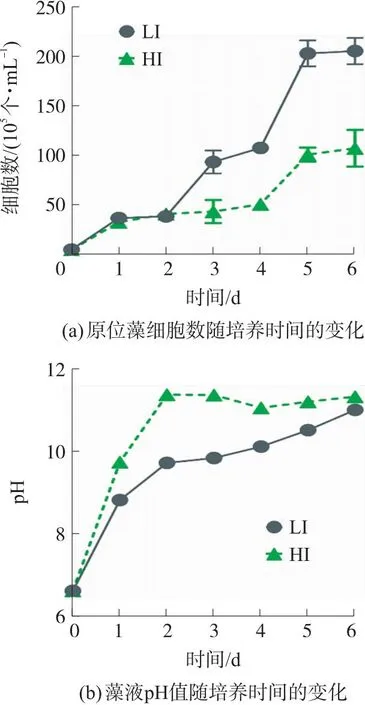
图1 低光强(LI)及高光强(HI)下原位藻细胞数及藻液pH值随培养时间的变化
由图1(a)可知,2天内LI组与HI组藻细胞生长速率无明显差异。2天后不同光强下原位藻的生长速率差距逐渐增加,第6天LI组细胞数增至2.04×107个/mL,是HI组的1.91倍。即在54 μmol/(m2·s)光强下原位藻生长趋势良好,说明微藻能较好适应此光强,然而1 000 μmol/(m2·s)光强下原位藻生物量降低,这可能与光抑制有关。该效应由细胞内光氧化反应引起,过量的光子导致D1蛋白被破坏,PSII反应中心功能丧失,光合电子传递受阻,从而抑制光合作用正常进行[22]。该试验结果也与Palanisamy等[23]的研究相吻合,他们发现200 μmol/(m2·s)对硅藻Thalassiosirapseudonana的生长产生了明显光抑制,生物量(细胞数)仅为120 μmol/(m2·s)光强下的50%。
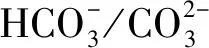
综上所述,HI组微藻生长受抑制的原因可能包括以下2个方面:高光强产生的光抑制、高pH导致的酶活性抑制。
2.1.2 叶绿素含量变化
叶绿素是光合作用电子传递活性的主要指标,可用以评估光强对原位藻光合作用的影响。图2描述了原位藻6天内在低光强和高光强下叶绿素含量(叶绿素a、叶绿素b)的变化。
图2 低光强(LI)与高光强(HI)下原位藻叶绿素含量随培养时间的变化
由图2可知,6天内LI组叶绿素含量持续增加,而HI组叶绿素含量呈减小趋势,且第6天培养结束时积累的叶绿素浓度为1.66 mg/L,仅为LI组(12.86 mg/L)的12.9%。这与多数研究结果一致,即与低光强相比,高光强下微藻叶绿素含量显著降低[27]。Liu等[27]研究表明,当光强从50 μmol/(m2·s)增加至400 μmol/(m2·s)时,Scenedesmussp.叶绿素占干重百分比下降约8%。这可能是由于藻类色素具有吸收光子的能力,但高光强导致的过量光吸收会破坏叶绿体薄片,降低二氧化碳固定酶的活性甚至导致叶绿体分解,由此对藻细胞造成伤害并抑制光合作用[8,28]。
2.1.3 光合作用参数变化
原位藻的光合活性以最大量子产率Fv/Fm和rETR表征,Fv/Fm反映PSII的潜在最大光合能力,rETR则表示经过PSII的相对电子流速率,2者均可用以表征微藻所受胁迫程度[13]。由图3可知,原位藻在LI下Fv/Fm值相对稳定,至第3天增至0.75,表明光合性能良好。随着细胞增长,微藻密度增大导致的光利用不均匀或养分受限致使Fv/Fm值又呈下降趋势,但仍高于0.70。
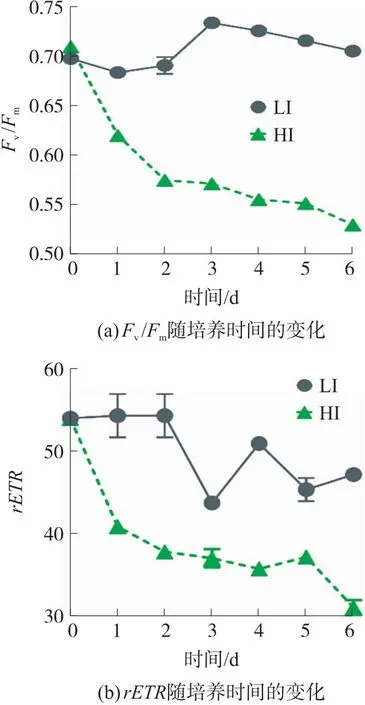
图3 低光强(LI)及高光强(HI)下原位藻Fv/Fm和rETR随培养时间的变化
有报道证实,Fv/Fm高于0.60可作为微藻生长良好及正常光合作用的判断依据[29]。相反,HI组在培养2天后Fv/Fm值迅速下降了18.97%且已低于0.60,表明高光强导致原位藻受到胁迫,光合活性显著降低。这可能是因为高光强加重了原位藻的氧化应激,增加了PSII损伤,导致光合速率下降。与之类似,Hughes等[30]也用Fv/Fm值评估不同光强对Thalassiosirapseudonana的光抑制效应,研究发现相比于47 μmol/(m2·s),在25 h 250 μmol/(m2·s)光照下微藻光抑制严重,其Fv/Fm值最终降至0.15。相反,课题组前期研究表明原位藻在700 μmol/(m2·s)光强下培养5天Fv/Fm值仍维持在0.63(>0.6)[13],表明此光强下原位藻仍能正常生长,而本试验1 000 μmol/(m2·s)的高光强对原位藻产生了明显的光抑制。值得注意的是,HI组Fv/Fm值于第2天下降至0.52后,下降速率减缓,这可能是由于原位藻自身启动光胁迫保护机制,激活抗氧酶或促进合成植物激素等光保护化合物,以阻止细胞破坏加剧[31]。与Fv/Fm类似,高光强下原位藻rETR也呈现逐渐下降趋势,于第6天降至30.98。而低光强下原位藻rETR值稳定处于较高水平,且第6天高于高光强组52%(p<0.05)。综上所述,原位藻在54 μmol/(m2·s)光强下光合性能良好,而1 000 μmol/(m2·s)对其光合作用产生胁迫作用。
2.2 光强对原位藻细胞组分的影响
2.2.1 胞外聚合物
胞外聚合物EPS是微藻分泌到胞外的复杂混合物,由蛋白、多糖等高分子聚合物组成,其保持稳定的水合生物膜基质结构,保护细胞免受脱水和有毒物质的侵害,并可作为能量来源以应对环境压力,通过调节多糖或蛋白的生物合成机制以适应环境条件。同时形成了有助于细胞间相互作用的三维聚合物网络,介导其与表面的粘附[32],对微藻生长、聚集、生物膜形成等至关重要,其中,光强是影响EPS含量的重要因素之一。不同光强对原位藻分泌EPS含量的影响如图4所示。
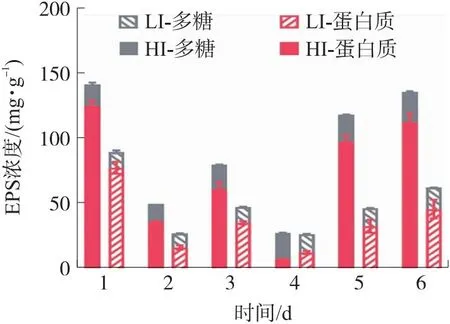
图4 光强对原位藻EPS中蛋白质和多糖含量的影响
首先,54 μmol/(m2·s)和1 000 μmol/(m2·s)条件下EPS总量最大值分别为89.11 mg/g和140.92 mg/g,即高光强显著增加了原位藻EPS产量(p<0.05)。由图4可知蛋白质为原位藻EPS的主要成分(除第4天外)。课题组前期研究表明700 μmol/(m2·s)光强下原位藻蛋白质含量占EPS的55.0%~65.7%[13],而本试验中原位藻EPS蛋白质含量占比升高至59.18%~88.55%,表明相比于700 μmol/(m2·s),在更高光强下原位藻分泌的EPS中蛋白质比例增加。2组原位藻生长过程中EPS总量变化趋势并无明显差异,EPS是微藻用以抵御极端环境的重要物质,在生长初期原位藻分泌大量EPS以应对新培养基带来的环境压力。具体而言,在第3天LI组和HI组EPS总量分别比第2天增加了30.03 mg/g和20.22 mg/g。随着细胞增长,2组原位藻分泌的EPS含量于第4天下降至25.95 mg/g和27.06 mg/g,尤其蛋白含量降至6.93 mg/g和11.9 mg/g,可能由于此时原位藻生长需要较多氮源,而蛋白质可作为有效的氮源满足微藻生长的营养需求,因而蛋白质含量下降。
2.2.2 胞内组分
微藻细胞主要由蛋白质、多糖和脂质组成[33]。不同光强对原位藻细胞内组分的影响如图5所示。图5(a)表明高光强降低了原位藻胞内蛋白质和多糖的含量。具体而言,相对于LI组,第6天HI组胞内蛋白质浓度下降29.19%,多糖浓度降低16.23%。这与2.1.2部分光合作用参数变化结果一致,1 000 μmol/(m2·s)光强下原位藻对光能的转换效率降低,碳循环被抑制,暗呼吸速率降低,导致原位藻对胞内蛋白质、多糖等生物量的积累。也有文献报道[27],当光强从50 μmol/(m2·s)增至400 μmol/(m2·s),Scenedesmusspp.胞内蛋白质的含量从11.1%降至6.1%。
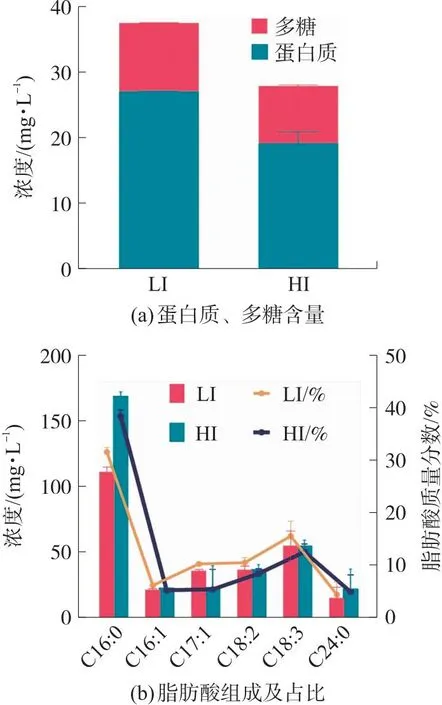
图5 光强对原位藻胞内蛋白质、多糖含量和脂肪酸组成及占比的影响
高光强诱导了原位藻脂肪酸含量及成分比例变化,当光强从54 μmol/(m2·s)增加到1 000 μmol/(m2·s)时,脂肪酸含量增加了19.63%,从354.08 mg/L增加到440.548 mg/L。这与已有研究一致,例如当光强从130 μmol/(m2·s)增加至520 μmol/(m2·s)时,Chlorellavulgaris的脂质含量从7.9%增加至22.2%,说明高光强促进脂质合成[34]。这可能是因为在高光强下,脂肪酸可作为能源吸收器,藻类通过将过量的光转化为脂肪酸用以对抗光氧化。即藻类细胞通过产生ATP和NAD(P)H(由光合作用产生)耗散多余的光子能量以阻止光化学损伤,而ATP和NAD(P)H可将二氧化碳通过一系列催化反应依次转化为丙酮酸及乙酰辅酶A,以促进脂质的生物合成[5,8]。因此高光强有助于原位藻脂肪酸的合成;然而在低光强下产生的能量多用于藻类生长,因而脂肪酸的合成受到影响。
另外,高光强导致的原位藻脂肪酸含量增加,可能与蛋白质和多糖含量减少相关。有研究表明,脂质和多糖的合成路径,会相互竞争共同的碳前体,而高光强可能因阻断了多糖合成从而促进脂肪酸的合成。也有人指出脂质合成主要依赖于蛋白质降解或蛋白质合成的抑制,这可能由于为氨基酸和蛋白质的合成所提供的碳骨架被用作合成脂肪酸所需的碳源和能源[33],例如有研究证实了以无氮或缺氮条件培养微藻以提高脂质含量的可行性[27]。
2.3 光照对原位藻生物柴油性能的影响
基于目前对可再生清洁燃料的迫切需求,微藻有望成为化石燃料的替代者。其中,脂肪酸组成是影响生物柴油性能的关键因素之一。由图5(b)可知,原位藻的主要脂肪酸组成为:棕榈酸(16∶0)、棕榈油酸(16∶1)、银杏酸(17∶1)、亚油酸(18∶2)、亚麻酸(18∶3)和花生四烯酸(24∶0),占总脂肪酸的70%~80%。其中棕榈酸占比最高,在2组中分别为31.18%和38.13%,花生四烯酸占比分别为4.10%和4.81%,即高光强下原位藻细胞饱和脂肪酸(Saturated fatty acids,SFAs)在总脂肪酸中的比例增加。由于SFAs具有最佳燃烧特性且单不饱和脂肪酸(Monounsaturated fatty acid,MUFA,包括棕榈油酸和银杏酸等)比多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA)具有理想的氧化稳定性、低温流动性和燃烧性能,因而SFAs和MUFA在生产生物柴油方面具有显著优越性[35]。从图5(b)可知光强改变了原位藻脂肪酸的成分比例,进而可能影响生物柴油的特性。
如表1所示,低光强和高光强下,从原位藻提取的脂肪酸性能均在生物柴油生产范围内。其中,HI组脂肪酸的SV值略高于LI组,表明HI组脂肪酸分子量较小、亲水性较强。IV是不饱和度的测定值,IV值较低表明生物柴油的稳定性较好[21],相比于LI组,HI组的生物柴油具有较高的氧化稳定性。CN值则用以表征生物柴油的燃烧性能,由表1可知,HI组的燃烧性能略高于LI组。KV值用以考察脂肪酸的运动粘度,该值与生物柴油的高温保护性能程度成正比,由此推测HI组的高温保护性能略高于LI组。然而,作为评价生物柴油低温流动性能的参数,HI组的高CP值表明该组低温流动性低于LI组。同时,HI的高HHV值则表明生物柴油的能量较低。综上所述,HI组培养的原位藻较LI组具有更好的氧化稳定性能、亲水性能、燃烧性能、高温保护性能,而低温流动性及能量则略逊于LI组。

表1 低光强(LI)及高光强(HI)下原位藻提取生物柴油性能评价表
3 结论
通过探究不同光强对原位藻生长和细胞内/外组分的影响,得到以下结论:(1)54 μmol/(m2·s)光照条件下原位藻生长良好,而1 000 μmol/(m2·s)光强下原位藻因藻液pH值升高及光氧化损伤,导致生长抑制,生物量下降47.63%,叶绿素浓度仅为1.66 mg/L;(2)高光强组胞内蛋白质和多糖含量分别下降29.19%和16.23%,而胞外聚合物含量提高了58.14%;(3)高光强刺激了原位藻脂质积累且高光强下培养的原位藻生物柴油具有更好的氧化稳定性能、亲水性能、燃烧性能、高温保护性能。本研究对于原位藻污水处理的培养条件调控及微藻资源化应用具有一定指导意义。

