原发性膜性肾病预防性抗凝治疗研究进展*
李炼,郑星月,武刘芸,尹琪楠,韩丽珠,雷洋,边原,
(1.电子科技大学医学院,成都 610054;2.四川省医学科学院·四川省人民医院/电子科技大学附属医院药学部·个体化药物治疗四川省重点实验室,成都 610072)
膜性肾病(membranous nephropathy,MN)通常进展为肾病综合征(nephrotic syndrome,NS),且以蛋白尿和低蛋白血症为主要临床症状,该病按照病因可分为继发性和原发性膜性肾病(primary membranous nephropathy,PMN),其中PMN占比约80%[1]。PMN患者伴有较高血栓风险,但这类人群预防性抗凝治疗目前仍然存在争议和分歧[2]。在进行血栓预防之前,准确掌握患者血栓风险有助于个体化治疗方案的制定。然而,找到适用于PMN患者的有效血栓风险评分工具及血栓预防方案对临床是一个挑战。笔者在本文就PMN血栓形成风险因素、预防性抗凝治疗时机及药物选择3个部分对现有文献进行综述,以期为临床提供参考,保障该类患者抗凝药物的合理使用。
1 PMN血栓风险因素
PMN患者在临床过程中通常伴随血液高凝状态,这与血栓发生密切相关。PMN静脉血栓栓塞(venous thromboembolism,VTE)发生率6.9%~36%[3-6],与多种风险因素相关。首先,在不同肾小球疾病中,目前专科领域普遍认为MN发生血栓的风险最高,对诊断为MN的患者应着重注意血栓风险[7-9]。其次,低蛋白血症为PMN并发VTE的独立风险因素,血清白蛋白水平越低血栓风险越高,尤其是低于25 g·L-1时[6,10-11]。最后,PMN患者长期存在蛋白尿,导致抗凝血酶Ⅲ、纤溶酶、蛋白S以及蛋白C等从尿液中丢失,引起凝血功能紊乱,这也可能是导致PMN血液高凝状态的机制之一[12],故严重的蛋白尿同样具有临床参考价值[13]。此外,M型磷脂酶A2受体抗体、D-二聚体以及糖皮质激素的使用均与PMN血栓风险有关[14-17]。
2 预防性抗凝的时机
如何确定PMN预防性抗凝的最佳时机一直是临床难题。现有文献资料和实践指南可供参考的依据并不多,大多聚焦在血清白蛋白水平以及出血风险上,结合二者可判断预防性抗凝的适宜性。
2.1PMN早期血栓高风险 PMN病程早期的VTE和动脉血栓栓塞(arterial thromboembolism,ATE)风险最高,尤其是在NS状态下,血栓栓塞发生风险在病程前6个月显著升高[18]。PMN治疗目标主要是保留患者肾功能及预防终末期肾脏疾病。然而有学者表示,在PMN病程早期,初期治疗目标不能仅限于此。在对来自肾小球疾病协作网的404例PMN患者临床数据回顾性分析后发现,在病程早期,PMN并发ATE的风险与进展为终末期肾脏疾病的风险相当,甚至在估计肾小球滤过率(estimated glomerular filtration rate,eGFR)≥60 mL·min-1的患者中,ATE发生风险超过进展为终末期肾脏疾病的风险[19]。因此,将预防血栓栓塞发生作为PMN早期治疗目标的一部分可能有助于改善患者预后。
2.2预防性抗凝的获益决策分析 当PMN的NS程度较为严重且没有抗凝禁忌证及伴有其他血栓形成风险因素时(例如心力衰竭、长期卧床以及外科手术等),给予预防性抗凝是易于理解的[20],但当情况变得更为复杂时预防性抗凝是否仍能获益不得而知。
SARASIN等[21]采用Markov决策模型分析比较了预防性抗凝治疗与抗凝治疗的风险获益,结果表明在血栓栓塞风险高的MN中,预防性抗凝治疗效果优于抗凝治疗。随着研究的深入,研究者们发现低蛋白血症、蛋白尿以及其他风险因素与PMN并发血栓密切关系,以此进一步阐明了预防性抗凝的决策。LEE等[22]构建了Markov模型,该模型结合MN患者血清白蛋白水平、出血风险以及可接受的获益风险比可以量化预测使用华法林进行预防性抗凝获益的可能性。纳入898例MN患者用以构建模型,采用ATRIA评分进行出血风险的评估,并将患者分为低、中、高出血风险,分别预测了3类患者在不同血清白蛋白水平下预防性抗凝的获益风险比。模型结果表明:①获益风险比与血清白蛋白水平成反比;②低出血风险MN患者更容易从预防性抗凝中获益;③中等出血风险MN患者在严重低蛋白血症时,才能从预防性抗凝中获得较低的收益;④高出血风险MN患者无法从预防性抗凝中获益。表1为预测不同出血风险及血清白蛋白水平的MN患者预防性抗凝的获益风险比[22]。然而,该模型仅适用于使用华法林的PMN患者,且仅纳入了血清白蛋白水平作为VTE风险因素,另外也有学者认为 HAS-BLED评分可能更适用于评估出血风险[23-24]。这些因素极大地限制了其普遍性和外部适用性。
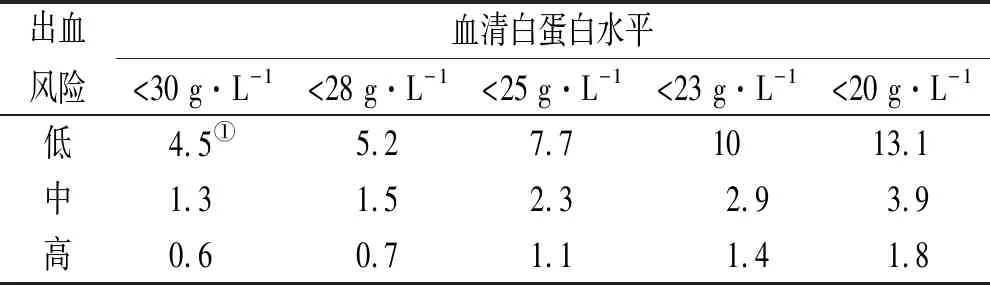
表1 预测的获益风险比
2.3预防性抗凝的临床决策算法
2.3.1ATE的预防 HOFSTRA等[25]讨论了阿司匹林用于MN中ATE的一级预防并开发了一个指导VTE和ATE预防的临床算法。该算法将血清白蛋白水平划分为3个区间,<25、25~32、>32 g·L-1。当血清白蛋白<25 g·L-1且PMN并发VTE风险较高时,评估出血风险后,对出血风险低的患者使用华法林预防,出血风险高者则使用阿司匹林;在 25~32 g·L-1时,则需要评估ATE发生风险,算法推荐使用Framingham风险评分结合eGFR、糖尿病和ATE史来评估。当ATE发生风险高于20/1 000人每年(patient-years,py)时,推荐阿司匹林,否则不推荐预防抗凝;>32 g·L-1则不推荐预防性抗凝。 LEE等[19]的研究结果表明,PMN患者ATE第一年累积发病率2.6%,高于20/1 000 py,为该算法提供了证据支持。但是低蛋白血症与PMN并发ATE的关系仍需讨论[24]。图1为该简化算法。
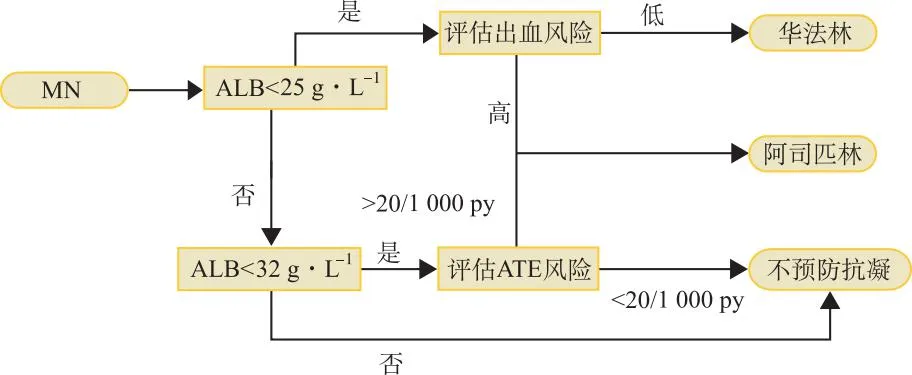
图1 HOFSTRA开发的预防PMN并发ATE的决策算法
2.3.2VTE的预防 一篇关于NS预防性抗凝的系统评价[23]针对PMN单独开发了决策算法。该算法不推荐对HAS-BLED评分≥3的高出血风险患者行预防性抗凝。对低出血风险的PMN,血清白蛋白<30 g·L-1时则建议给与预防性抗凝治疗;在中等出血风险中,这个阈值被降为25 g·L-1,另外,当血清白蛋白水平在25~30 g·L-1之间合并一个或多个血栓形成风险因素(如蛋白尿>10 g·d-1、病态肥胖、心力衰竭、外科手术以及遗传易栓症等)时应当考虑预防性抗凝治疗(图2)。
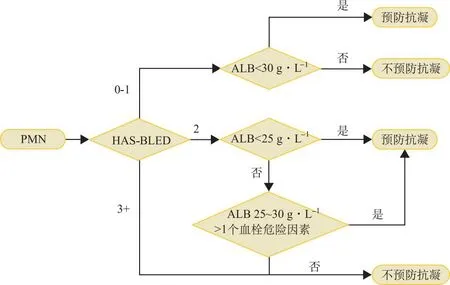
图2 LIN开发的预防PMN并发VTE的决策算法
2.3.3改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)指南推荐的临床决策算法 2021版肾小球疾病临床实践指南[26]更新了MN预防性抗凝治疗策略。新增了预防MN并发ATE的建议,其中关于MN预防性抗凝治疗的临床算法与HOFSTRA提出的基本类似。不同的是KDIGO额外考虑了血清白蛋白不同检测方法之间的差异,例如溴甲酚紫与溴甲酚绿。关于VTE的预防治疗方案,KDIGO在HOFSTRA建议的华法林基础之上提出低分子肝素联合阿司匹林的替代方案,以用于一些不适合使用华法林的MN患者。另外基于LEE等构建的Markov决策工具(该决策工具包含了ATRIA出血风险评分),KDIGO建议使用该工具来评估MN的出血风险(网址:https://www.med.unc.edu/gntools/bleedrisk.html)。同样,该决策算法仍然存在一些争议,依据血清白蛋白水平来指导MN发生ATE的预防欠妥,因为ATE的风险是否与低蛋白血症有关尚未达成共识;其次是出血评估的工具欠佳,HAS-BLED评分可能更合适;最后是低分子肝素联合阿司匹林治疗方案欠考虑,因为KDIGO推荐的出血评估工具仅适用于华法林预防性抗凝治疗的MN患者[24,27]。图3为该简化算法。
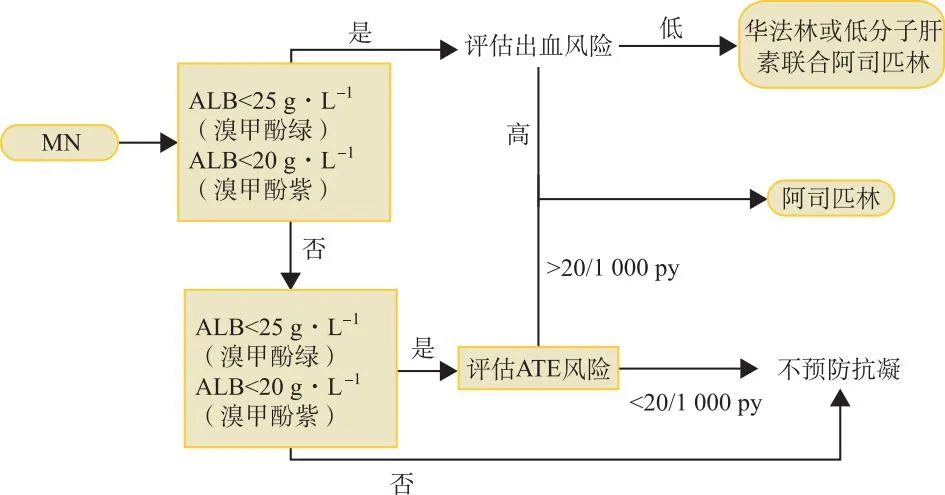
图3 KDIGO开发的决策算法
3 血栓防治药物
如何确定PMN血栓防治的最佳治疗方案目前尚无统一共识,仅有少部分低证据水平研究评估了MN或者NS中使用预防抗凝药物的效果。表2对这些研究做了简单总结。
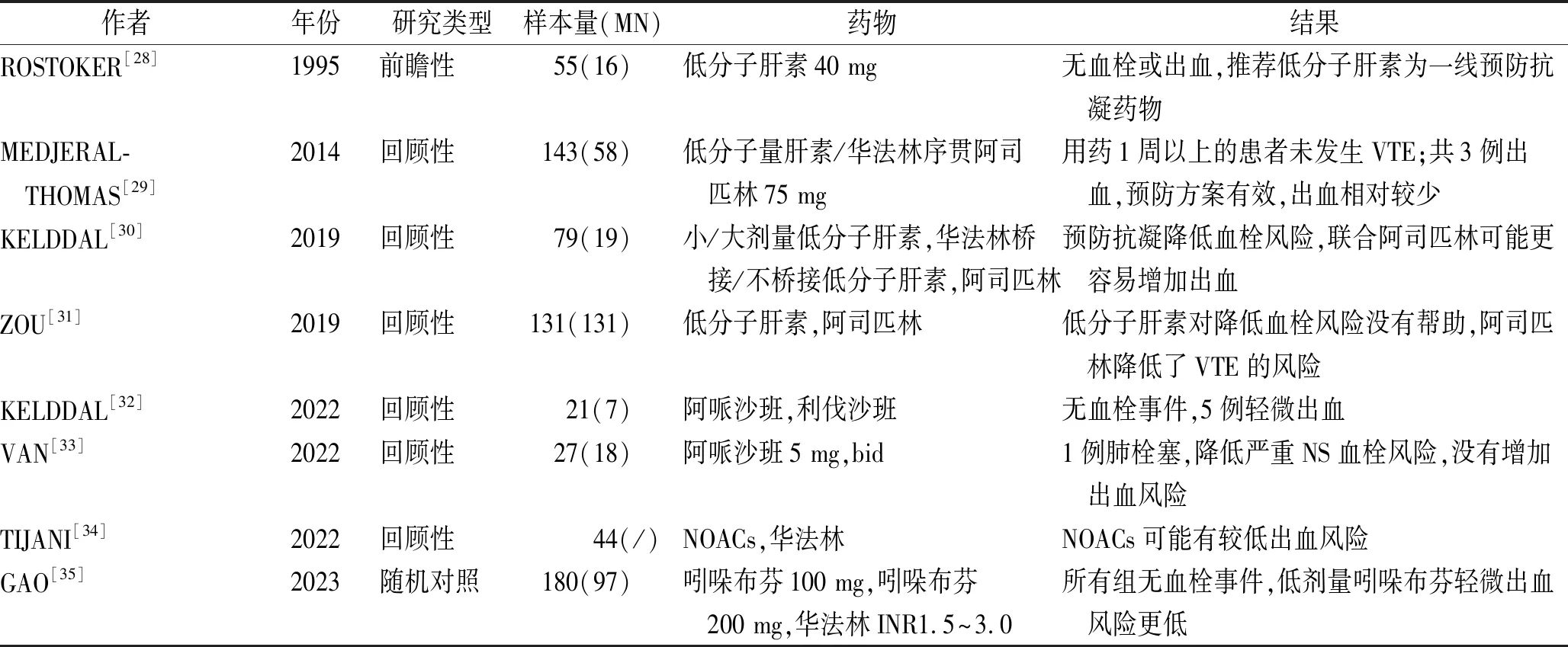
表2 评估预防抗凝药物的研究
3.1抗凝药物
3.1.1华法林 华法林的临床使用经验最为丰富,广泛用于VTE的一级和二级预防、心房颤动血栓栓塞的预防等[36]。几乎所有学者都认可华法林用于MN预防性抗凝治疗[22-23,29,37-40],一些回顾性队列研究提示华法林的使用与MN血栓风险下降有关并且较少发生出血事件[29-30,41-42]。KDIGO指南推荐对血清白蛋白<25 g·L-1且低出血风险的MN患者使用华法林进行VTE预防性抗凝,并且提到单独使用华法林也能有效预防ATE。但是严重NS和低eGFR会导致国际标准化比值(international normalized ratio,INR)不易控制,且华法林的高初始剂量反而会增加MN血栓风险。
3.1.2新型口服抗凝剂(novel oral anticoagulants,NOACs) 有关NOACs用于PMN血栓预防的研究极为有限,两项小型回顾性研究报道了NOACs用于NS血栓预防的可能性[32-34]。另外也有报道称,通过阿哌沙班成功预防了2例NS患者血栓发生[43],与此同时,也有1例在阿哌沙班治疗时仍然复发VTE的MN患者[44]。在选择NOACs预防PMN血栓时应当慎之又慎,目前相关的证据并不足以支持NOACs作为PMN一线抗凝预防药物。此外,蛋白尿和低蛋白血症对NOACs在体内的药动学及药效学改变有何影响尚不确定,在重度肾损伤患者中安全性有限[23,44]。
3.1.3低分子肝素 低分子肝素常用于MN预防性抗凝。低分子肝素/华法林序贯阿司匹林的治疗方案效果好且出血风险低[29,41]。并且KDIGO指南中对血清白蛋白<25 g·L-1且低出血风险的MN,在单用华法林不适宜的情况下推荐低分子肝素联合阿司匹林进行预防性抗凝[26]。需要注意的是,该联合治疗方案可能增加出血风险[30]。另外,低分子肝素主要通过与抗凝血酶Ⅲ结合从而快速抑制Ⅹa因子达到抗凝效果。MN患者抗凝物质从尿液中丢失,导致抗凝血酶Ⅲ水平降低,此时使用低分子肝素可能更易引起患者肝素抵抗[24]。
3.2抗血小板药物
3.2.1阿司匹林 小剂量阿司匹林能够抑制血小板粘附、集聚从而预防血栓形成,而血小板异常活化与PMN血液高凝状态的形成有关[5]。使用阿司匹林获益的关键在于MN患者ATE风险是否大于20/1 000 py。当ATE风险大于20/1 000 py,按照4:1的获益风险比计算时,预防性使用阿司匹林才能获益,否则其带来的出血风险依旧高于获益。低分子肝素序贯阿司匹林的方案可能是更优的选择[29-30,41],血清白蛋白水平<20 g·L-1时给予低分子肝素,上升至20~30 g·L-1时停用低分子肝素,给予阿司匹林。
3.2.2吲哚布芬 近期一些研究者评估了吲哚布芬用于MN预防性抗凝的效果。国内一项随机对照研究将吲哚布芬与华法林进行比较,在整个研究期间所有组均未发现血栓事件,且小剂量吲哚布芬相比华法林显著降低了轻微出血事件的发生率(2%vs.18%,P<0.05)。在高出血风险的情况下,吲哚布芬或许值得考虑[35]。
4 结束语
预防性抗凝的双刃剑特性使人们用起来总是小心翼翼,尤其是PMN中。预防性抗凝获益与出血风险之间的权衡始终是争议的焦点,高质量随机对照研究的缺乏导致PMN预防性抗凝研究进展缓慢。制定预防抗凝策略应当基于患者个体风险水平,但这并非易事。在精准医疗和个体化治疗的时代背景下,利用医疗大数据构建PMN血栓风险预测模型或许能够帮助权衡风险。

