老年晚期非小细胞肺癌免疫治疗策略*
尹佳鑫,宋羽霄,章必成
(武汉大学人民医院肿瘤中心,武汉 430060)
当前在全球范围内,肺癌的发病率和死亡率位居榜首,而肺癌中绝大部分是非小细胞肺癌(non-small cell lung cancer,NSCLC),约占80%以上[1]。NSCLC常发生于老年人,约半数患者确诊时年龄超过70岁[2]。由于年龄较大,老年NSCLC患者会出现对传统治疗手段不敏感、治疗耐受性差和药物不良反应大等情况。近年来,以免疫检查点抑制剂(immune check-point inhibitors,ICIs)为代表的免疫疗法彻底改变了包括老年人在内的所有分期NSCLC患者的治疗方案。ICIs在给老年晚期NSCLC患者带来更长生存获益的同时,也会出现不同程度的免疫相关毒副反应(immune-related adverse events,irAEs)。目前仅少数临床研究纳入老年患者[3],使得该群体的临床代表性明显不足,而在真实世界中,老年NSCLC群体数量庞大,因此亟需探究其ICIs治疗策略。笔者对老年晚期NSCLC患者的ICIs应用现状进行归纳总结,以期为优化其免疫治疗策略提供参考。
1 老年晚期NSCLC患者应用ICIs的理论基础
免疫检查点是免疫细胞上表达的对免疫系统起抑制作用的分子,主要作用是防止自身免疫、维持耐受,但却常被肿瘤细胞利用,成为肿瘤逃避机体免疫监视的“帮凶”。ICIs一方面可以阻断免疫检查点,通过抑制肿瘤细胞的免疫逃逸发挥抗肿瘤作用;另一方面通过阻断肿瘤向正常细胞传递抑制性信号,恢复免疫细胞抗肿瘤功能。研究认为,随着年龄增加,人群也会出现“免疫衰老”,主要表现为表观遗传改变、蛋白质稳态丧失、细胞衰老等[4]。继发于免疫衰老出现固有免疫和适应性免疫系统的老化,可能降低ICIs疗效[5]。因此从理论上讲,老年人接受ICIs治疗可能疗效相对较差。
然而,一项研究老年肿瘤患者的综合转录组分析显示,衰老组的程序性细胞死亡受体-1(programmed cell death protein-1,PD-1)及配体(programmed cell death ligand-1,PD-L1)、抗细胞毒性T淋巴细胞相关抗原-4(cytotoxic T-lymphocyte-associated antigen 4,CTLA-4)等免疫抑制分子高表达,且表达水平与年龄呈正相关[6]。在黑色素瘤小鼠模型中发现,高龄小鼠对PD-1抗体反应更优[7]。部分随机临床研究的老年亚组分析以及针对老年晚期NSCLC患者的真实世界研究发现,老年患者能从ICIs治疗中获得与年轻患者相似的疗效,患者的生存结局主要受体能状态(performance status,PS)影响,而不是实际年龄[8]。因此,老年NSCLC患者应用ICIs治疗从理论和实践上讲可行。
2 老年晚期NSCLC患者应用ICIs的临床研究现状
在老年肿瘤人群中,关于老年NSCLC患者应用ICIs的数据最多。老年患者罹患NSCLC大多已是晚期,ICIs已成为老年晚期NSCLC的优选方案。2023年中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)指南再次将ICIs一线或二线治疗作为晚期无驱动基因突变NSCLC患者(包括老年患者)的一级推荐[9]。笔者根据老年晚期NSCLC患者的不同ICIs治疗方案分别进行讨论。
2.1老年晚期NSCLC患者应用ICIs单药方案 目前临床应用较多的ICIs单药主要包括帕博利珠单抗、阿替利珠单抗和纳武利尤单抗等PD-1/L1抗体,涵盖晚期NSCLC的一线和二线治疗。
一项评估老年晚期NSCLC人群(≥75岁)单用帕博利珠单抗治疗的荟萃分析纳入KEYNOTE-010、KEYNOTE-024、KEYNOTE-042三项大型随机对照研究(randomized controlled trials,RCTs),包括264例≥75岁、PS评分0~1分的老年NSCLC患者[10]。结果显示,对PD-L1肿瘤细胞阳性比例分数(tumor proportion score,TPS)≥1%的老年患者,相比于传统化学治疗(化疗),帕博利珠单抗可延长4个月的中位总生存期(overall survival,OS);在PD-L1 TPS≥50%的老年患者中,帕博利珠单抗显著改善OS(23.1个月vs.8.3个月),PD-L1表达水平越高,帕博利珠单抗的临床获益越显著。然而,KEYNOTE-010和KEYNOTE-042研究的年龄分层结果显示,≥75岁晚期NSCLC患者的生存获益显著低于<75岁患者[10]。
阿替利珠单抗在晚期NSCLC一线或二线治疗中均有一定地位。IMpower110研究[11]结果显示,在PD-L1高表达人群中,相比铂类化疗,65~74岁年龄区间的NSCLC患者一线使用阿替利珠单抗有显著OS获益[风险比(hazard ratio,HR)=0.63],≥75岁患者仍有获益(HR=0.79),但获益率有所下降。Ⅲ期OAK研究[12]显示,相比多西他赛,≥65岁NSCLC患者二线应用阿替利珠单抗能显著延长OS(14.1个月vs.9.2个月)。
多项全球多中心Ⅲ期RCTs确立了纳武利尤单抗的二线免疫治疗地位。CheckMate 017和CheckMate 057研究采用相同的实验设计,对比纳武利尤单抗和多西他赛对不同病理分型NSCLC患者的疗效[13]。针对鳞状NSCLC,CheckMate 017研究[14]显示≥75岁患者OS的HR为1.85(0.76~4.51)。针对非鳞状NSCLC,CheckMate 057研究[15]显示≥75岁患者OS的HR为0.90(0.43~1.87)。针对中国人群的CheckMate 078研究[16]显示,单用纳武利尤单抗可降低≥65岁NSCLC患者近一半死亡率,但≥75岁者获益并不明确。
大型真实世界研究和回顾性研究数据支持老年晚期NSCLC患者使用ICIs,但随着年龄增长,生存获益变差。来自美国国家癌症数据库的真实世界研究纳入≥75岁晚期NSCLC患者24 136例,发现接受ICIs治疗患者OS明显长于未接受者(HR=0.61,P<0.000 1)[17]。荷兰大型回顾性研究纳入接受ICIs治疗的晚期NSCLC患者2 302例,≥75岁患者OS率与年轻患者相似[18]。一项意大利多中心回顾性研究探索≥75岁NSCLC患者使用PD-1单抗的有效性,发现以80岁为分界的老年患者OS率未见差异[19]。一项大型荟萃分析纳入34项研究的20 511例不同肿瘤类型晚期患者,结果显示ICIs治疗组(<65岁、65~75岁)的OS改善有统计学意义,但≥75岁患者改善较小[20]。一项更高年龄分层的回顾性研究显示,≥80岁晚期NSCLC患者接受ICIs治疗后的OS仅为3.62个月,而<80岁患者OS超过12.92个月[21]。一项多中心队列研究探索接受ICIs治疗的不同年龄段晚期NSCLC患者OS趋势,发现ICIs最大获益人群是<75岁患者,且年龄与OS呈负相关[22]。
综合上述及其他数据(表1),笔者认为老年晚期NSCLC患者可根据PD-L1表达情况选用帕博利珠单抗、阿替利珠单抗和纳武利尤单抗等作为一线或二线治疗手段,但高龄(≥80岁)患者应慎重选择ICIs治疗。
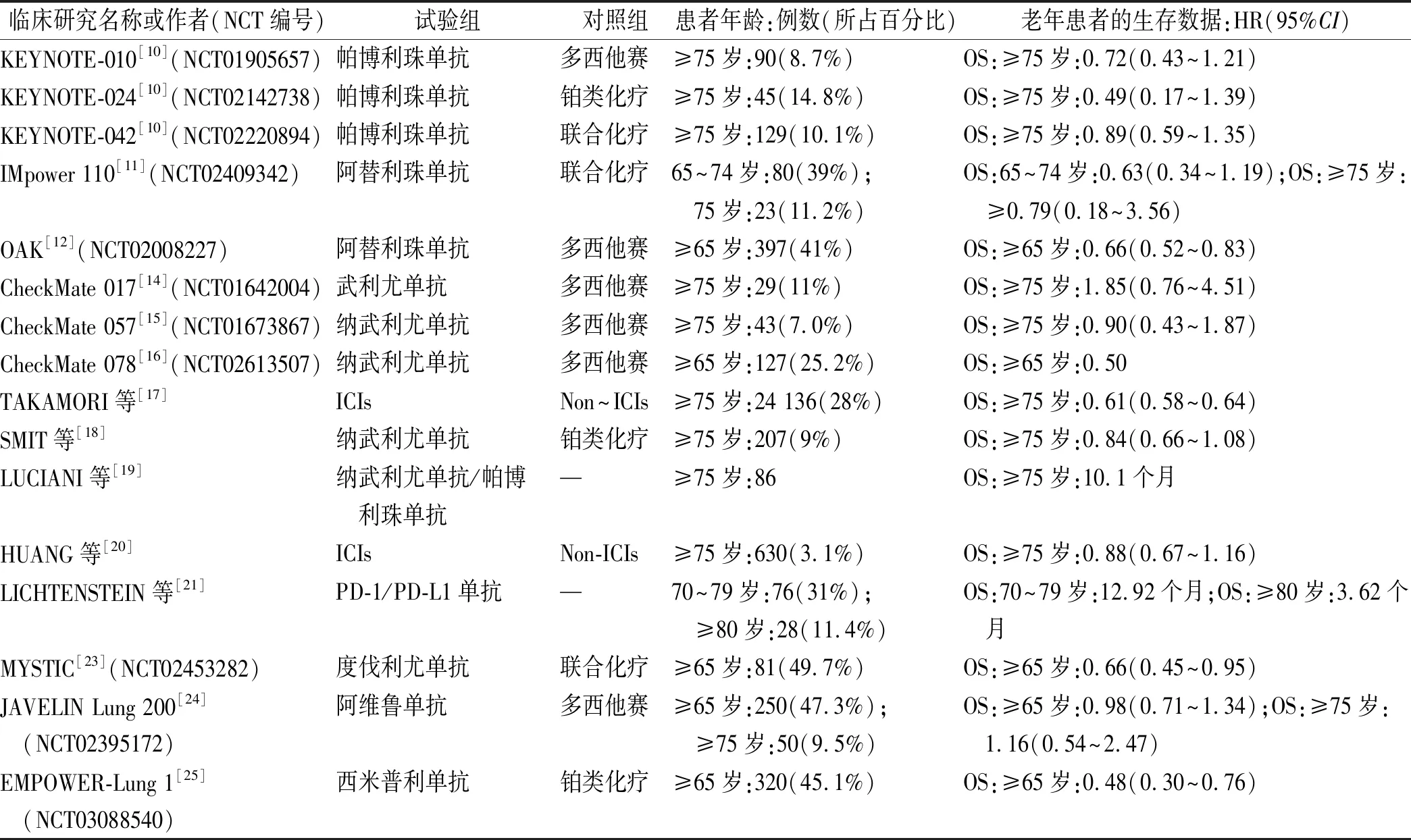
表1 老年NSCLC患者一线/二线单用ICIs的临床研究生存数据汇总
2.2老年晚期NSCLC患者一线应用ICIs双药方案 基于CheckMate 227和CheckMate 9LA研究,纳武利尤单抗联用伊匹木单抗以及双ICIs联合短疗程化疗方案被美国食品药品管理局(Food and Drug Administration,FDA)批准用于无驱动基因突变且PD-L1表达阳性晚期NSCLC患者的一线治疗,从而拉开晚期NSCLC双ICIs治疗时代序幕。CheckMate 227研究[26]结果显示,相比化疗,双ICIs能给65~74岁年龄区间的晚期NSCLC患者带来生存获益(16.6个月vs.14.5个月),≥75岁患者也有获益(13.5个月vs.11.4个月),但获益率有所下降。此外,亚裔人群生存数据与总体人群一致,在有些方面甚至表现更好[27]。在CheckMate 9LA研究[28]中,双ICIs联合2周期化疗对65~74岁患者疗效显著,OS的HR为0.62(0.46~0.85),但≥75岁患者疗效不佳(HR=1.21)。笔者认为,65~74岁年龄区间的NSCLC患者可选用双免疫或双免疫联合短疗程化疗,但基于双免疫治疗的irAEs发生率较高,不推荐≥75岁患者使用此方案。
2.3老年晚期NSCLC患者一线应用ICIs联合化疗方案 作为ICIs代表药物,以帕博利珠单抗为代表的进口药物在一线免疫联合化疗领域占据重要地位。多项探索帕博利珠单抗联合化疗的RCTs达到主要研究终点,亚组分析显示对多种病理类型的老年晚期NSCLC患者均有较好疗效。KEYNOTE-189研究[29]对比安慰剂联合化疗,应用帕博利珠单抗联合化疗的≥65岁非鳞NSCLC患者OS的HR为0.64(0.43~0.95),无进展生存期(progression-free survival,PFS)的HR为0.75(0.55~1.02)。KEYNOTE-407研究[30]显示帕博利珠单抗联合化疗对老年肺鳞癌患者的生存数据也表现出具有临床意义的改善。此外,KEYNOTE-189研究[29]还根据PD-L1 TPS分层(<1%、1%~49%、≥50%)比较OS和PFS,发现PD-L1评分越高,患者预后越好。
在一线免疫联合化疗领域,国产ICIs也大放异彩。中国多中心Ⅲ期CHOICE-01研究[31]数据显示,对比安慰剂联合化疗,特瑞普利单抗联合化疗可降低≥65岁NSCLC患者47%的疾病进展风险。舒格利单抗联合化疗对老年转移性NSCLC的生存数据同样优秀(PFS的HR为0.53)[32]。卡瑞利珠单抗联合卡铂和培美曲塞能降低老年晚期非鳞NSCLC患者43%的疾病进展风险[33];卡瑞利珠单抗联合卡铂和紫杉醇对老年晚期肺鳞癌患者疗效更显著(≥65岁患者OS和PFS的HR分别为0.64和0.49)[34]。信迪利单抗联合化疗对>60岁晚期非鳞和鳞状NSCLC患者PFS均有获益,分别为0.53和0.57[35-36]。相比于老年晚期非鳞NSCLC,替雷利珠单抗联合化疗对肺鳞癌患者的生存获益更明显,≥65岁患者PFS为0.60[37-38]。
虽然免疫联合化疗能提升老年晚期NSCLC患者生存获益,但可能疗效和安全性不如免疫单药。2023年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)会议报道了一项日本多中心大样本回顾性队列研究,比较≥75岁晚期NSCLC患者使用免疫联合化疗或免疫单药的疗效和安全性。结果显示相比于免疫单药,ICIs联合化疗并未改善患者生存率,并且3级及以上irAEs发生率有所增加(24.3%vs.17.9%,P=0.03)[39]。
综合以上及其他数据(表2),笔者认为,<75岁晚期NSCLC患者一线接受免疫联合化疗,生存获益和毒副反应均与年轻患者类似;但在≥75岁且PD-L1阳性的晚期NSCLC患者中,最好选用免疫单药。
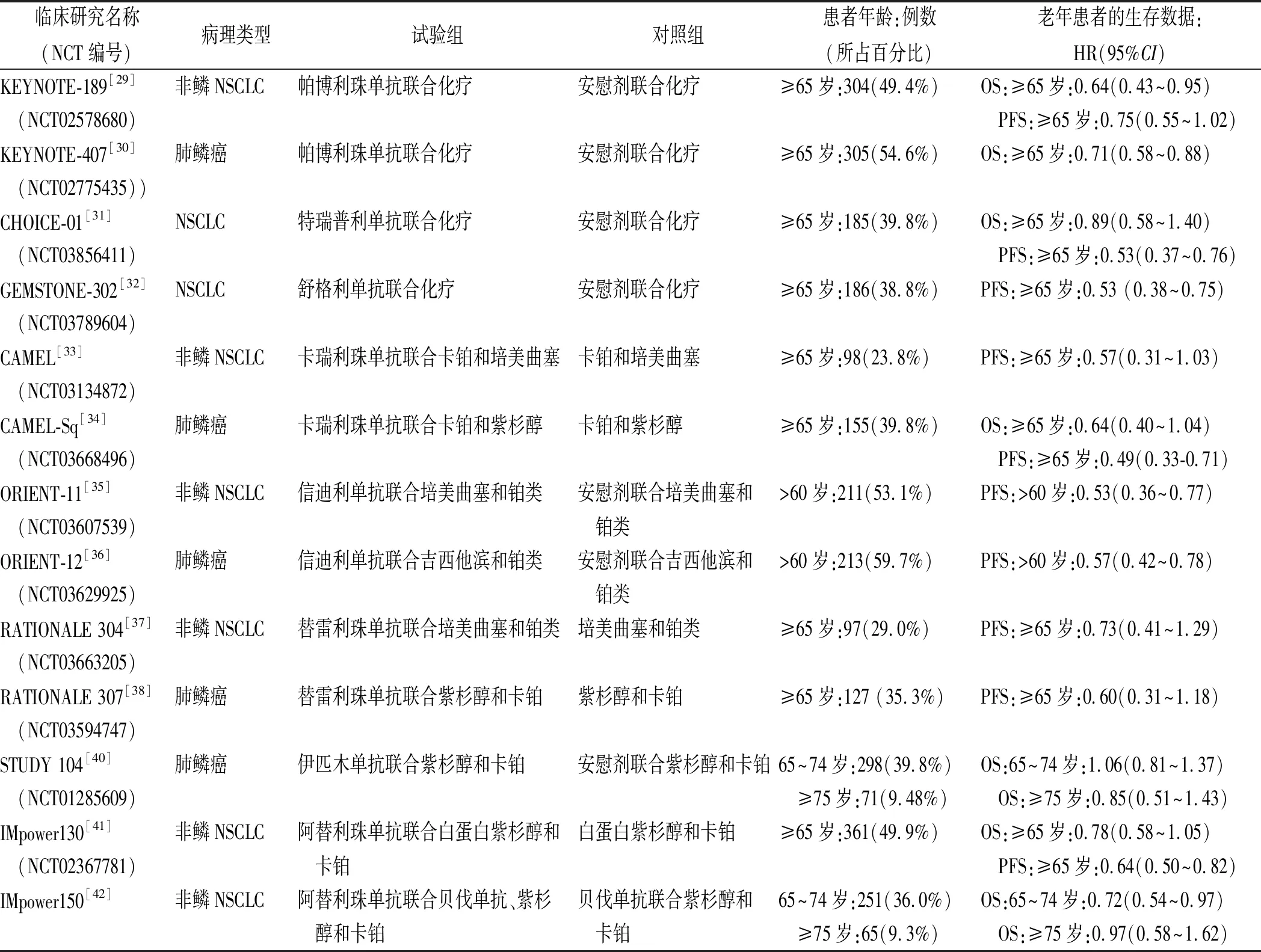
表2 老年NSCLC患者一线ICIs联合化疗的临床研究生存数据汇总
3 老年NSCLC患者应用ICIs导致irAEs的讨论
现有数据表明,与标准化疗相比,ICIs对老年晚期NSCLC患者疗效更优,治疗相关不良事件(treatment-related adverse events,TRAEs)发生率更低。老年晚期NSCLC患者使用帕博利珠单抗的总体TRAEs发生率低于化疗(68.5%vs.94.3%),≥3级TRAEs发生率更低(24.2%vs.61.0%)[10]。CheckMate 078研究发现,纳武利尤单抗用于≥65岁亚洲人群安全性良好,3-4级TRAEs的发生率低于化疗组(10%vs.47%)[16]。
虽然ICIs引起TRAEs的发生率比化疗低,但随着患者年龄逐渐增长,TRAEs的发生率也会随之升高。老年患者衰老过程中出现持续的炎症反应会增加TRAEs发生率,甚至导致某些患者不得不停止有效的ICIs治疗。II期CheckMate 171研究[43]发现,总人群、≥70岁和≥75岁NSCLC患者任意级别TRAEs发生率分别为57.3%、62.9%和69%,3-4级TRAEs分别为13.9%、15.8%和18%,呈逐渐增高趋势。一项法国前瞻性研究评估真实世界中接受ICIs治疗的实体瘤患者的irAEs发生率,以年龄划分为年轻(<70岁)和老年患者(≥70岁)。结果显示,老年患者中≥2级irAEs的发生率高于年轻患者(33%vs. 25%),并且老年患者更易反复出现irAEs(P<0.05)[44]。两项国际队列研究表明,随着年龄增长,因irAEs而停用ICIs的频率变高,≥90岁患者因irAEs而停用ICIs的频率是<90岁患者的2倍多(30.9%vs. 15.1%)[45-46]。研究发现,不同年龄段NSCLC患者发生irAEs的具体类型不同,老年NSCLC患者发生的低级别irAEs(<2级)以皮肤毒性为主,而高级别(≥2级)irAEs主要累及心脏和肺[47],一旦并发严重免疫性心肌炎和免疫性肺炎,易继发多器官功能衰竭,带来极高的死亡风险。当怀疑老年NSCLC患者并发高级别irAEs时,应立即停用ICIs并尽快口服或静脉注射糖皮质激素(如甲强龙等)进行治疗。
意大利胸腔肿瘤学会(Italian Association of Thora-cic Oncology,AITO)国际专家小组会议讨论结果认为,现有数据支持老年晚期NSCLC患者单用ICIs,疗效优异且毒性尚能耐受。相比单药ICIs,免疫联合治疗导致irAEs的风险更高[48]。出于对irAEs的担忧,≥80岁晚期NSCLC患者应用免疫治疗可能缺乏生存获益[49]。因此笔者认为,老年晚期NSCLC患者可以选用ICIs治疗,但≥80岁高龄患者,应谨慎选择免疫治疗,尤其是双免疫或免疫联合化疗。
4 年龄和PS对老年NSCLC患者应用ICIs的影响
NSCLC多发生于老年患者,老年患者往往脏器功能退化、PS评分较差,那么对于老年NSCLC患者来说,影响ICIs疗效的究竟是年龄还是PS评分?笔者将针对这两类特殊人群展开论述。
已有临床研究开始探索特殊人群应用ICIs的疗效。CheckMate 153研究[50]根据PS≥2和年龄≥70岁分组,探讨两类特殊人群应用纳武利尤单抗的疗效。≥70岁分组患者的中位OS为10.3个月,但PS≥2分组的中位OS仅4个月。CheckMate 171研究[43]共纳入NSCLC患者811例,其中103例PS=2分、278例≥70岁、125例≥75岁,结果显示总体、≥70岁和≥75岁患者的中位OS大致相同(分别为10.0、10.0和11.2个月),但PS=2分人群的中位OS仅为5.2个月。针对ICIs在不同年龄层(<70、70~79和≥80岁)NSCLC患者的回顾性研究指出,高龄与ICIs疗效降低无关,影响疗效的唯一变量是PS评分[51]。汇总美国国家癌症研究所监测,流行病学和最终结果数据库(surveillance,epidemiology,and end results,SEER)数据库中应用ICIs治疗的1 256例年龄≥65岁NSCLC患者的大样本分析认为,较高的PS评分与患者死亡风险增加相关[52]。荷兰的大样本回顾性分析也指出,PS≥2的患者通常生存结局较差[18]。一项队列研究纳入75例>70岁NSCLC患者,PS<2和≥2分组中位OS分别为13.7个月和3.8个月,PS≥2分组的ICIs停用率、糖皮质激素使用率和治疗期间住院率相对更高[8]。
因此,高龄可能与较差预后无直接关联,PS评分或是影响预后的关键因素。PS≥2分患者不仅不能受益于ICIs治疗,反而可能由于irAEs出现导致OS显著降低。2022年,CSCO发布的《免疫检查点抑制剂特殊人群应用专家共识》[53]指出,老年肿瘤患者(65~75岁)接受ICIs的有效性和安全性与年轻患者相当,但超过75岁老年患者需要谨慎评估;老年患者致死性irAEs发生率较高,建议给予ICIs治疗前对其主要脏器功能、合并症、认知功能、营养状态、心理状态、社会支持及伴随用药等进行综合评估。笔者认为,无论年龄大小,只要患者PS评分较好(0~1分),ICIs都应纳入考虑,并且考虑到化疗的毒性,ICIs甚至是适用于老年患者的唯一治疗方案;PS=2分的患者或是ICIs治疗的潜在获益人群,但暂无高级别循证医学证据支持,建议结合患者治疗目标后谨慎使用;对PS≥3分的患者,不推荐给予ICIs治疗,可考虑使用支持治疗。
除了年龄和PS,还有许多其他因素可能影响老年晚期NSCLC患者对ICIs治疗的反应[54]。血液PD-L1 mRNA的动态表达对接受ICIs治疗的晚期NSCLC患者的临床获益具有预测价值[55]。一项汇总分析发现,衍生粒淋比(derive neutrophil-to-lymphocyte ratio,dNLR)[中性粒细胞数/(白细胞数-中性粒细胞数)]≥3和乳酸脱氢酶(lactatedehydrogenase,LDH)≥正常值上限是NSCLC患者生存的独立预后因素,作者进一步提出肺免疫预后指数(lung immune prognostic index,LIPI)评分,并证实LIPI评分与晚期NSCLC接受ICIs治疗的生存预后和疾病控制呈正相关[56]。驱动基因突变可能与ICIs疗效之间存在相关性,来自Immunotarget登记的结果表明,相比于EGFR突变或ALK突变,具有KARS基因突变和BRAF基因突变的患者从ICIs中生存获益更大[57]。此外,当NSCLC患者出现肝转移或恶性胸腔积液时,对ICIs治疗反应不佳[58-59]。
5 总结与展望
以ICIs为代表的免疫治疗在临床上取得显著成效,对包括NSCLC在内的多种肿瘤都具有良好的治疗效果。综合多项RCTs、荟萃分析、回顾性及真实世界研究结果,笔者认为对一般情况较好(PS<2分)的老年晚期NSCLC患者,可以使用ICIs单药、双ICIs以及ICIs联合化疗等方案,疗效优异且irAEs的发生率比化疗低;但随着年龄进一步增加,≥80岁高龄NSCLC患者应用ICIs疗效变差,且irAEs的发生率升高,因此高龄NSCLC患者应慎重选择ICIs治疗;更为重要的是,相较于年龄,PS评分或是影响预后的关键因素。鉴于我国正步入老龄化社会,老年肿瘤群体极大增加,未来需要开展评估老年晚期NSCLC患者免疫治疗疗效及安全性的真实世界研究和前瞻性临床研究,以期积累更多循证医学证据,突破老年晚期NSCLC的治疗现状,制定适合老年晚期NSCLC患者的最佳免疫治疗策略。

