基于UPLC-MSE 的白术化学成分分析及产地差异研究
杨 亮,于 洋,康舒宇,闫广利,孙 晖,王喜军
黑龙江中医药大学,经方与现代中药融合创新全国重点实验室,国家中医药管理局中医方证代谢组学研究中心,黑龙江哈尔滨 150040
白 术 为菊 科 植物白 术Atractylodes macrocephalaKoidz.的干燥根茎,始载于《神农本草经》,列为上品,具有补气健脾、固表止汗、燥湿利水、安胎之功效,多用于脾虚食少、腹胀泄泻、痰饮眩悸、水肿、自汗、胎动不安等症[1]。白术中主要含有倍半萜类、三萜类、聚乙炔类、香豆素类、苯丙烷类、黄酮类、苯醌和多糖类等化学成分[2]。现代研究表明,白术具有抗炎、抗肿瘤、抗凝血、抗抑郁、神经保护、调节免疫、调节胃肠运动和调节子宫平滑肌等多种药理作用[3-5]。
白术作为常用的大宗药材,其药用价值广泛,素有“北参南术”之称,在国家中医药管理局公布的首批百首经典名方中含有白术的方剂多达13 首[6]。白术主产于我国的浙江、湖南、安徽及河北等地,自古以浙江为道地产区,享有“浙八味”“磐五味”之一的美誉。但近年来浙白术产量已大幅度萎缩,目前以安徽、河北和湖南等产地为主[7]。但“土地所出,真伪陈新,并各有法”,受生长环境,土质以及气候的影响,不同产地的药材质量差异往往较大,其药材的质量直接影响到方剂的质量与疗效,因此评价不同产地白术药材的质量,优选产地是保证白术相关经方制剂质量的重要手段之一[8]。目前的研究多采用UPLC 指纹图谱[9]、三维[10]及多维荧光技术[11]、元素指纹分析技术[12]、GC-MS 指纹图谱[13]、近红外漫反射光谱技术[14]等对白术进行质量评价与产地鉴别研究,但这些分析方法尚不能全面、系统地表征不同产地白术药材的质量差异。
液质联用技术是一种集高效分离、高灵敏度与高选择性检测于一体的现代分离分析技术,可同时测定数十个甚至上百个成分,广泛用于中药材不同产地、不同品种、不同药用部位中次生代谢物或化合物差异性的鉴别分析[15-16]。本研究运用UPLCMSE技术全面分析白术药材的化学成分,通过多元统计分析出河北、安徽、浙江产区白术的差异化学成分及其变化规律,为白术的产地鉴别及质量评价提供参考,为筛选符合经方制剂开发要求的优质白术药材奠定基础。
1 仪器与材料
1.1 仪器
Waters AcquityTMUPLC 液相色谱仪(Waters 公司,美国);SynaptTMG2-Si 质谱分析系统(Waters公司,美国);Waters AcquityTMUPLC HSS T3 色谱柱(Waters 公司,美国);MassLynx V4.2 工作站(Waters 公司,美国);超声波清洗器KQ-500DB(昆山市超声仪器有限公司);低温超高速离心机ThermoSorvall ST16R(Thermo 公司,美国);电子分析天平(上海蒲春计量仪器有限公司);Progenesis QI V3.0(Waters 公司,美国);SIMCA14.1 软件(Umetrics,瑞典)。
1.2 试药
对照品腺苷(批号110879-202204)、白术内酯I(批号111975-201501)、白术内酯II(批号111976-201501)、白术内酯III(批号111978-201501)均购于中国食品药品检定研究院;所有对照品质量分数均≥98%;质谱纯乙腈(Thermo Fisher 公司,美国);色谱纯甲酸(赛默飞世尔科技有限公司);亮氨酸脑啡肽(Sigma 公司,美国);水为超纯水;其余试剂均为分析纯。
白术药材样品采自河北、安徽、浙江3 个产区,均由神威药业有限公司提供,经黑龙江中医药大学药学院吴修红教授鉴定为菊科植物白术A.macrocephalaKoidz.的干燥根茎。样品详细采集信息见表1。
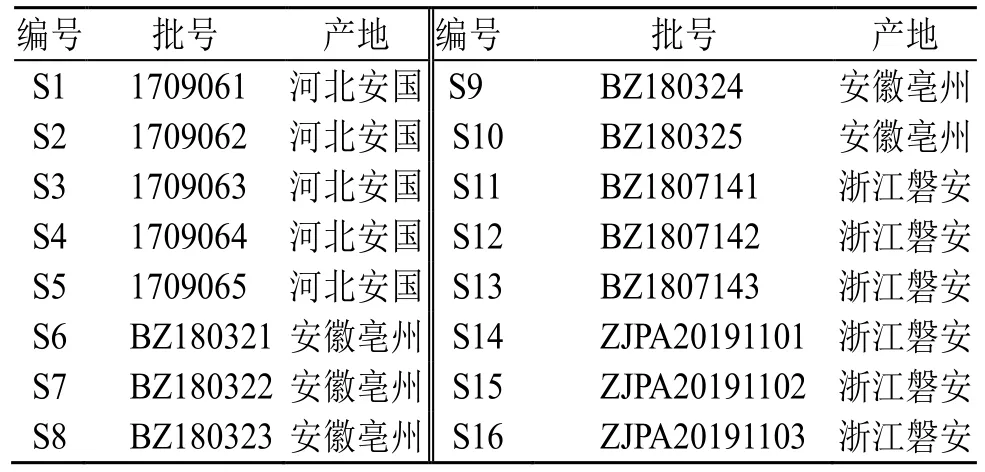
表1 白术样品信息Table 1 Sample information of A. macrocephala
2 方法
2.1 供试品溶液制备
取白术药材粉末(过四号筛)1 g,精密称定,置于50 mL 具塞锥形瓶中,精密加入75%甲醇20 mL,称定质量,超声提取1 h(250 W、40 kHz),取出放冷称定质量,以75%甲醇补足减失质量,摇匀,12 000 r/min 离心10 min,取上清液过0.22 μm微孔滤膜,取续滤液,即得。另等量吸取各供试品溶液400 μL,混匀,制成质量控制(quality control,QC)样品,用于监测分析系统和方法的稳定性。
2.2 对照品溶液的制备
精密称取腺苷、白术内酯I、白术内酯II、白术内酯III 对照品适量,分别置于10 mL 量瓶中,加甲醇溶解并定容至刻度,配制成质量浓度分别为20.012、20.008、20.017、20.011 μg/mL 的对照品溶液。
2.3 色谱条件
Waters AcquityTMUPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8 µm),流动相为0.1%甲酸乙腈溶液(A)-0.1%甲酸水溶液(B);梯度洗脱:0~7 min,1%~40% A;7~12 min,40%~70% A;12~16 min,70%~100% A;16~18 min,100% A;18~19 min,100%~1% A;19~21 min,1% A;柱温40 ℃;样品管理器温度10 ℃;体积流量0.4 mL/min;进样量3 μL。
2.4 质谱条件
采用电喷雾离子源(ESI),正、负离子模式检测,离子源温度110 ℃,脱溶剂气温度350 ℃,脱溶剂气流量700 L/h,锥孔气流量50 L/h,提取锥孔电压4.0 V,样品锥孔电压为35 V,正、负离子模式毛细管电压分别为2.8、3.0 kV。采用亮氨酸-脑啡肽溶液(Leucine Enkephalin,[M +H]+556.277 1、[M-H]-554.261 5)为质量锁定溶液。采用MSE模式采集数据,扫描时间为0.2 s,扫描范围为m/z50~1 200,质谱数据采集的碰撞能为10~35 V。
2.5 数据采集与分析
数据采集由MassLynx V4.2 工作站完成。应用Progenesis QI 分析软件对质谱数据进行处理分析,正离子模式下,化合物准分子离子以[M+H]+、[M+Na]+、[2M+H]+的形式被检测;负离子模式下,准分子离子以[M-H]-、[M+COO]-、[2M-H]-的形式被检测。通过分析各成分的保留时间、一级、二级质谱信息结合文献中报道的化合物裂解规律、同条件下对照品的裂解规律,并与构建的白术化学成分数据库、MassBank、PubChem 等在线数据库进行对比分析,完成化合物的识别鉴定。
多元统计分析:通过Progenesis QI 软件对质谱原始数据进行预处理,将处理后的数据导出到MetaboAnalyst 5.0 网站进行无监督的主成分分析( principal component analysis , PCA ), 再用SIMCA14.1 软件进行有监督的正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),依据OPLS-DA 中的变量重要性投影值(variable importance in projection,VIP)>3,结合单因素方差分析(P<0.05)筛选不同产地白术药材间具有显著性差异的化学成分。
3 结果与分析
3.1 白术药材化学成分的鉴定
按“2.3”和“2.4”项下方法进行数据采集,结果发现各产地白术样品的基峰强度色谱图(base peak intensity,BPI)大致轮廓较为相似,但色谱峰高度有所差异,提示各产地白术间化学成分的含量存在差异。按“2.5”项下方法分析,最终从白术药材中鉴定出53 个化学成分,代表性BPI 谱图见图1。
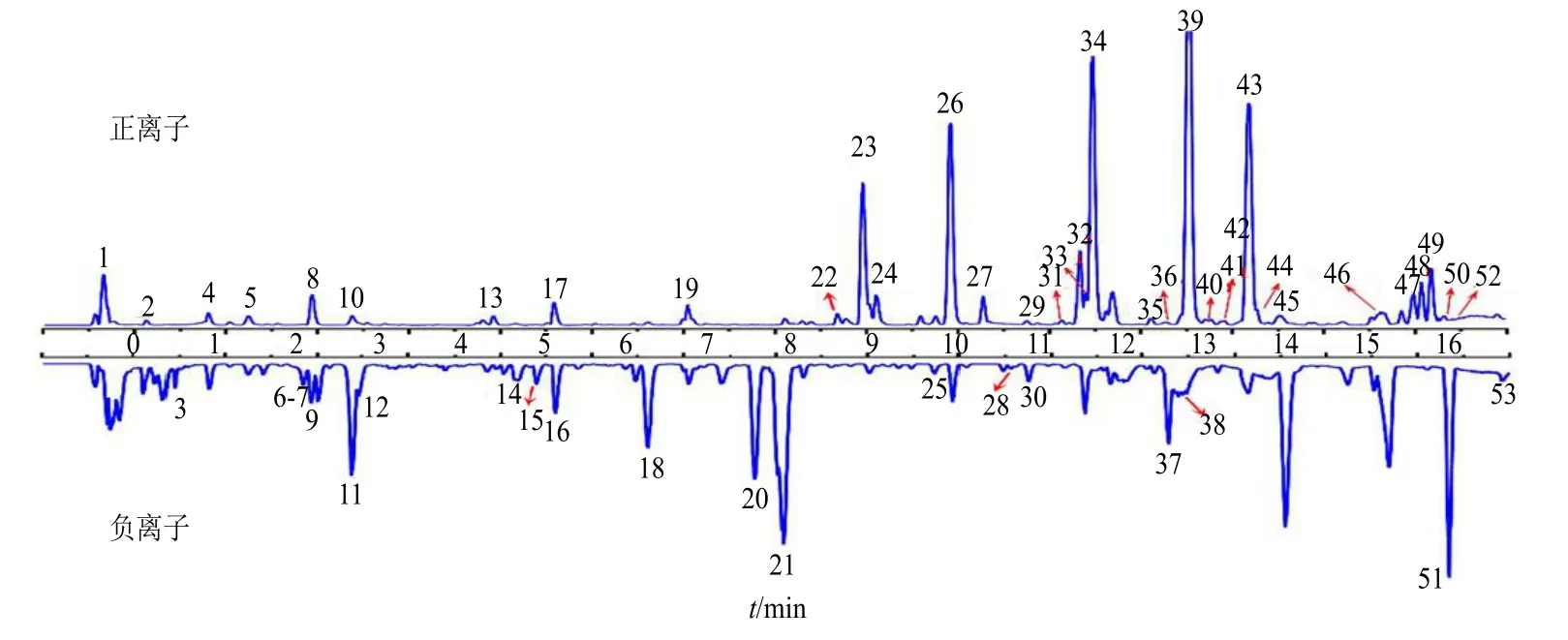
图1 正、负离子模式下白术药材的基峰强度色谱图Fig. 1 Basic peak intensity chromatogram of A. macrocephala in positive and negative ion modes
以白术内酯III 为例阐释化学成分裂解途径及规律的鉴定过程。首先,Progenesis QI 软件在9.95 min 时匹配到m/z249.153 4 [M+H]+的离子峰,其脱水形成m/z231.138 4 的碎片离子,碎片离子m/z231.138 4 丢失-CO、-C3H6、-C5H8形成203.142 4、189.088 4、163.076 8 的碎片离子,碎片离子m/z189.088 4 丢失-CH2形成碎片离子m/z175.075 5;碎片离子163.076 8 丢失-CO2形成m/z119.087 9 的碎片离子,再丢失-CH2形成m/z105.070 0 或丢失-C2H4形成m/z91.056 3,裂解过程与文献报道一致[17],二级质谱图及具体裂解途径如图2 所示。通过与白术内酯III 对照品比对,鉴定该化合物为白术内酯III。其他化合物采用相同方法鉴定,具体化合物详细信息见表2。
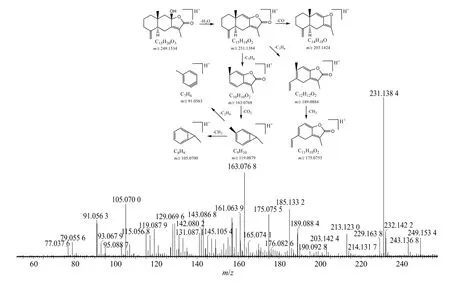
图2 白术内酯III 的二级质谱图及裂解途径Fig. 2 MS2 spectrum and fragmentation pathway of atractylenolide III
3.2 不同产地白术差异成分分析
3.2.1 PCA 主成分分析是一种无监督学习方法,它通过提取最重要的分析信息来降低数据集的维度[18]。运用PCA 的方法对不同数据组(包括质控样本)之间的关系进行评价,所有组的PCA得分图见图3。结果显示,QC 样品紧密聚集在一起,说明仪器稳定性良好,数据质量良好。3 个产地的白术样品均分别明显呈现出组内聚类,组间分离的趋势,表明不同产地白术样品化学成分间存在明显差异。
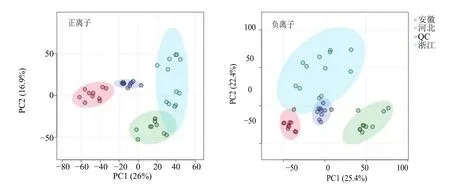
图3 正、负离子模式下不同产地白术药材的PCA 得分图Fig. 3 PCA scores plots of A. macrocephala from different origins in positive and negative ion modes
3.2.2 OPLS-DA OPLS-DA 可将组间差异最大化,在海量数据集中寻找存在于不同组别间的差异性成分,广泛用于不同产地药材之间的差异性研究[19-20]。在PCA 的基础上,本研究对每个产地与其他2 个产地的样品分别进行OPLS-DA,结果表明每个产地与其他2 个产地之间均表现出较明显的分离趋势,与PCA 结果一致,且组别间分离效果更加显著,见图4-A。在OPLS-DA 模型中,各模型组R2X(cum)、R2Y(cum)和Q2值均大于0.5,表明模型构建良好,预测性可靠。对OPLS-DA 进行验证,设定随机排列检验次数为200 次,见图4-B。结果显示,各组模型验证中原始R2和Q2均大于Y置换后相应的值,且Q2点的回归线在Y轴的截距小于0,说明模型预测能力好,不存在过拟合现象,可用于区分不同产地白术药材,模型具体相关参数见表3。散点得分图(S-plot)可以表示组间的差异成分,数据点离原点越远,则该变量对样本分组差异的贡献越大,利用S-plot 图可筛选出存在显著性差异(VIP>3)的化学成分,见图4-C。
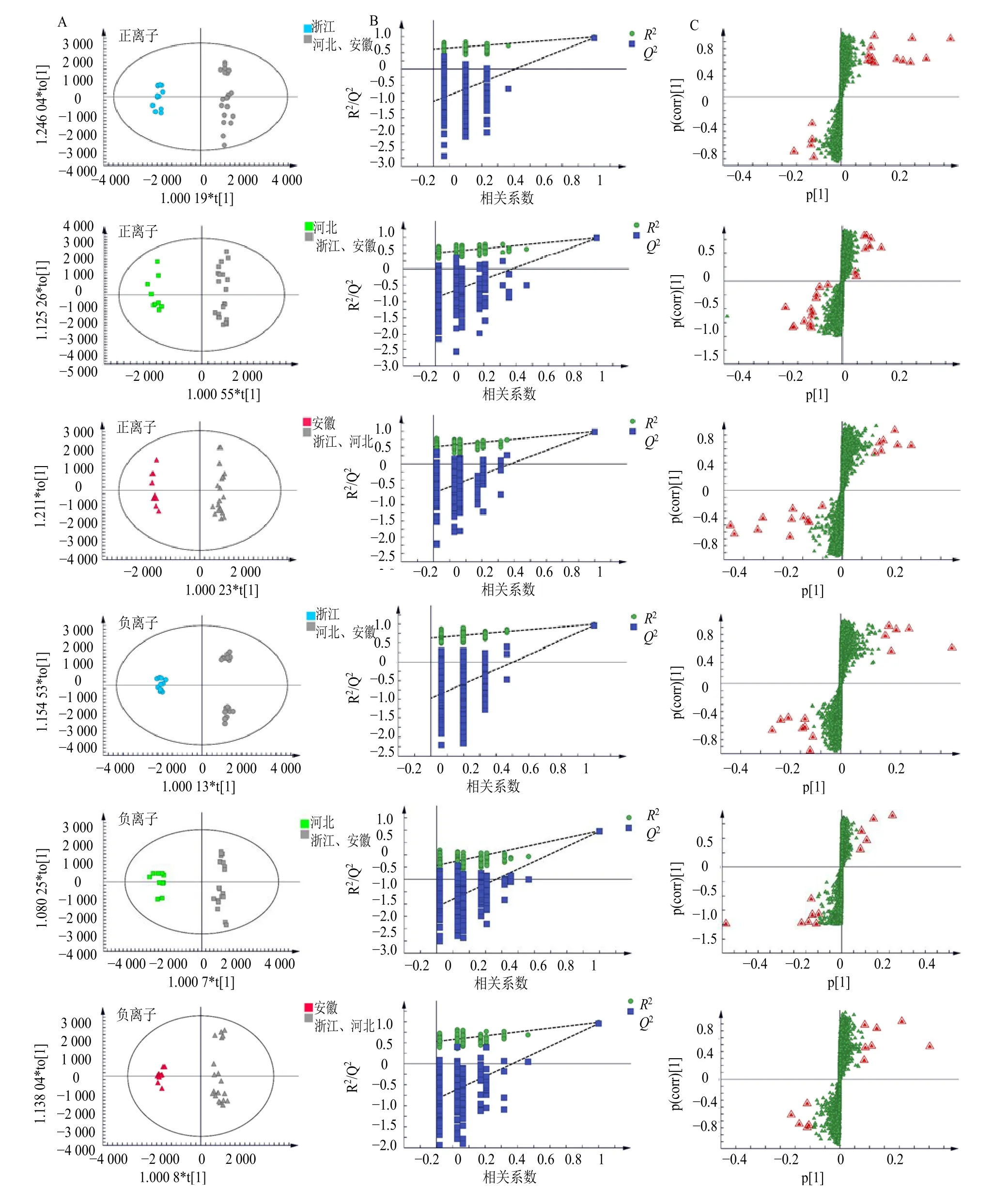
图4 正、负离子模式下不同产地白术药材的OPLS-DA 得分图、置换检验图及S-plot 图Fig. 4 OPLS-DA scores plot, permutation test polt and S-plot of A. macrocephala from different origins in positive and negative ion modes
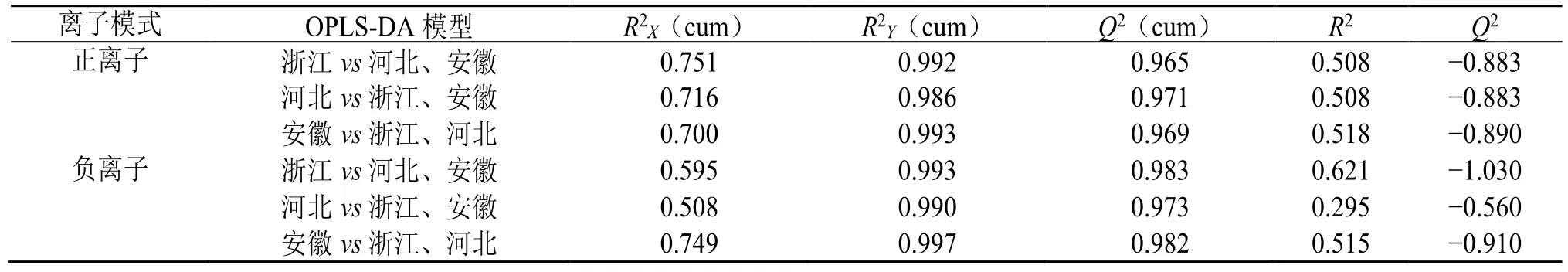
表3 OPLS-DA 模型参数Table 3 Model parameters of OPLS-DA
根据OPLS-DA 结果,以VIP 值>3,单因素方差分析P<0.05 为筛选标准,共表征出21 个差异化学成分,具体分为各产地的特有成分3 个及共有成分18 个,包括尿苷、腺苷、L-异亮氨酸、新绿原酸、L-缬氨酸、7-羟基香豆素、绿原酸、咖啡酸、8,9-epoxy atracolactone、4,6-二羟基-3,3a-二氢白术内酯III、6,9-二羟基-3,3a-二氢白术内酯III、furan sesquiterpene、9,10-环氧-12(Z)-十八碳烯酸、白术内酯III、白术内酰胺、白术内酯I、白术内酯II、芹子二烯酮、3β-乙酰氧基苍术酮、双白术内酯、棕榈酸等,各成分的量以各样品相对应的峰面积表示,见图5。其中河北安国产地具有1 个特有成分,为9,10-环氧-12(Z)-十八碳烯酸,且腺苷、6,9-二羟基-3,3a-二氢白术内酯III、furan sesquiterpene、白术内酯I、白术内酯II、双白术内酯的含量最高。安徽亳州产地具有1 个特有成分,为L-异亮氨酸,且新绿原酸、7-羟基香豆素、绿原酸、咖啡酸的含量最高。浙江磐安产地具有1 个特有成分,为白术内酰胺,且尿苷、L-缬氨酸、8,9-epoxy atracolactone、4,6-二羟基-3,3a-二氢白术内酯III、白术内酯III、芹子二烯酮、3β-乙酰氧基苍术酮、棕榈酸含量最高。这些差异成分均可作为区分不同产地白术的特征成分。
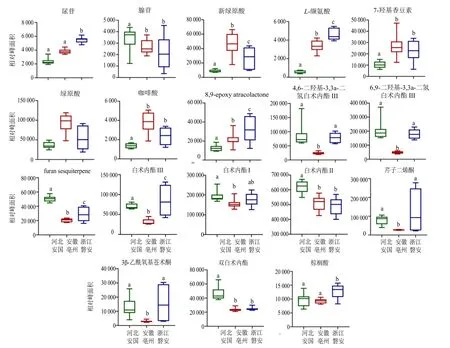
图5 不同产地白术药材差异化合物对比分析Fig. 5 Analysis of differential compounds in A. macrocephala from different origins
4 讨论
目前,《中国药典》2020 年版对白术的质量控制方法主要为定性鉴别,包括感官评价、显微鉴定与理化鉴别,无客观准确的量化指标,具有一定的局限性。目前的研究多以一种或几种白术内酯类成分的含量作为判断不同产地白术药材间质量差异的指标,而中药为复杂的化学体系,仅靠几个指标性成分不能全面体现其品质差异[21-[2]]。本研究采用UPLC-MSE技术准确快速地对河北、安徽、浙江产区白术药材进行分析,鉴定出53 个化学成分并通过多元统计分析方法表征出21 个差异性成分,包括18 个共有差异成分及3 个特有成分。在河北安国产地中腺苷、6,9-二羟基-3,3a-二氢白术内酯III、furan sesquiterpene、白术内酯I、白术内酯II、双白术内酯的含量最高。安徽亳州产地中新绿原酸、7-羟基香豆素、绿原酸、咖啡酸的含量最高。浙江磐安产地中尿苷、L-缬氨酸、8,9-epoxy atracolactone、4,6-二羟基-3,3a-二氢白术内酯III、白术内酯III、芹子二烯酮、3β-乙酰氧基苍术酮、棕榈酸含量最高。黄小方等[24]采用UPLC-MS 技术对不同产地白术药材进行分析,发现各产地药材的差异主要体现在白术内酯类成分上。已有的对白术中化学成分含量检测的研究显示,不同产地白术在白术内酯类及有机酸类成分含量上存在一定差别[25-[3]]。本研究采用UPLC-MSE整体化学成分分析所得到的差异化学成分与文献报道一致性较高。此外,本研究还确定了9,10-环氧-12(Z)-十八碳烯酸为河北安国产地的特有成分,L-异亮氨酸为安徽亳州产地的特有成分,白术内酰胺为浙江磐安产地的特有成分,这些特有成分可作为产地区分的依据。上述分析提示,不同产地白术药材因所处的气候、土壤、地势地貌等环境不同,在化学成分的种类及含量上产生了很大变化,即生成了特有成分与共有成分,提示白术的质量与其产地密切相关。
本研究发现浙江、河北产白术的白术内酯类成分含量明显高于安徽产地。研究表明,倍半萜类化合物是白术中含量最丰富的生物活性成分之一,其中白术内酯类成分已被证明具有显著的抗肿瘤、抗菌、抗炎、调节免疫、调节胃肠道功能和神经保护作用[28];双白术内酯可通过抑制活性氧生成来减少损伤细胞的死亡,从而发挥抗阿尔茨海默病的作用[29-30];芹子二烯酮、3β-乙酰氧基苍术酮具有抗炎作用[31]。而安徽产地的有机酸类化合物如绿原酸、新绿原酸等的含量高于其他两产地,上述成分具有抗氧化、抗菌、抗病毒、抗肿瘤、调血脂、降血糖和免疫调节等多方面的药理作用[32-33]。以上分析提示不同产地白术药材间的差异化学成分可能对其生物活性产生影响,进而影响其功效及配伍情况下的疗效,后续可结合不同层次的药效学实验进行阐释与验证,为临床依据不同病症、不同产地药材合理的调整用药提供更好的指导。
本实验基于河北、安徽、浙江3 个产区的白术药材展开研究,对不同产地白术药材的差异性进行分析,找出其特有成分及共有差异成分,为白术的产地鉴别及质量评价提供了重要参考,也为后续含白术的经典名方开发、中药质量标志物研究及药材质量标准的制定提供科学依据和理论支撑。
利益冲突所有作者均声明不存在利益冲突

