牛蒡子-甘草药对指纹图谱的建立及其抗炎活性谱效关系研究
邢耀莹 ,王姿杨 ,王 露 ,杨苗苗 ,庞 哲 ,赵 宁 ,崔治家 ,邵 晶 ,
1. 甘肃中医药大学,甘肃 兰州 730000
2. 西北中藏药省部共建协同创新中心,甘肃 兰州 730000
3. 国家中医药管理局三级实验室(中药化学重点实验室),甘肃 兰州 730000
4. 甘肃省中医药研究中心,甘肃 兰州 730000
5. 甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000
6. 甘肃省中药制药工艺工程研究中心,甘肃 兰州 730000
药对是中药配伍组方的基本单位之一,通过组方的配伍分解,从阐释药对的药效物质基础和作用机制入手,是能有效、全面地阐释中药复方的重要途径之一[1]。牛蒡子、甘草2 药作为基本药对配伍历史悠久,独立成方使用最早见《太平圣惠方》中记载:“牛蒡子散,牛蒡子1 两(微炒)、甘草1 分(炙微赤,锉),治口疮久不愈”[2]。后经《证类治裁》《奇效良方》《本草纲目》等多部中医药典籍进行转载后形成了应用主治各异的新处方,如明代《痘治理辨》中记载“牛蒡子甘草散,牛蒡子(麸炒)1 两、甘草(炙)1 钱,麻痘初作,服此则稀”[3];清代《杂病源流犀烛》中记载“甘草鼠粘汤,甘草1 两、鼠粘根2 两,主治肺热,咽喉痛”等[4-5]。现今常用的中药复方如银翘散、五福化毒丸、羚羊感冒片等中也多含有牛蒡子-甘草药对,证明了牛蒡子-甘草药对配伍使用的广泛性和临床有效性[6-7]。其中牛蒡子辛苦而寒,具有疏散风热、宣肺透疹、解毒利咽之功[8],甘草甘平,能够清热解毒、润肺止咳、缓急止痛等[9],2 药相伍,清补合法。现代研究表明牛蒡子、甘草均具有抗炎、抗病毒、免疫调节等作用,与牛蒡子含有的木脂素类(牛蒡苷、牛蒡苷元)、绿原酸类(绿原酸A、B、C)等成分以及甘草含有黄酮类(甘草素、异甘草素、甘草查耳酮A)和三萜皂苷类(甘草酸、甘草次酸)等成分密切相关[10-11]。
炎症反应是机体对外界物理、化学或生物刺激及感染、内源组织损伤等做出的防御性免疫反应,广泛发生于机体的细胞、组织和器官等[12]。依据其发生程度和持续时间的不同分为急性炎症和慢性炎症,急性炎症持续时间较短,如局部组织损伤所致的发热、红肿、疼痛等。慢性炎症持续时间较长,炎症因子的长期异常分泌会导致关节炎、糖尿病、自身免疫性疾病以及肿瘤等多种炎症性疾病的发生[13]。当机体处于过度炎症的环境下,巨噬细胞通过释放大量炎症因子来调控炎症反应,如一氧化氮(nitric oxide,NO)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)等[14]。脂多糖为革兰阴性菌细胞壁的主要成分,能够刺激巨噬细胞释放炎症因子,常作为构建RAW264.7 巨噬细胞炎症模型的常用试剂,且该模型作为筛选抗炎药物的经典模型被广泛应用[15]。目前有关牛蒡子、甘草的报道主要聚焦于各单味药材的研究,而对于2 药配伍使用的药效物质基础及作用机制研究较少,探讨其抗炎活性具有实际意义。
如何全面地反映牛蒡子-甘草药对抗炎活性成分的关键在于探索牛蒡子-甘草药对的抗炎作用物质基础。中药谱效学以中药指纹图谱为研究基础,与药效评价相结合,并应用生物信息学方法建立谱-效相关性分析,可为揭示中药药效物质提供科学依据[16]。本研究基于牛蒡子、甘草药对临床应用的历史有效性和广泛性,以收集到的18 批样品研究建立牛蒡子-甘草药对HPLC 指纹图谱,以脂多糖刺激RAW264.7 细胞制备炎性细胞,分析HPLC 共有峰与炎性指标间的谱效相关性,以期为牛蒡子-甘草药对抗炎的有效成分群的阐释及药效学机制研究提供科学基础,为进一步开发利用该药对提取物的质量评价提供参考,也为含有该药对的中药复方药效物质基础及作用机制的全面阐释提供研究基础和思路方向。
1 材料
1.1 细胞
RAW264.7 细胞株(批号JF4RFYWU3S)购自武汉普诺赛生命科技有限公司。
1.2 药材
炒牛蒡子、甘草药材购自不同生产厂家,以同一厂家药材为原则进行配对,经甘肃中医药大学崔治家教授分别鉴定为菊科牛蒡属植物牛蒡Arctium lappaL.的干燥成熟果实和豆科甘草属植物甘草GlycyrrhizauralensisFisch.的干燥根和根茎。具体信息见表1。
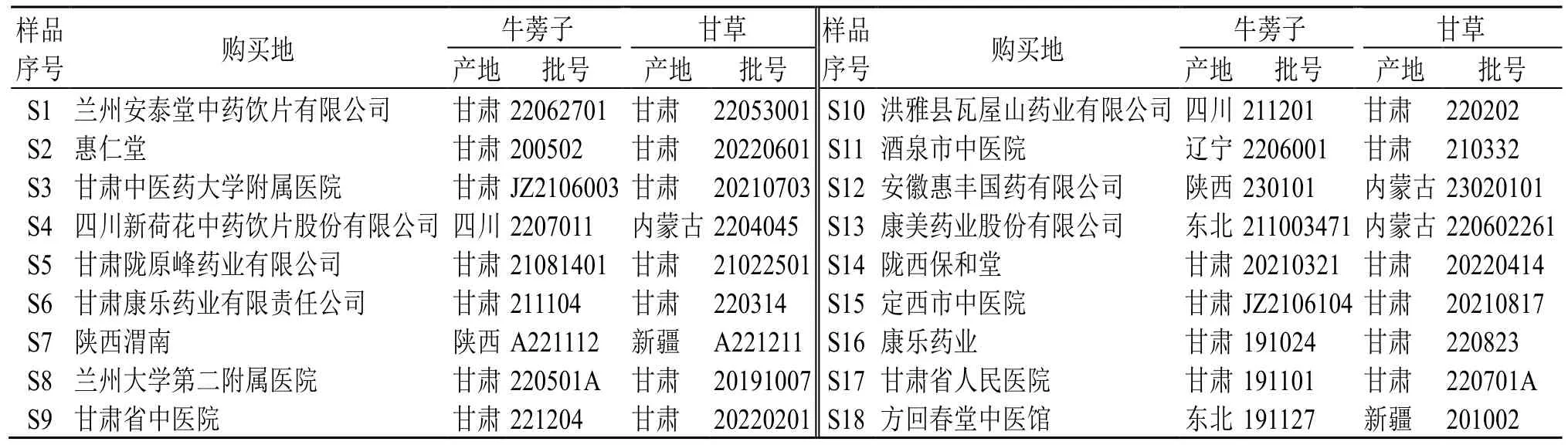
表1 牛蒡子-甘草样品信息Table 1 Information of Arctii Fructus-Glycyrrhizae Radix et Rhizoma samples
1.3 试剂
甲醇(批号20220103)、乙腈(批号20221005)、甲酸(批号20280825)为色谱纯,均购自天津市大茂化学试剂厂;95%乙醇(批号20190301)为分析纯,购自天津市富宇精细化工有限公司;对照品异甘草苷(批号Y15A10H95344)、异绿原酸B(批号AF20060701)、甘草素(批号C26A10Q87040)、异绿原酸A(批号AF20020302)、甘草查耳酮A(批号 A19GB145817 )、 牛蒡苷元( 批号Y26D6Y17483)、甘草酸(批号Y02J11L113432)、甘草苷(批号Z07J12X136344)、牛蒡子苷(批号Z11D6B7394)、异甘草素(批号H03D9Z76567)、绿原酸(批号 B20782)、异绿原酸 C(批号AF20121801)、甘草次酸(批号B31O9D73752)均购自上海源叶生物科技有限公司,质量分数均≥98%;脂多糖(批号820F036)、MTT(批号917Q054)、二甲基亚砜(dimethyl sulfoxide,DMSO,批号1121E0324)、PBS 缓冲液(批号P1020)购自北京索莱宝科技有限公司;RAW264.7 细胞专用培养基(批号WHAA23E072)购自武汉普诺赛生命科技有限公司。
1.4 仪器
Waters e2695 型高效液相色谱仪(美国Waters公司);BS110S 型电子分析天平(北京赛多利斯仪器系统有限公司);SB-5200DTD 型超声波清洗机(宁波新芝生物科技股份有限公司);AP-01P 型真空泵(天津奥特塞恩斯仪器有限公司);800Y 型高速多功能粉碎机(永康市铂欧五金制品有限公司);OHG-9070B 型智能电热恒温鼓风干燥箱(上海琅实设备有限公司);Benchmark plus 型酶标仪(上海新振仪器设备有限公司);CKX41+DP21 型倒置显微镜(日本Olympus 公司);CPY-180 型CO2培养箱(美国Thermo Fisher Scientific 公司);IC1000 型Countstar 自动细胞计数仪(上海睿钰生物科技有限公司)。
2 方法与结果
2.1 指纹图谱的建立
2.1.1 对照品溶液的制备 分别精密称定绿原酸、甘草苷、异绿原酸B、异绿原酸A、异绿原酸C、异甘草苷、牛蒡子苷、甘草素、甘草酸、异甘草素、牛蒡苷元、甘草查耳酮A、甘草次酸对照品适量,加甲醇制成质量浓度分别为40、48、36、48、44、40、44、48、44、40、40、44、40 μg/mL 的混合对照品溶液。
2.1.2 供试品溶液的制备 精密称定炒牛蒡子、甘草饮片粉末(过3 号筛)各2 g,于具塞锥形瓶中,移液管量取80 mL 95%乙醇加入,称定质量,45 ℃超声提取30 min(40 kHz、250 W),补足减失的质量后抽滤,取续滤液5 mL,水浴挥干溶剂,经同体积甲醇复溶后即得供试品溶液;余量滤液挥干溶剂,干浸膏留存。
2.1.3 色谱条件[17]色谱柱为Agilent SB-C18色谱柱(250 mm×4.6 mm,5 μm);检测波长254 nm;体积流量0.5 mL/min;柱温25 ℃;进样量10 μL;流动相为乙腈-0.2%甲酸水溶液,梯度洗脱:0~5 min,20%乙腈;5~15 min,20%~25%乙腈;15~20 min,25%~27%乙腈;20~25 min,27%~29%乙腈;25~35 min,29%~31%乙腈;35~40 min,31%~33%乙腈;40~45 min,33%~50%乙腈;45~50 min,50%~52%乙腈;50~70 min,52%~54%乙腈;70~75 min,54%~55%乙腈;75~80 min,55%~57%乙腈;80~95 min,57%~80%乙腈;95~105 min,80%~90%乙腈;105~110 min,90%乙腈。
2.2 方法学考察
2.2.1 精密度试验 取“2.1.1”项下混合对照品溶液,按“2.1.3”项下色谱条件连续进样测定6 次,以响应值较大且分离度较好的第7 个峰为参照峰,计算得13 种对照品相对峰面积的RSD 均小于3%,结果显示所用仪器的精密度较好。
2.2.2 重复性试验 取同一牛蒡子-甘草药对(S1),按“2.1.2”项下方法制备6 个平行供试品溶液,依据“2.1.3”项下色谱条件进样测定,以响应值较大且分离度较好的第7 个峰为参照峰,计算得13 种成分相对峰面积的RSD 均小于3%,说明所选用的色谱方法具有较好的重复性。
2.2.3 稳定性试验 取同一牛蒡子-甘草药对(S1)供试品溶液分别于0、2、4、8、12、24 h 按“2.1.3”项下方法进样测定,以响应值较大且分离度较好的第7 个峰为参照峰,计算得13 种成分相对峰面积的RSD 均小于3%,表明所制备的供试品溶液在24 h内质量稳定。
2.3 指纹图谱的建立及相似度评价
2.3.1 指纹图谱的生成 取18 批牛蒡子-甘草药对样品(S1~S18),按“2.1.2”项下方法依次制备供试品溶液,按“2.1.3”项下色谱条件进样测定。测定结果导出为TXT 格式,依次导入《中药色谱指纹图谱相似度评价系统》(2012 年版)软件,得到18批样品(S1~S18)的叠加图谱。采用中位数法,时间宽度为0.2 min,以S1 作为参照图谱,经多点校正后采用mark 峰匹配,共确定38 个共有峰,生成对照图谱,见图1。
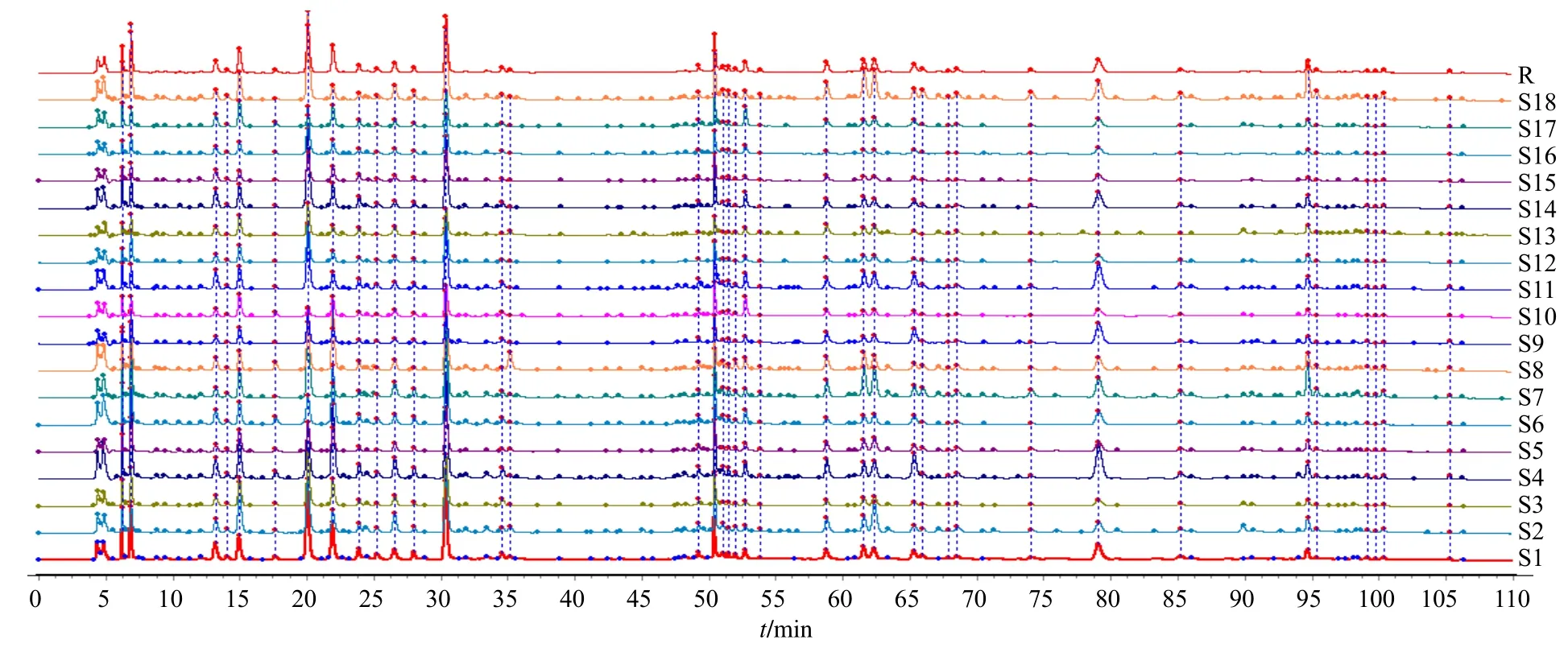
图1 18 批牛蒡子-甘草药对样品 (S1~S18) 的指纹图谱叠加图及其对照指纹图谱 (R)Fig. 1 Fingerprint overlay of 18 batches of Arctii Fructus-Glycyrrhizae Radix et Rhizoma drug pair samples (S1—S18) and their control fingerprints (R)
2.3.2 相似度评价 选择分离度好、含量较高的38个色谱峰作为牛蒡子-甘草药对的指纹图谱共有特征峰,以对照指纹图谱为参照,对18 批牛蒡子-甘草药对指纹图谱的相似度评价见表2,从表中可以看出,牛蒡子-甘草药对的指纹图谱相似度均>0.7,表明所建立的指纹图谱方法可用于牛蒡子-甘草药对的整体质量控制。

表2 18 批牛蒡子-甘草药对共有模式相似度Table 2 Similarity of common pattern between 18 batches of Arctii Fructus-Glycyrrhizae Radix et Rhizoma drug pair
2.4 共有峰的指认与分析
2.4.1 共有峰的指认 取“2.1.1”项下的混合对照品溶液,按“2.1.3”项下色谱条件进样测定,得混合对照品溶液色谱图(图2)。通过与供试品溶液出峰的保留时间比对,可指认牛蒡子-甘草药对共有峰F2、F5~F8、F11、F13、F15、F17、F20、F21、F26、F35 分别为绿原酸、甘草苷、异绿原酸B、异绿原酸A、异绿原酸C、异甘草苷、牛蒡子苷、甘草素、甘草酸、异甘草素、牛蒡苷元、甘草查耳酮A、甘草次酸。

图2 混合对照品色谱图Fig. 2 Chromatogram of mixed control
2.4.2 聚类分析 聚类分析能够从整体角度分析并比较不同样品间的相似性,排除相关性较差变量的影响[18]。对18 批牛蒡子-甘草药对的数据采用聚类分析法[19]进行分析以探索其差异性。使用SPSS 26.0软件,以18 批牛蒡子-甘草药对指纹图谱的38 个共有峰的峰面积作为变量,选择平方欧式距离为测度,采用组间均联法进行系统聚类,对其进行聚类分析。结果显示,当平方欧式距离为10 时,18 批样品可以被分为3 类,S7、S18、S1、S14、S11、S2、S6、S8 为第1 类,S10、S17、S12、S16、S13、S15、S5、S9、S3 为第2 类,S4 为第3 类,聚类分析树状图见图3。

图3 聚类分析树状图Fig. 3 Cluster analysis tree diagram
2.4.3 主成分分析(principal component analysis,PCA) PCA 能将多个指标转化为少数几个主成分,这些主成分是原始变量的线性组合,且彼此之间互不相关,可以直观显示出不同样品之间的整体差异性,进一步寻找不同批牛蒡子-甘草药对质量的差异性变量[20]。将18 批牛蒡子-甘草药对指纹图谱的38个共有峰的峰面积作为变量,结合SIMCA 14.1与SPSS 26.0 软件对其进行PCA,以特征值>1,自动得到5 个主成分,累积方差贡献率为92.272%,相关信息见表3,结合总方差解释结果,观察碎石图(图4),当折线由陡峭突然变得平稳时,陡峭到平稳对应的因子个数即为参考提取因子个数。结果表明,5 个主成分能够充分体现38 个共有峰的基本特征值和主要信息,可以作为牛蒡子-甘草药对质量的差异性变量反映其整体质量,具有进一步研究的意义。

图4 公因子碎石图Fig. 4 Common factor lithotripsy diagram

表3 主成分特征值和方差贡献率Table 3 Eigenvalues and variance contribution rates of principal component
主成分载荷矩阵反映了各变量对主成分的贡献大小和作用方向[21]。依据表4 可以看出38 个共有峰中F2~F4、F7、F22~F25、F27~F30、F32~F34、F36、F37 位于第1 个主成分上有较高的载荷,F3、F4、F7~F10、F12、F13、F14、F16、F17~F19、F33 位于第2 个主成分上有较高的载荷,F12、F14、F19、F21、F22、F26、F31、F38 位于第3 个主成分上有较高的载荷,F1、F6、F8、F15、F20、F35 位于第4 主成分上有较高的载荷,F5、F11、F22 位于第5 主成分上有较高的载荷,主成分含义较清晰,说明影响样品质量差异的并不是单一成分,而是由多个成分聚集产生作用,对应中药治疗疾病多成分、多靶点的特点。选择6 个主成分进行PCA,绘制主成分得分图,结果见图5,样品总体可聚为2 类(S4与S13 为离群样品),与聚类分析结果基本一致,样品间产生差异可能与采收季节、产地加工和炮制等相关。进一步根据各主成分值及贡献率分别计算综合得分,评价18 批牛蒡子-甘草药对样品的质量,结果见表5,综合得分的排名反映出18 批牛蒡子-甘草药材的质量差异,排名越高质量越好。
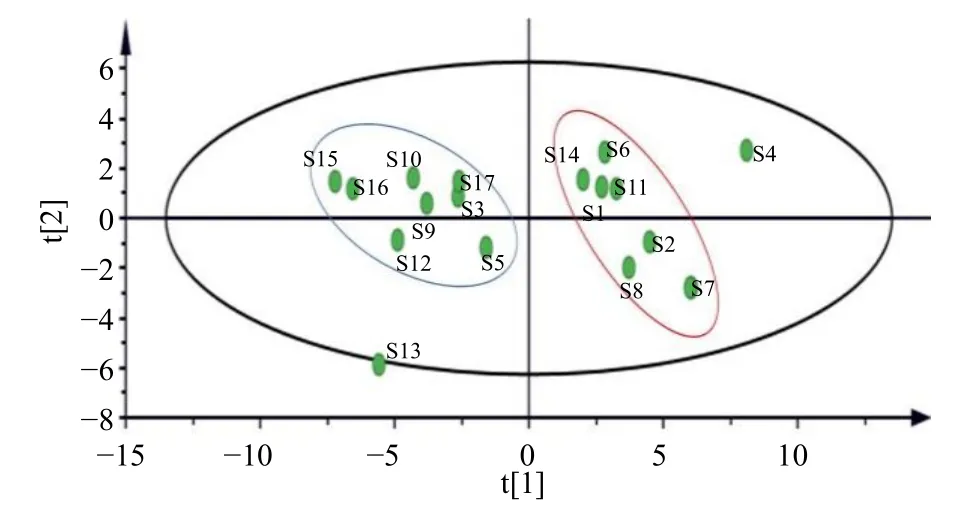
图5 主成分得分图Fig. 5 Principal component score chart
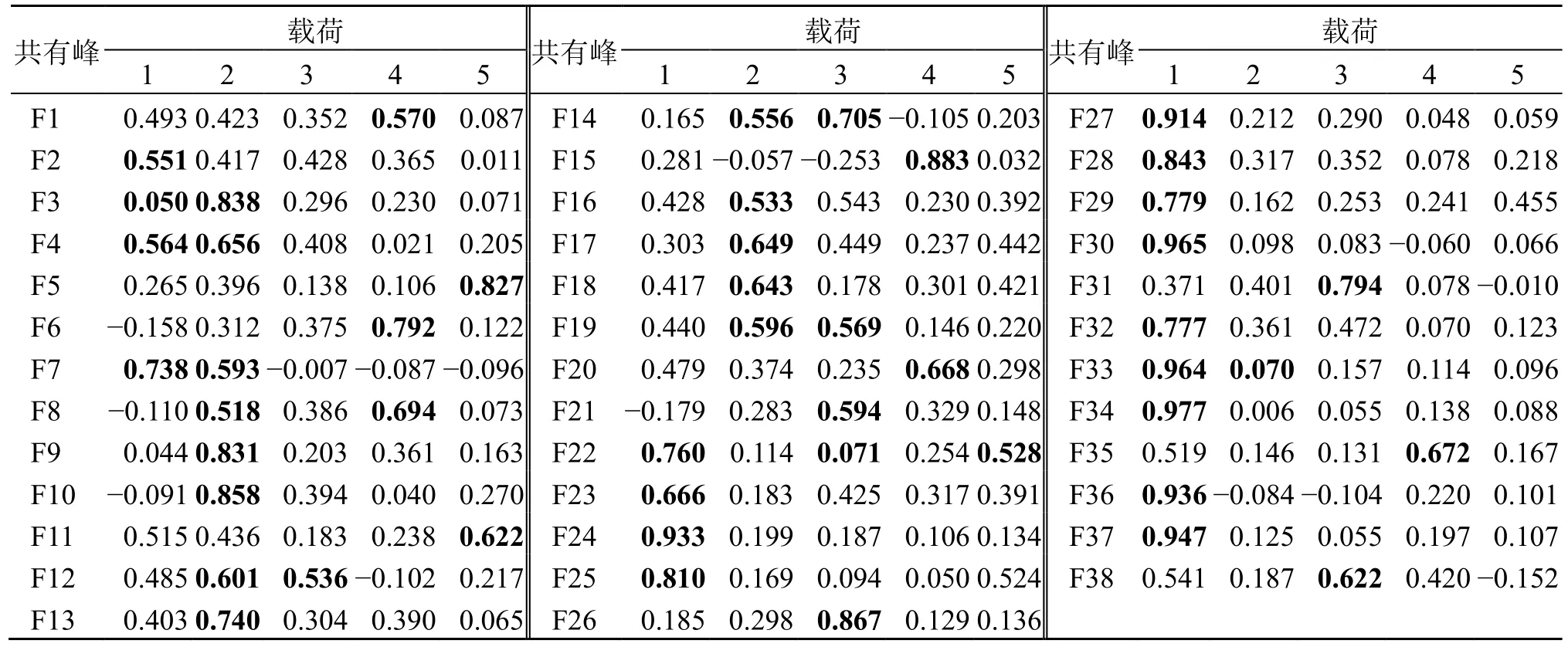
表4 主成分矩阵Table 4 Principal component matrix
2.5 18 批牛蒡子-甘草对脂多糖所致RAW264.7 细胞炎症模型的影响
2.5.1 细胞培养 RAW264.7 细胞采用专用培养基,于37 ℃、5% CO2的细胞培养箱中培养。
2.5.2 样品制备 取“2.1.2”项下留存干浸膏(样品S1),加入专用培养基配制成2 mg/mL(含0.1%DMSO)的样品母液,过0.22 μm 微孔滤膜,备用。
2.5.3 牛蒡子-甘草对RAW264.7 细胞活性的影响取处于对数生长期的RAW264.7 细胞,调整细胞密度为1.5×105~2.0×105个/mL,每孔200 μL 接种于96 孔板中(空白组为200 μL 完全培养基),37 ℃、5% CO2培养箱中培养过夜,弃去孔中原培养液,空白组与正常组加入200 μL 完全培养基,给药组分别加入含2.0、1.8、1.6、1.4、1.2、1.0、0.8、0.6、0.4、0.2 mg/mL 牛蒡子-甘草药对95%乙醇总提物的完全培养基,每组5 个复孔,培养24 h 后,各孔加5 mg/mL MTT 溶液20 μL,置于CO2培养箱中继续培养4 h,弃去各孔上清液,加入150 μL DMSO,振荡混匀15~20 min,待各孔中紫色结晶完全溶解,于570 nm 处测定吸光度(A)值,计算细胞存活率。
细胞存活率=(A给药-A空白)/(A正常-A空白)
采用GraphPad Prism 9 软件进行统计学分析,结果见表6。当牛蒡子-甘草药对95%乙醇总提物质量浓度高于1.0 mg/mL 时,细胞存活率低于90%;当牛蒡子-甘草药对95%乙醇总提物质量浓度为0.2~0.8 mg/mL 时,细胞存活率大于90%且随质量浓度变化趋势小,可以为后续实验提供依据。
表6 牛蒡子-甘草药对95%乙醇总提物对RAW264.7 细胞活力的影响 (±s, n = 5)Table 6 Effect of Arctii Fructus-Glycyrrhizae Radix et Rhizoma drug pair on 95% alcohol total extract on RAW264.7 cell viability (±s, n = 5)
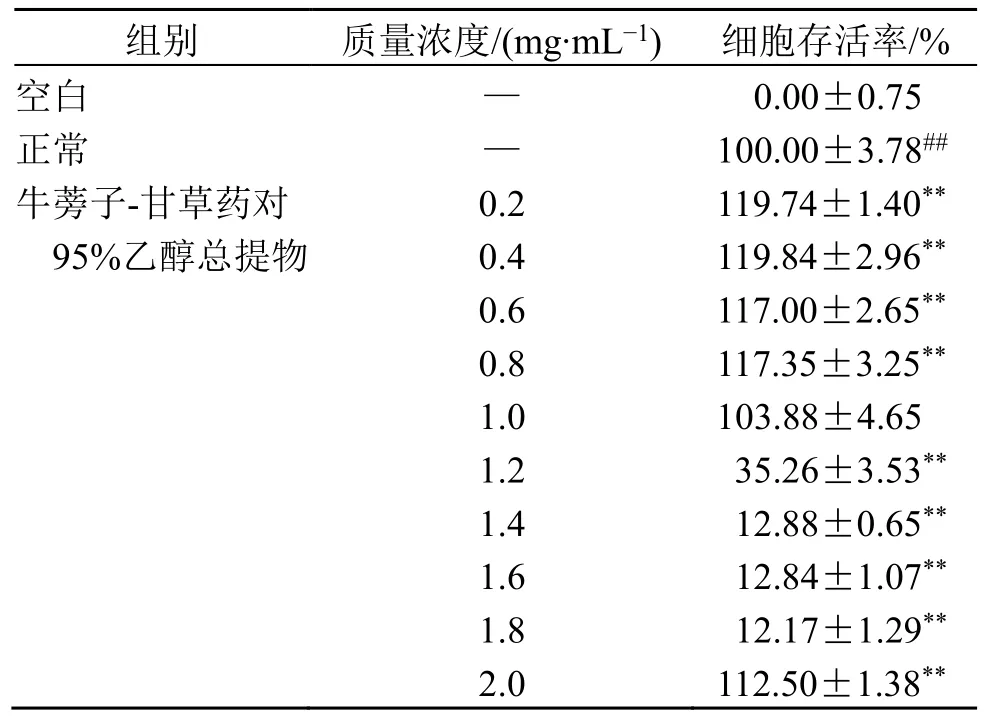
表6 牛蒡子-甘草药对95%乙醇总提物对RAW264.7 细胞活力的影响 (±s, n = 5)Table 6 Effect of Arctii Fructus-Glycyrrhizae Radix et Rhizoma drug pair on 95% alcohol total extract on RAW264.7 cell viability (±s, n = 5)
与空白组比较:##P<0.01;与对照组比较:**P<0.01。##P < 0.01 vs blank group; **P < 0.01 vs control group.
组别 质量浓度/(mg·mL-1) 细胞存活率/%空白 — 0.00±0.75正常 — 100.00±3.78##牛蒡子-甘草药对 0.2 119.74±1.40**95%乙醇总提物 0.4 119.84±2.96**0.6 117.00±2.65**0.8 117.35±3.25**1.0 103.88±4.65 1.2 35.26±3.53**1.4 12.88±0.65**1.6 12.84±1.07**1.8 12.17±1.29**2.0 112.50±1.38**
2.5.4 不同质量浓度牛蒡子-甘草药对95%乙醇总提物对脂多糖诱导的RAW264.7 细胞分泌NO 的影响 取处于对数生长期的RAW264.7 细胞,调整细胞密度为1.5×105~2.0×105个/mL,每孔200 μL接种于96 孔板中,37 ℃、5% CO2培养箱中培养过夜,弃去孔中原培养液,正常组加入200 μL 专用培养基,模型组加入200 μL 含脂多糖(1 μg/mL)专用培养基,给药组分别加入200 μL 0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1 mg/mL 牛蒡子-甘草药对95%乙醇总提物含脂多糖(1 μg/mL)专用培养基,每组设置3 个复孔,5% CO2、37 ℃培养箱中培养24 h,按相关试剂盒说明书操作,检测细胞分泌NO 水平。采用GraphPad Prism 9 软件进行统计学分析,计量资料以±s表示,多组间比较采用单因素方差分析。
由表7 可知,与正常组比较,模型组NO 含量明显上升(P<0.01);与模型组比较,牛蒡子-甘草药对95%乙醇总提物干预后在质量浓度0.2~0.8 mg/mL 内NO 含量降低(P<0.01),并呈剂量相关性。为尽可能准确筛选牛蒡子-甘草药对抗炎活性有效成分群,设定给药质量浓度为0.8 mg/mL 进行后续18 批牛蒡子-甘草药对95%乙醇总提物抗炎谱效相关性研究。
表7 牛蒡子-甘草药对95%乙醇总提物对脂多糖诱导的RAW264.7 细胞分泌NO 的影响 (±s, n = 3)Table 7 Effect of Arctii Fructus-Glycyrrhizae Radix et Rhizoma drug pair on secretion of NO from lipopolysaccharide-induced RAW264. 7 cells (±s, n = 3)

表7 牛蒡子-甘草药对95%乙醇总提物对脂多糖诱导的RAW264.7 细胞分泌NO 的影响 (±s, n = 3)Table 7 Effect of Arctii Fructus-Glycyrrhizae Radix et Rhizoma drug pair on secretion of NO from lipopolysaccharide-induced RAW264. 7 cells (±s, n = 3)
与正常组比较:##P<0.01;与模型组比较:**P<0.01,表8 同。##P < 0.01 vs normal group; **P < 0.01 vs model group, same as Table 8.
组别 质量浓度/(mg·mL-1) NO/(μmol·L-1)正常 — 5.17±0.13模型 — 11.53±0.27##牛蒡子-甘草药对 0.1 11.13±0.23 95%乙醇总提物 0.2 10.11±0.28**0.3 9.20±0.13**0.4 8.34±0.14**0.5 7.93±0.16**0.6 7.72±0.15**0.7 7.46±0.13**0.8 7.38±0.07**
2.5.5 体外抗炎实验 按“2.5.2”项下方法制备样品溶液,得到18 批牛蒡子-甘草药对95%乙醇总提物,按照相关试剂盒说明书操作,检测细胞NO 水平。结果见表8,与正常组比较,模型组NO 分泌量升高(P<0.01);与模型组比较,18 批样品均能不同程度降低RAW264.7 炎性细胞的NO 分泌量。
表8 18 批牛蒡子-甘草药对95%乙醇总提物对NO 分泌量的影响 (±s, n = 3)Table 8 Effect of 18 batches of Arctii Fructus-Glycyrrhizae Radix et Rhizoma drug pair on 95% total alcohol extract on NO secretion (±s, n = 3)

表8 18 批牛蒡子-甘草药对95%乙醇总提物对NO 分泌量的影响 (±s, n = 3)Table 8 Effect of 18 batches of Arctii Fructus-Glycyrrhizae Radix et Rhizoma drug pair on 95% total alcohol extract on NO secretion (±s, n = 3)
编号 NO/(μmol·L-1) 编号 NO/(μmol·L-1)正常 5.82±0.09 S9 6.22±0.08**模型 9.54±0.07## S10 6.75±0.06**S1 6.71±0.04** S11 6.33±0.07**S2 5.64±0.03** S12 7.98±0.21**S3 6.98±0.22** S13 5.82±0.04**S4 6.97±0.14** S14 6.66±0.11**S5 6.63±0.09** S15 7.00±0.04**S6 6.47±0.04** S16 6.17±0.07**S7 6.06±0.16** S17 5.62±0.07**S8 6.15±0.12** S18 5.71±0.02**
2.6 灰色关联度分析(gray correlation analysis,GCA)
GCA 能够表征各因素间的关联程度,通过计算关联度,然后根据关联的大小进行排序、分析,关联度值越大,说明关系越密切,对药效的“贡献”越大。主要包括定义参考序列和比较序列、处理参考数列和比较数列数据、计算参考数列和比较数列的绝对差值、计算灰色关联系数和灰色关联度[22]。
2.6.1 原始数据的无量纲化处理 为消除因变量与各变量之间单位不同的影响,用均值化法对原始数据进行无量纲化处理[23]。将牛蒡子-甘草药对抗炎作用的药效指标作为母序列,牛蒡子-甘草药对95%乙醇总提物的共有峰峰面积作为子序列,变换的母序列记为Y(k)(k为18 批样品编号)、子序列记为Xf(k)(f为峰号)。
2.6.2 序列和子序列绝对差序列及关联度的计算根据公式计算母序列与子序列的绝对差序列[Δf(k)]和关联度[Af(k)]。当关联度大于0.8 时,表明子序列与母序列关联密切,当关联度0.6~0.8 时,表明两者关联度一般[24]。
ρ为分辨系数,取值为0.5
18 批样品对RAW264.7 细胞NO 分泌量的影响与其指纹图谱38 个共有峰的关联度见表9,结果显示,除F34、F36 外,其余色谱峰的灰色关联度均大于0.8,进一步说明牛蒡子-甘草药对抗炎活性是多种成分共同作用的结果。各共有峰所代表的化学成分对其抗炎活性的影响程度有所不同,与RAW264.7 细胞NO 分泌量有较大关联性的色谱峰贡献大小顺序为F5(甘草苷)>F17(甘草酸)>F1>F3>F4>F9>F11(异甘草苷)>F13(牛蒡子苷)>F19>F23>F21(牛蒡苷元)>F14。
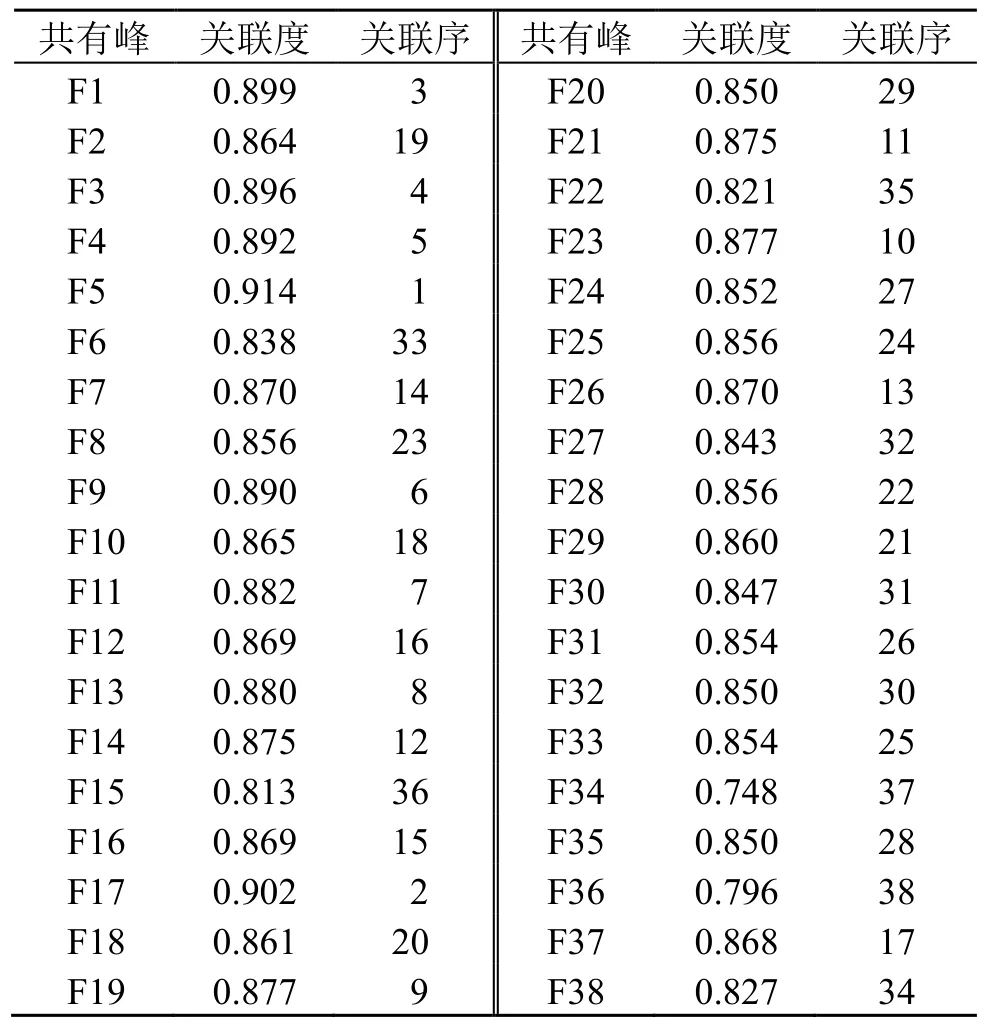
表9 18 批牛蒡子-甘草药对共有峰峰面积与抗炎药效的关联度Table 9 Correlation between peak areas of shared peaks and anti-inflammatory efficacy of 18 batches of Arctii Fructus-Glycyrrhizae Radix et Rhizoma drug pair
2.7 指纹图谱与抗炎药效的偏最小二乘回归(partial least squares regression,PLSR)分析
PLSR 分析是一种模型拟合度好和预测能力强的数据处理方法,集聚类分析、PCA、多元线性回归(multiple linear regression,MLR)优势为一体,且具有无须剔除样本、预测精度高、计算量小,易于定性解释等特点,已普遍应用于中药谱效学[25]。利用SIMCA14.1 软件,将18 批牛蒡子-甘草药对38个共有峰的峰面积进行标准化处理,结果作为自变量(X),RAW264.7 细胞NO 分泌量作为因变量(Y),进行PLSR 分析,结果见图6,结果表明所标示的共有峰中F1、F3、F5、F6、F9、F15、F17、F18、F20~F23、F25、F26、F28、F29、F33~F37 与RAW264.7 细胞NO 分泌量呈负相关,与牛蒡子-甘草药对抗炎药效呈正相关。
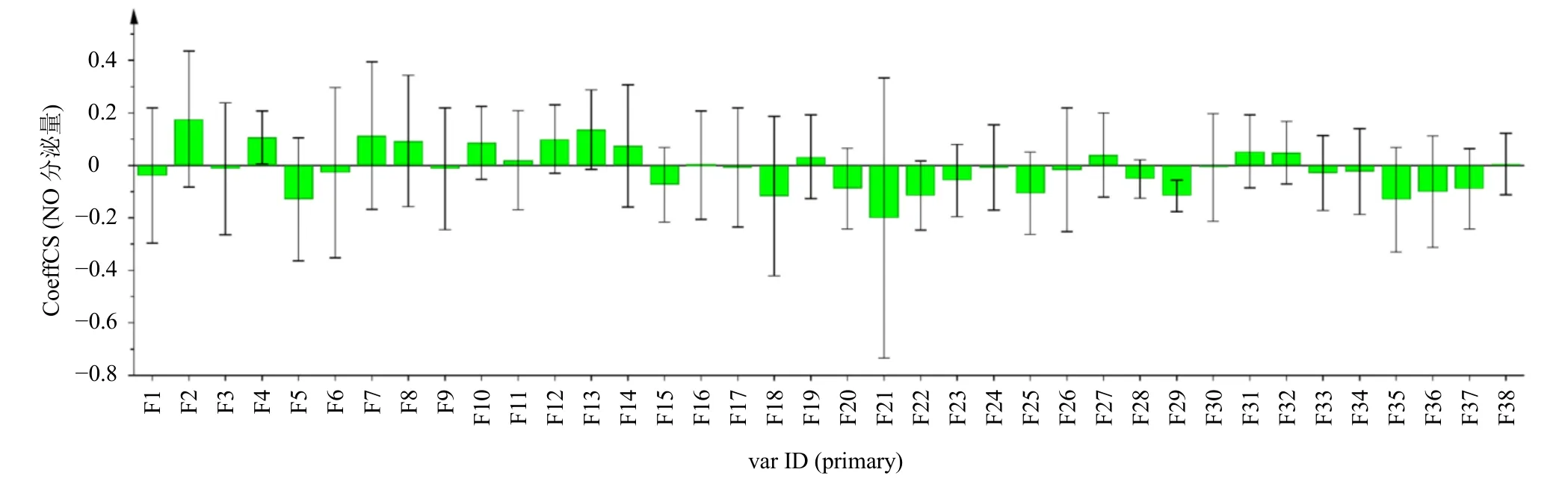
图6 回归系数图Fig. 6 Regression coefficient graph
基于PLSR 分析变量的选择方法进行变量重要性投影(variable importance projection,VIP)分析。VIP 值反映了自变量对因变量的解释能力,值越大(VIP>1),解释能力越强[26]。18 批牛蒡子-甘草药对指纹图谱的38 个共有峰与RAW264.7 细胞NO分泌量的VIP 图见图7,由VIP 图可知,牛蒡子-甘草药对38 个共有峰中17 个特征峰(VIP>1)与其抗炎作用显著相关且F21(VIP>1.5)贡献较大,牛蒡苷元(F21)是引起18 批牛蒡子-甘草药对抗炎药效产生差异的最主要变量。
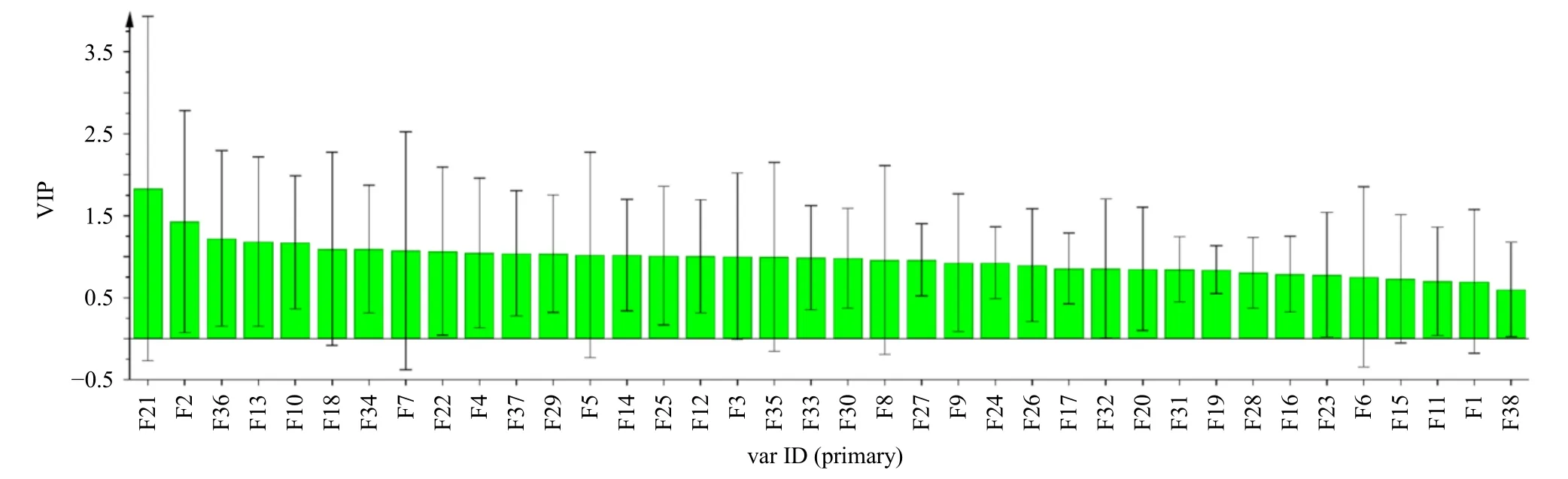
图7 VIP 分析Fig. 7 VIP analysis
3 讨论
中药复方应在传统配伍理论和临床应用基础上开展继承创新的现代开发研究,阐释药效物质基础和作用机制是推动中药复方现代化创新开发研究的科学需求。药对是中药配伍组方的基本单位之一,在中医临证方剂配伍中起到相辅相成的作用[1]。
本研究以色谱峰信息量最大化、方法稳定为宗旨优化了提取条件;对流动相配比、柱温、体积流量和波长等进行筛选,以色谱峰分离度和峰面积为考察目标确定了最佳色谱条件,且依据课题组前期文献信息挖掘及“生信分析-网络药理学-分子对接”的相关研究确定牛蒡子和甘草药材具有抗炎活性研究基础的有效成分作为对照品。牛蒡子-甘草药对指纹图谱共标定38 个共有峰,经混合对照品溶液指认出13 个共有峰,18 批样品相似度均>0.7,表明所建立的指纹图谱方法可用于药对的整体质量评价。聚类分析结果显示,当平方欧式距离为10 时,18 批样品被分为3 类;PCA 得到5 个主成分,累计方差贡献率为92.272%,能够充分体现牛蒡子-甘草药对活性成分的基本信息,选择6 个主成分绘制主成分得分图,样品总体可聚为2 类(S4 与S13 为离群样品),与聚类分析结果基本一致,样品间产生差异可能与采收季节、产地加工和炮制等相关。进一步根据各主成分值及贡献率分别计算18 批样品综合得分,来评价收集到的18 批牛蒡子-甘草药对质量,综合得分的排名越高说明药材的质量越好,结果显示样品S7 质量最佳。
本研究以脂多糖刺激RAW264.7 细胞制备炎性细胞模型[27],以NO 分泌量作为药效学指标考察18批牛蒡子-甘草药对的抗炎活性。首先以细胞存活率为判定指标对给药安全剂量进行筛选,当牛蒡子-甘草药对95%乙醇总提物质量浓度为0.2~0.8 mg/mL时,细胞存活率均大于100%,进行3 次重复实验后结果一致,说明牛蒡子-甘草药对95%乙醇总提物在0.2~0.8 mg/mL 能够促进细胞活力,但随质量浓度变化趋势不明显,考虑可能与药物质量浓度设定梯度变化较小和细胞种板均匀度相关。在给药安全剂量范围内设定梯度质量浓度考察牛蒡子-甘草药对95%乙醇总提物的抗炎活性,与模型组比较,给药组NO 分泌量显著降低,呈剂量相关性,体外抗炎实验结果显示,18 批样品均能不同程度降低RAW264.7 炎性细胞的NO 分泌量。值得注意的是,实验过程中空白组NO 分泌量较高,考虑RAW264.7细胞对于培养环境要求严格,尤其对于CO2的浓度具有较高的敏感性,在实验期间不同实验人员不定期开关培养箱使其培养环境无法长时间稳定,导致细胞活力有所降低,这可能是导致空白组NO 释放量过高的重要原因。
本研究采用GCA 和PLSR 分析对牛蒡子-甘草药对的抗炎活性进行谱效相关性分析,GCA 结果表明38 个共有峰中多个成分的关联度均大于0.8,色谱峰贡献大小顺序为F5(甘草苷)>F17(甘草酸)>F1>F3>F4>F9>F11(异甘草苷)>F13(牛蒡子苷)>F19>F23>F21(牛蒡苷元)>F14,说明牛蒡子-甘草药对的抗炎活性是通过多成分协同作用产生的;其中甘草苷、甘草酸、异甘草苷、牛蒡子苷、牛蒡苷元已明确具有较好的抗炎作用,甘草总皂苷(甘草酸等)能够通过抑制NO、TNF-α、IL-6的炎症因子的分泌来达到抗炎作用,牛蒡苷元可以通过抑制Janus 激酶(Janus kinase,JAK)/信号转导与转录激活子(signal transducer and activators of transcription,STAT)信号通路发挥抗炎作用[28-29],牛蒡苷可通过抗炎、解热等途径减轻炎症反应[30]。PLSR 分析结果显示,牛蒡子-甘草药对38 个共有峰中有17 个特征峰(VIP>1)与其抗炎作用显著相关,且牛蒡苷元(F21,VIP>1.5)是引起18 批牛蒡子-甘草药对抗炎药效产生差异的主要变量。牛蒡子-甘草药对临床配伍应用中牛蒡子的炮制加工方法分别为炒制品和生品,相关研究表明,炒制条件的不同使得牛蒡子的抗炎药效存在差异,高温炒制使部分牛蒡子苷分解成其抗炎主要活性成分牛蒡苷元[31]。一定程度解释了可能由于18 批样品炒制程度不同,导致牛蒡苷元含量差异,使其成为影响牛蒡子-甘草药对抗炎药效产生差异的主要变量。
综上,本研究建立了牛蒡子-甘草药对HPLC 指纹图谱的研究方法,通过GCA 与PLSR 分析探讨了指纹图谱共有峰与抗炎活性的谱效相关性,筛选出牛蒡子-甘草药对抗炎作用的有效成分群,可为牛蒡子-甘草药对的抗炎药效物质基础研究、质量评价及相关制剂开发提供研究基础。此外,本研究发现,在未指认的化学成分中也有部分与该药对抗炎药效具有一定关联性,后续将采用液质联用技术进行进一步阐释研究。
利益冲突所有作者均声明不存在利益冲突

