基于脂肪可塑性研究大黄素对肥胖小鼠的改善作用和机制
冯倩倩,贺润铖,张 磊,耿 杨,赵子阳,史浩男,贾占红,张硕峰,孙建宁,董世芬
北京中医药大学中药学院 中药药理系,北京 102488
随着生活水平的提高,以脂质代谢异常为共同特征的相关代谢疾病(包括肥胖、糖尿病、心血管和肝脏疾病以及衰老等),发病率逐年升高,预计到2030 年,我国成人超重及肥胖患病率将达到65.3%[1]。肥胖症是常见的慢性脂质代谢性疾病,主要表现为体内脂肪含量过多、体脂分布失调以及局部脂肪沉积。肥胖的病生理原因主要包括摄食异常、脂肪组织功能障碍、瘦素受体缺陷或其信号转导改变、肠道菌群紊乱。多数肥胖症患者存在严重的脂质代谢紊乱,并与2 型糖尿病、冠心病、高血压等合并存在形成恶性循环,致使疾病加重[2],对身心健康造成严重负担。据估算,2000—2025 年,我国因肥胖导致的经济损失将达到国民生产总值的3.6%~8.7%,造成了重大的社会经济负担[3]。因此,从改善脂质代谢角度寻找肥胖症的治疗药物具有重要意义。
脂肪具有可塑性特点。脂肪组织是一类具有高度动态变化的内分泌器官,在能量代谢稳态维持过程具有重要作用。哺乳动物的脂肪组织主要由白色脂肪组织(white adipose tissue,WAT)、棕色脂肪组织(brown adipose tissue,BAT)及米色脂肪组织组成。WAT 可将机体过剩的能量以三酰甘油(triglycerides,TG)形式在体内积聚;BAT 是一种产热组织,能够通过加快脂肪的氧化产热,促进机体的能量代谢和消耗,人体50 g BAT(<0.1%体质量)最多可利用超过20%的基础热量。WAT 细胞被药物诱导或冷暴露刺激后“褐变”产生棕色样脂肪细胞,也就是米色脂肪细胞,获得棕色化的表型特征,改善因肥胖引起的代谢紊乱[4-7],是目前广受关注的对抗肥胖、糖尿病的治疗方法。大黄素是一种天然蒽醌苷元,是大黄中的主要成分,体内外研究发现,大黄素具有抗糖尿病、抗肥胖、抗骨质疏松、抗癌等药理作用[8-9]。课题组前期研究发现,大黄素为三黄泻心汤改善肥胖的主要有效成分之一,进一步研究发现大黄素可有效抑制肥胖,并且与调节脂肪组织小分子代谢物有关,推测脂肪组织是大黄素改善肥胖的关键作用位置。因此,本研究深入探究大黄素对脂肪可塑性的影响以及改善肥胖的作用及机制,旨在为肥胖治疗提供新的思路。
1 材料
1.1 动物
SPF 级雄性C57BL/6J 小鼠48 只,6 周龄,体质量(20±2)g,由斯贝福(北京)生物技术有限公司提供,合格证号SCXK(京)2019-0010。小鼠饲养于北京中医药大学屏障环境动物实验室(温度20~24 ℃、相对湿度50%~70%、明暗12 h/12 h),使用许可证号SYXK(京)2020-0033。动物实验通过北京中医药大学医学与实验动物伦理委员会批准(批准号BUCM-4-2021102003-4054)。
1.2 药品与试剂
大黄素( 质量分数为 95.0% , 批号T17O11F127680)、马来酸罗格列酮(质量分数为99%,批号S17088)购自上海源叶生物科技有限公司;β3-肾上腺素受体激动剂CL316243(批号C5795)购自美国Sigma-Aldrich 公司;D12492 高脂饲料购自斯贝福(北京)生物技术有限公司;羧甲基纤维素钠(sodium carboxyl methyl cellulose,CMC-Na,批号S14016)购自上海源叶生物科技有限公司;葡萄糖(批号20201028)购自北京百瑞极生物科技有限公司;血糖试纸(批号06454038022)购自瑞士Roche公司;TG 试剂盒(批号20211102)、总胆固醇(total cholesterol,TC)试剂盒(批号20220114)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒(批号20220114)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒(批号20220114)购自南京建成生物工程研究所;解偶联蛋白1(uncoupling protein 1,UCP1)抗体(批号23673-1-AP)、过氧化物酶体增殖物激活受体γ 共激活剂-1α(peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)抗体(批号66369-1-Ig)、线粒体转录因子A(mitochondrial transcription factor A,TFAM)抗体(批号22586-1-AP)、葡萄糖转运蛋白4(glucose transporter 4,GLUT4)抗体(批号66846-1-Ig)购自武汉三鹰生物技术有限公司;PR结构域蛋白16(positive regulatory domain-containing 16,PRDM16)抗体(批号PA5-20872)购自赛默飞世尔科技公司;腺苷酸活化蛋白激酶(AMPdependent/activated protein kinase,AMPK)抗体(批号GR284787-18)、磷酸化AMPK(phosphorylated AMPK,p-AMPK)抗体(批号GR3357969-1)、β-actin抗体(批号GR3371313-1)购自英国Abcam 公司;4%多聚甲醛固定液(批号20210118)购自北京百瑞极生物科技有限公司;无水乙醇(批号100092683)、二甲苯(批号10023418)、中性树胶(批号10004160)、正丁醇(批号1000521090)购自国药集团化学试剂有限公司;苏木素-伊红(HE)染液套装(批号G1003)、柠檬酸(pH6.0)抗原修复液(批号G1202)、EDTA 抗原修复液(pH 9.0,批号G1203)、EDTA 抗原修复液(pH 8.0,批号G1206)、牛血清白蛋白(bovine serum albumin,BSA,批号G5001)、超净快干封片胶(批号G1404)、组化试剂盒DAB 显色剂(批号G1211)购自武汉赛维尔生物科技有限公司;PVDF 膜(批号 R0BB30223)购自德国 Merck Millipore 公司;山羊抗小鼠Ig 二抗(批号ZB-2301)、山羊抗兔Ig 二抗(批号ZB-2305)购自北京中杉金桥生物技术有限公司;细胞组织快速裂解液RIPA(批号080320200921)、BCA 蛋白浓度测定试剂盒(批号120320210419)购自上海碧云天生物科技有限公司。
1.3 仪器
LOT480134 型血糖仪(瑞士Roche 公司);5810R 型高速冷冻式离心机(德国Eppendorf 公司);TiS50 型红外热像仪(美国Fluke 公司);蛋白电泳系统(美国Bio-Rad 公司);Donatello 脱水机、Giotto染色机(意大利DIAPATH 公司);JB-P5 型包埋机、JB-L5 型冻台(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);KD-P 型组织摊片机(浙江省金华市科迪仪器设备有限公司);TSY-B 型脱色摇床(武汉赛维尔生物科技有限公司);DS-U3 型成像系统、Eclipse E100 型正置光学显微镜(日本Nikon 公司);Epoch 酶标仪(美国Bio Tek 公司);Amersham Imager 680 型超灵敏多功能成像仪(美国 Cellular Technology 公司);FBZ2001-up-p 型标准试剂型纯水仪(青岛富勒姆科技有限公司)。
2 方法
2.1 动物分组、造模及给药
取40 只C57BL/6J 小鼠喂食高脂饲料,另取8只小鼠喂食普通饲料作为对照组。造模8 周后,将造模小鼠按体质量随机分为模型组,大黄素(40、80 mg/kg)组,CL316243(1 mg/kg)组和罗格列酮(10 mg/kg)组。大黄素组和罗格列酮组ig 给药(20 mL/kg),1次/d,连续给药4周;取材前3 d,CL316243组ip 给药(10 mL/kg),1 次/d,连续3 d;对照组、模型组ig 等体积CMC-Na 溶液。
2.2 体质量的测定
给药期间每周监测各组小鼠体质量的变化,考察大黄素对模型小鼠肥胖程度的影响。
2.3 Lee’s 指数的测定
药物连续干预4 周后,称定小鼠体质量,精确测量小鼠体长(鼻尖至肛门的距离),计算Lee's 指数。Lee's 指数为评价小鼠肥胖程度的指标。
2.4 红外热像仪测量小鼠肩胛骨皮肤温度
末次给药前1 d脱去小鼠背部肩胛骨处的毛发,第2 天各组小鼠的肩胛骨皮肤温度由红外热像仪(Fluke TiS50 THERMAL IMAGER)在安静状态下测定,并用特定的软件包(Smart view 4.3)分析。
2.5 口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)
使用OGTT 研究高脂饮食小鼠体内的葡萄糖代谢情况。药物连续干预4 周后,小鼠在禁食不禁水12 h 的情况下,采用剪尾法取血,用血糖仪试纸法测定小鼠血糖。ig 50%葡萄糖(2 g/kg),测定ig 后0、30、60、90、120 min 血糖值,绘制OGTT 时间曲线图,并采用近似梯形方法计算曲线下面积(area under curve,AUC)。实验结束小鼠放回笼子,保证充足的饮水和食物。
2.6 血清血脂水平检测
给药结束后,小鼠禁食不禁水12 h,麻醉取血约1 mL,3 500 r/min 离心10 min,分离血清。按照试剂盒说明书测定各组小鼠血清中TC、TG、LDLC 和HDL-C 的含量。
2.7 脂肪组织形态观察和脂肪指数的测定
取血后,解剖分离皮下腹股沟白色脂肪组织(inguinal white adipose tissue,iWAT)、附睾白色脂肪组织(epididymal white adipose tissue,eWAT)、肾周白色脂肪组织(perirenal white adipose tissue,pWAT)、BAT,观察各组小鼠iWAT、eWAT、pWAT、BAT 大小、厚度和颜色,称定质量,计算脂肪指数。
脂肪指数=脂肪质量/体质量
2.8 HE 染色检测脂肪组织形态
用4%多聚甲醛固定iWAT、BAT,梯度脱水,石蜡包埋,制备成2~3 μm 厚的组织薄片,HE 染色,中性树胶封片,于显微镜下观察并拍照。
2.9 免疫组化法检测UCP1 表达
石蜡切片进行常规脱蜡,将iWAT、BAT 切片放在抗原修复缓冲液中进行修复,滴加3%双氧水溶液,避光室温孵育25 min,PBS 洗涤3 次,滴加山羊血清封闭1 h。滴加UCP1 抗体(1∶500),将切片放入湿盒内4 ℃孵育过夜。滴加二抗,37 ℃孵育20 min,DAB 显色,苏木素复染3 min,常规脱水,中性树胶封片,于显微镜下观察并拍照,通过Image-Pro Plus 6.0 软件处理数据。
2.10 Western blotting检测脂肪棕色化相关蛋白表达
取各组小鼠的iWAT,加入细胞组织快速裂解液裂解,提取蛋白,采用BCA 蛋白定量试剂盒测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,于5%脱脂牛奶中封闭后,分别加入PGC-1α、PRDM16、TFAM、AMPK、p-AMPK、GLUT4 和β-actin 抗体,4 ℃孵育过夜;TBST 洗涤3 次,加入二抗,37 ℃摇床孵育2 h;TBST 洗涤后,加入ECL 化学发光试剂显影,Image J 软件分析条带灰度值。
2.11 统计学分析
图片使用Image J 软件进行处理,实验数据采用IBM SPSS Statistics 26 软件进行统计,计量资料用±s表示,对于正态数据,多组间数据比较采用单因素方差分析法(One-way ANOVA),组间两两比较采用LSD。
3 结果
3.1 大黄素对肥胖小鼠体质量和Lee’s 指数的影响
如图1 所示,与对照组比较,模型组小鼠体质量和Lee's 指数均显著升高(P<0.01、0.001);与模型组比较,给药4 周时大黄素各剂量组体质量和Lee's 指数均显著降低(P<0.01、0.001),表明大黄素可显著改善小鼠肥胖程度。

图1 大黄素对肥胖小鼠体质量 (A) 和Lee’s 指数 (B) 的影响 (±s, n = 8)Fig. 1 Effect of emodin on body weight (A) and Lee’s index (B) of obese mice (±s, n = 8)
3.2 大黄素对肥胖小鼠肩胛骨体温的影响
如图2 所示,与对照组比较,模型组BAT 周围的皮肤温度显著降低(P<0.05);与模型组比较,大黄素(40 mg/kg)组BAT 周围的皮肤温度显著升高(P<0.01),表明大黄素能促进肥胖小鼠的BAT产热,激活BAT 功能。
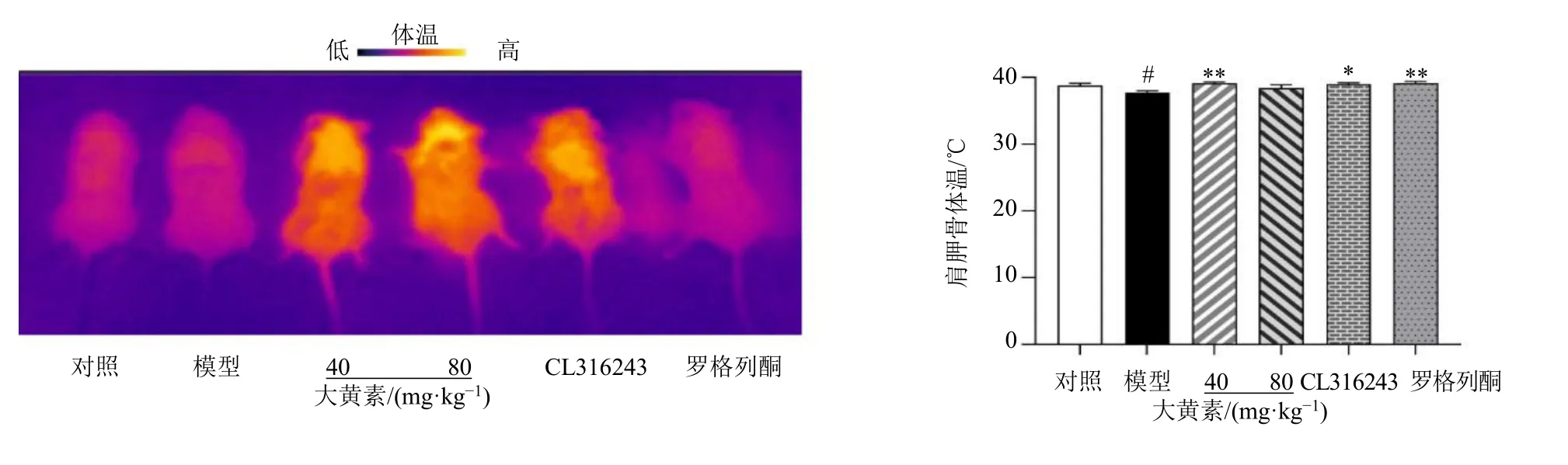
图2 大黄素对肥胖小鼠肩胛骨体温的影响 (±s, n = 8)Fig. 2 Effect of emodin on scapular temperature of obese mice (±s, n = 8)
3.3 大黄素对肥胖小鼠脂肪组织形态和脂肪指数的影响
与对照组比较,模型组小鼠iWAT、eWAT、pWAT 明显增大、增厚;与模型组比较,大黄素各剂量组iWAT、eWAT、pWAT 明显变小、变薄,更褐色,有棕色化趋势,BAT 无明显变化,表明大黄素能有效减少肥胖小鼠的白色脂肪沉积,促进WAT棕色化。
如表1 所示,与对照组比较,模型组iWAT、eWAT、pWAT 指数均显著升高(P<0.001);与模型组比较,大黄素(40、80 mg/kg)组iWAT、eWAT、pWAT 指数均显著降低(P<0.001),表明大黄素能有效减少肥胖小鼠的白色脂肪沉积。
表1 大黄素对肥胖小鼠脂肪指数的影响 (±s, n = 8)Table 1 Effect of emodin on adipose index of obese mice (±s, n = 8)

表1 大黄素对肥胖小鼠脂肪指数的影响 (±s, n = 8)Table 1 Effect of emodin on adipose index of obese mice (±s, n = 8)
与对照组比较:##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下表同。##P < 0.01 ###P < 0.001 vs control group; *P < 0.05 **P < 0.01 ***P < 0.001 vs model group, same as below tables.
组别 剂量/(mg kg-1) iWAT 指数 eWAT 指数 pWAT 指数对照 — 0.004±0.001 0.008±0.001 0.002±0.001模型 — 0.016±0.002### 0.034±0.005### 0.014±0.002###大黄素 40 0.008±0.001*** 0.018±0.002*** 0.006±0.002***80 0.009±0.001*** 0.016±0.002*** 0.005±0.001***CL316243 1 0.006±0.001*** 0.010±0.002*** 0.004±0.001***罗格列酮 10 0.009±0.001*** 0.020±0.002*** 0.006±0.001***
3.4 大黄素对肥胖小鼠口服葡萄糖代谢的影响
如图3 所示,葡萄糖耐量实验中,与对照组比较,模型组空腹血糖及AUC 显著升高(P<0.05、0.01、0.001);与模型组比较,大黄素(40 mg/kg)组空腹血糖显著降低(P<0.05、0.01),大黄素(40、80 mg/kg)组AUC 降低但无显著性差异。
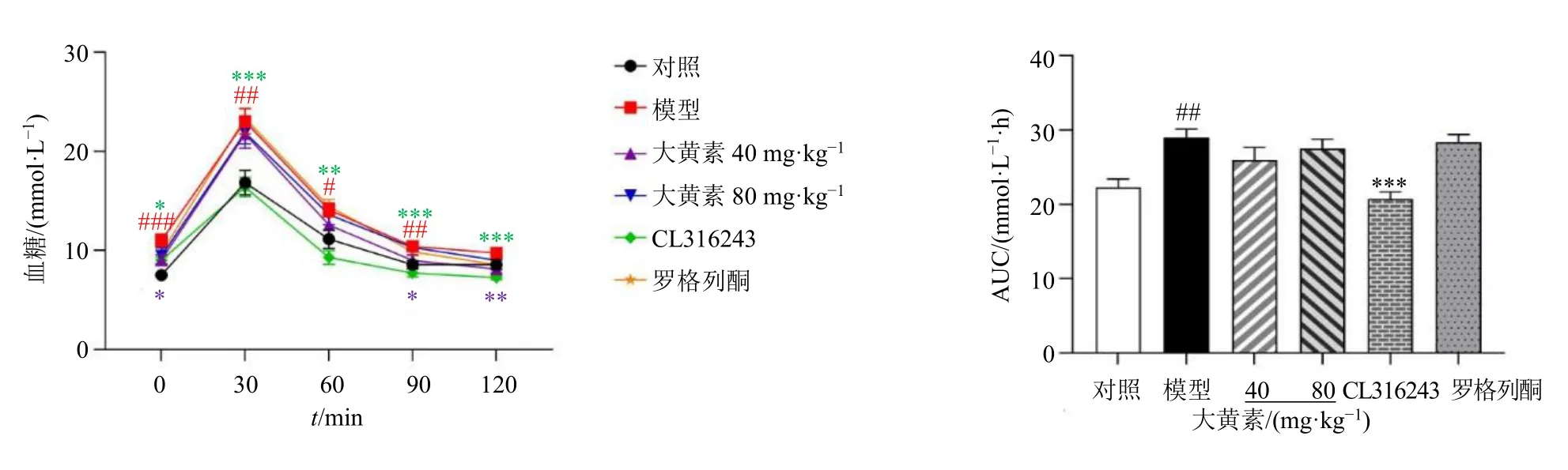
图3 大黄素对肥胖小鼠葡萄糖耐量及AUC 的影响 (±s, n = 8)Fig. 3 Effect of emodin on glucose tolerance and AUC of obese mice (±s, n = 8)
3.5 大黄素对肥胖小鼠血脂的影响
如表2 所示,与对照组比较,模型组小鼠血清中TC、LDL-C 和HDL-C 水平均显著升高(P<0.01、0.001);与模型组比较,大黄素(40、80 mg/kg)组血清中TG、TC、LDL-C 水平均显著降低(P<0.05、0.01、0.001),表明大黄素能改善肥胖小鼠的脂质代谢紊乱。
表2 大黄素对肥胖小鼠血脂的影响 (±s, n = 8)Table 2 Effect of emodin on blood lipid of obese mice (±s, n = 8)

表2 大黄素对肥胖小鼠血脂的影响 (±s, n = 8)Table 2 Effect of emodin on blood lipid of obese mice (±s, n = 8)
组别 剂量/(mg kg-1) TG/(mmol·L-1) TC/(mmol·L-1) LDL-C/(mmol·L-1) HDL-C/(mmol·L-1)对照 — 0.54±0.04 3.05±0.22 0.52±0.06 2.97±0.21模型 — 0.65±0.03 4.80±0.23### 1.26±0.13### 3.66±0.13##大黄素 40 0.44±0.05** 3.85±0.32** 0.54±0.06*** 3.50±0.07 80 0.46±0.05* 4.04±0.22* 0.57±0.06*** 3.31±0.18 CL316243 1 0.38±0.05*** 3.90±0.23* 0.60±0.06*** 3.01±0.14**罗格列酮 10 0.52±0.07 3.91±0.25* 0.50±0.05*** 3.41±0.09
3.6 大黄素对肥胖小鼠脂肪组织病理变化的影响
如图4 所示,与对照组比较,模型组小鼠iWAT细胞直径明显变大,较为松散,WAT 细胞特征明显;与模型组比较,大黄素(40、80 mg/kg)组小鼠iWAT细胞体积变小,排列更致密,形态趋向BAT细胞。
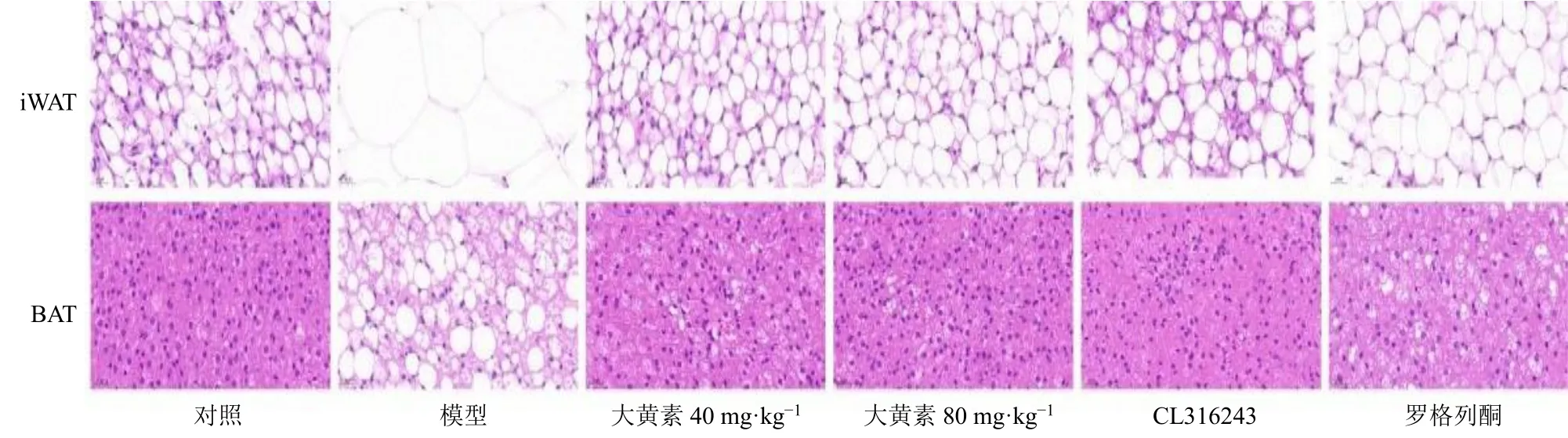
图4 大黄素对肥胖小鼠脂肪组织病理变化的影响 (HE, ×400)Fig. 4 Effect of emodin on pathological change of adipose tissue in obese mice (HE, × 400)
与对照组比较,模型组小鼠BAT 细胞直径较大,组织中具有单一空泡状脂滴的细胞明显增多,细胞形态更加趋向WAT 细胞;与模型组比较,大黄素(40、80 mg/kg)组小鼠BAT 细胞增多,排列紧密,细胞间毛细血管丰富,具有较为明显的BAT 细胞形态特征。
3.7 大黄素对肥胖小鼠脂肪组织中UCP1 表达的影响
如图5 所示,与对照组比较,模型组iWAT 中UCP1 阳性细胞表达减少但无显著性差异;与模型组比较,大黄素(40、80 mg/kg)组小鼠UCP1 阳性细胞表达增多但无显著性差异。
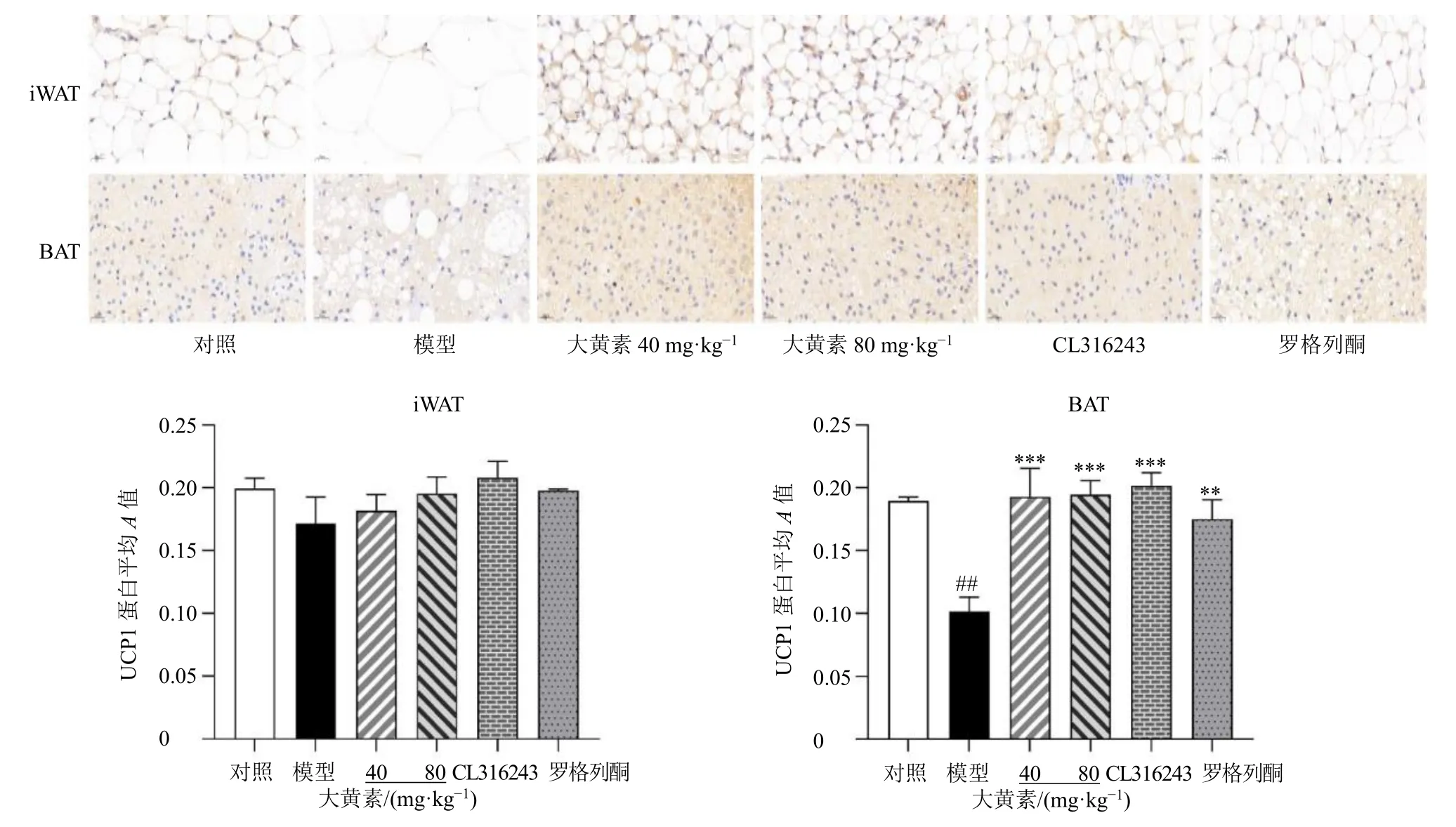
图5 大黄素对肥胖小鼠iWAT 和BAT 中UCP1 蛋白表达的影响 (免疫组化, ×400)Fig. 5 Effect of emodin on UCP1 protein expression in iWAT and BAT of obese mice (immunohistochemistry, × 400)
与对照组比较,模型组小鼠BAT 中UCP1 阳性细胞表达显著减少(P<0.01);与模型组比较,大黄素(40、80 mg/kg)组UCP1 阳性细胞表达显著增多(P<0.001)。
3.8 大黄素对肥胖小鼠iWAT中脂肪可塑性相关蛋白表达的影响
如图6 所示,与对照组比较,模型组iWAT 中PRDM16、p-AMPK/AMPK 和GLUT4 蛋白表达水平均显著降低(P<0.01、0.001),PGC-1α、TFAM蛋白表达水平降低但无显著性差异;与模型组比较,大黄素(40、80 mg/kg)组PRDM16、p-AMPK/AMPK和GLUT4 蛋白表达水平均显著升高(P<0.05、0.01),大黄素(80 mg/kg)组PGC-1α、TFAM 蛋白表达水平显著升高(P<0.01)。

图6 大黄素对肥胖小鼠iWAT 中PGC-1α、PRDM16、p-AMPK/AMPK、TFAM 和GLUT4 蛋白表达的影响 (±s, n = 3)Fig. 6 Effect of emodin on PGC-1α, PRDM16, p-AMPK/AMPK, TFAM and GLUT4 protein expressions in iWAT of obese mice (±s, n = 3)
4 讨论
肥胖对患者身心健康和社会经济产生重大影响,因此研究改善肥胖症的药物作用及分子机制具有重要意义。为进一步研究大黄素改善肥胖的药效作用及机制,采用高脂饲料喂养建立肥胖模型,研究大黄素对肥胖程度、糖脂代谢、组织形态变化及脂肪可塑性相关蛋白表达的影响。皮下iWAT 细胞较小并具有更大的分化潜力,因此常被用来作为WAT 棕色化的重要研究部位[10];啮齿类动物大部分BAT 位于背部肩胛区域[11]。因此,本研究对皮下iWAT 及肩胛部BAT 进行重点关注。本研究发现,大黄素可降低肥胖小鼠体质量、Lee's 指数、肩胛骨体温、WAT 指数及iWAT 细胞大小,表明大黄素可改善小鼠肥胖程度,促进BAT 产热,改善WAT、BAT 指数和形态。大黄素显著降低血糖、TC、TG、LDL-C 水平,表明大黄素可以改善糖脂代谢紊乱。
研究发现,不同的脂肪细胞中糖代谢靶点GLUT4 的功能强度表达不一,在胰岛素的刺激下较大的脂肪细胞中GLUT4 转位和扩散都明显弱于较小脂肪细胞[12]。本研究结果显示,与模型组比较,大黄素组皮下iWAT 细胞明显变小,GLUT4 表达显著增加,表明大黄素可促进GLUT4 表达,改善糖代谢。UCP1、PRDM16 是重要的脂肪棕色化相关蛋白。UCP1 是一种特殊的线粒体蛋白,介导BAT 产热过程。UCP1 在线粒体内膜上形成质子通道,内膜胞质侧的H+可经此通道返回线粒体基质,使氧化磷酸化解偶联而不合成三磷酸腺苷(adenosine triphosphate,ATP),质子浓度梯度储存的能量以热能形式释放[13]。因此,BAT 细胞的UCP1 活动被认为是一种很有前途的对抗肥胖和代谢疾病的策略。PRDM16 近年来被发现具有激活BAT 特异性的生热程序、提高其线粒体密度、促进UCP1 的表达、增加能量消耗的作用[14]。同时,当WAT 中异位表达UCP1 和PRDM16 时,可作为识别WAT 细胞出现米色脂肪细胞的标志[15]。此外,PRDM16 也被证明是罗格列酮诱导褐变效应所必须的蛋白[16]。PRDM16 能够诱导UCP1 以及其他棕色基因的表达,同时抑制包括抵抗素在内的特定WAT基因[17]。本研究中,大黄素显著回调iWAT 中PRDM16 蛋白表达,表明大黄素可促进WAT 棕色化,激活BAT。
AMPK 是机体内最重要的代谢调控蛋白之一,在机体能量水平下降时被激活,通过磷酸化一系列下游因子促进分解代谢、抑制合成代谢,从而维持能量平衡。AMPK 被证明在调节米色脂肪组织和BAT 的代谢方面具有重要意义。在脂肪细胞中,AMPK 的激活能够促使蛋白激酶A 磷酸化甘油三酯脂肪酶和激素敏感性脂肪酶,这些酶可促进细胞内脂肪分解,分解的产物游离脂肪酸是非颤抖产热过程中必要的底物[18]。AMPK 的敲除会对WAT 棕色化功能造成明显影响,当AMPKα1 被敲除后,WAT 中UCP1 表达水平剧烈下降[19];AMPKβ1 敲除小鼠WAT 中PGC-1α 蛋白表达减少[20],而AMPK激动剂能够诱导WAT 棕色化发生,上调UCP1 的表达[21]。此外,研究发现,AMPK 可通过作用于肾上腺素能神经系统影响BAT 产热,也可通过促进PRDM16 启动子区的去甲基化促进PRDM16 表达,进而促进 BAT 生成[22]。给予去甲肾上腺素或CL316243 刺激后,AMPKβ1 促进PGC-1α 的表达同时增加PRDM16 的活性[20]。本研究中,在大黄素的作用下,iWAT 中p-AMPK/AMPK、PGC-1α、PRDM16 表达上调,表明大黄素可激活AMPK,促进WAT 棕色化,从而改善肥胖。
综上,本研究基于脂肪可塑性探讨了大黄素改善肥胖症的作用及相关机制,证实了大黄素可在给药4 周后有效抑制肥胖模型小鼠的肥胖程度,改善糖脂代谢紊乱,其机制与激活BAT,诱导WAT 棕色化有关。
利益冲突所有作者均声明不存在利益冲突

