指纹图谱、一测多评与模式识别相结合的忍冬藤配方颗粒质量评价
曹桂云,宁 波,余彩娟,庄雪松,刘羽康,王岱杰,林永强,董晓弟,杨纯国,崔伟亮,刘洪超,孟兆青*
1. 山东宏济堂制药集团股份有限公司 山东省中医药治疗呼吸系统疾病技术创新中心,山东 济南 250103
2. 齐鲁工业大学(山东省科学院)山东省分析测试中心,山东 济南 250014
3. 山东省食品药品检验研究院,山东 济南 250101
4. 山东一方制药有限公司,山东 临沂 276000
忍冬藤LoniceraeJaponicaeCaulis是忍冬科忍冬属植物忍冬LonicerajaporacaThunb.的干燥茎枝,有清热解毒、疏风通络之功效。用于温病发热、风湿热痹、痈肿疮疡、关节红肿热痛[1]。忍冬藤最早记载于汉末的《名医别录》,其性甘味寒,尤善清热解毒、疏风通络[2]。《本草纲目》称其“茎叶及花,功用皆同,治一切湿气及诸肿痛”。现代研究发现,忍冬藤与金银花所含化学成分相似,主要为有机酸、黄酮类、环烯醚萜苷类等化合物[3-4],具有抗菌、抗炎、抗氧化、调节机体免疫力等多种药理作用[5-7]。
忍冬藤配方颗粒是由忍冬藤饮片经水提取后浓缩干燥而成,具有免煎易服,易储存,携带方便、便于调剂等优点,满足了随证加减的临床用药特点,已经成为忍冬藤临床用药的重要形式。因此建立完善的忍冬藤配方颗粒质量评价方法规范忍冬藤配方颗粒质量并明确忍冬藤配方颗粒与临床汤剂一致性对于其临床应用具有十分重要的意义。国家药品监督管理局于2021 年发布的《中药配方颗粒质量控制与标准制定技术要求》[8](下称《技术要求》)明确了“标准汤剂”的概念及标准汤剂的制备方法与工艺,并对配方颗粒质量标准评价系统的建立提供了思路与依据。目前仅有4 篇文献报道了忍冬藤标准汤剂及配方颗粒相关研究。胥爱丽等[9]建立了忍冬藤配方颗粒的HPLC 指纹图谱。李志娇等[10]建立了HPLC 法同时测定忍冬藤配方颗粒中绿原酸、咖啡酸、马钱苷等3 种成分含量的方法。余德发等[11]以出膏率和绿原酸、马钱苷的含量及转移率为评价指标对忍冬藤配方颗粒的制备工艺进行了研究。范帅帅等[12]制备了15 批忍冬藤标准汤剂,以绿原酸、咖啡酸、马钱苷作为定量检测指标,计算出膏率、含量和转移率,并建立超高液相色谱指纹图谱分析方法。其中前3 篇报道未基于标准汤剂进行研究,第4 篇报道采用购买的饮片进行标准汤剂的制备,均不符合《技术要求》相关规定,导致所测定配方颗粒中马钱苷含量数据及出膏率数据与忍冬藤配方颗粒国家标准差距较大,难以反映现行忍冬藤配方颗粒质量。这些报道还存在研究指标成分过少或单一、未制定配方颗粒指标成分含量限度等问题,难以用于忍冬藤配方颗粒的全面质量控制。另外,尚无忍冬藤配方颗粒与对其饮片临床用药的一致性相关研究,不利于忍冬藤配方颗粒的临床配伍使用。
本研究根据《技术要求》相关规定,于山东、河南、河北等地收集代表性药材,炮制成饮片,制备标准汤剂,并建立忍冬藤质量评价标准,并以标准汤剂出膏率、指纹图谱及新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷6 个特征成分含量和转移率评价忍冬藤配方颗粒与标准汤剂的一致性,为忍冬藤配方颗粒的质量控制、工艺研究及临床应用提供参考。
1 仪器与材料
Agilent1260 型高效液相色谱仪,安捷伦科技有限公司;BSA224S-CW 型1/1 万电子天平,赛多利斯科技仪器(北京)有限公司;TS8606 型冻干机,菲维科公司;XS105 型1/10 万电子天平,梅特勒托利多科技(中国)有限公司;YRE2000A 型旋转蒸发仪,巩义市予华仪器有限责任公司;KQ-800VSW型双频静音型超声波清洗器,昆山市超声仪器有限公司;KDM 型可调控温电热套,山东鄄城华鲁电热仪器有限公司。
忍冬藤对照药材,批号121069-202107,中国食品药品检定研究院;对照品隐绿原酸(批号250031-202104)、新绿原酸(批号240008-202110)、当药苷(批号260014-202108),质量分数均为98.0%,上海鸿永生物科技有限公司;对照品马钱苷酸,批号ST05430120,质量分数98.0%,上海诗丹德生物技术有限公司;对照品绿原酸,批号 110753-202119,质量分数96.3%,中国食品药品检定研究院;对照品马钱苷,批号200359-200604,质量分数99.9%,江苏永健医药科技有限公司。
15 批忍冬藤药材来源见表1,经山东省食品药品检验研究院林永强主任药师鉴定,为忍冬科忍冬属植物忍冬L.japoracaThunb.的干燥茎枝。水为超纯水,乙腈、磷酸为色谱纯,其他试剂均为分析纯。忍冬藤配方颗粒,山东宏济堂制药集团股份有限公司,批号220501、220502、220503、220504、220505、220506,编号S16~S21;北京康仁堂药业有限公司,批号22015443,编号S22;山东一方制药有限公司,批号G2020732、G2020742、G2020721,编号S23~S25;忍冬藤配方颗粒规格均为每克中药配方颗粒均相当于饮片6.5 g。

表1 15 批忍冬藤药材信息Table 1 Information of 15 batches of LJC
2 方法与结果
2.1 忍冬藤标准汤剂冻干粉及配方颗粒制备
2.1.1 忍冬藤标准汤剂冻干粉的制备 将15 批忍冬藤药材按照《中国药典》2020 年版一部忍冬藤饮片【炮制】项下的方法炮制,即除去杂质,洗净,闷润,切段,干燥,得到15 批忍冬藤饮片(批号与药材批号对应相同,编号YP1~YP15)。结合现代临床用药习惯,标准汤剂制备工艺确定为称取15批忍冬藤饮片不少于100 g,置于砂锅中,加水煎煮2 次,第1 次加10 倍量水浸泡30 min,武火煮沸后改为文火煎煮20 min,第2 次加8 倍量水武火煮沸后改为文火煎煮15 min,趁热用200 目筛滤过,合并滤液,减压浓缩,冷冻干燥,即得15 批标准汤剂冻干粉(编号S1~S15)。
2.1.2 忍冬藤配方颗粒制备 取忍冬藤饮片6 500 g,加水煎煮,滤过,滤液浓缩成清膏,干燥,加入辅料适量,制粒,制成1 000 g,即得。其中,山东宏济堂制药集团股份有限公司 220501、220502、220503(编号S16~S18)批配方颗粒由YF2104005批(编号YC3)药材炮制成饮片,制备成配方颗粒。
2.2 忍冬藤标准汤剂和配方颗粒HPLC 指纹图谱研究
2.2.1 色谱条件 色谱柱为Agilent Zorbax SB-C18(250 mm×4.6 mm,5 μm);以乙腈-0.4%磷酸水溶液为流动相,梯度洗脱:0~40 min,6%~9%乙腈;40~50 min,9%乙腈;50~51 min,9%~13%乙腈;51~70 min,13%~20%乙腈;70~80 min,20%乙腈;检测波长0~60 min 为236 nm,60~80 min 为327 nm;体积流量1.0 mL/min;柱温30 ℃;进样量5 µL。理论塔板数按马钱苷峰计算不低于3 000。
2.2.2 参照物溶液的制备 取忍冬藤对照药材1 g,精密称定,置具塞锥形瓶中,精密加入30%甲醇25 mL,回流提取30 min,放冷,摇匀,滤过,取续滤液,作为对照药材参照物溶液。
2.2.3 对照品溶液的制备 取马钱苷对照品适量,精密称定,加50%甲醇制成含马钱苷60 μg/mL 的对照品溶液,即得。
2.2.4 供试品溶液的制备 预试验采用单因素实验分别对提取方式、提取溶剂、提取时间和取样量等进行考察,确定供试品溶液制备方式为取忍冬藤配方颗粒或标准汤剂冻干粉适量,研细(过五号筛),取约0.4 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50 mL,密塞,超声处理(功率250 W、频率40 kHz)30 min,放冷,摇匀,滤过,取续滤液,即得。
2.2.5 专属性试验 取忍冬藤配方颗粒所使用的辅料(糊精)适量,按照“2.2.4”项下制备方法制备成阴性对照溶液;取忍冬藤配方颗粒供试品溶液、马钱苷对照品溶液、阴性对照溶液按“2.2.1”项下方法获得其色谱图,结果表明(图1)阴性对照无干扰,表明方法专属性良好。

图1 忍冬藤配方颗粒的专属性分析Fig. 1 Chromatogram of specificity determination of LJC dispensing granules
2.2.6 重复性试验 精密称取同一批号忍冬藤配方颗粒样品6 份,按“2.2.4”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定,以马钱苷峰为参照峰,考察各共有峰相对保留时间和相对峰面积的一致性,结果显示,各共有峰的相对保留时间的RSD<2%,相对峰面积的RSD<3%,供试品指纹图谱相似度>0.90,表明该方法的重复性较好。
2.2.7 中间精密度试验 由2 个分析人员在不同日期分别按“2.2.4”项下方法分别制备6 份供试品溶液,利用不同仪器按“2.2.1”项下色谱条件检测,以马钱苷峰为参照峰,考察各共有峰相对保留时间和相对峰面积的一致性,结果显示,各共有峰的相对保留时间的RSD<3%,相对峰面积的RSD<5%,供试品指纹图谱相似度>0.90,表明该方法的中间精密度较好。
2.2.8 稳定性试验 取同一供试品溶液,分别于0、2、4、8、12、24 h 按“2.2.1”项下色谱条件测定,以马钱苷峰为参照峰,考察各共有峰相对保留时间和相对峰面积的一致性,结果显示,各共有峰的相对保留时间的RSD<1%,相对峰面积的RSD<3%,供试品指纹图谱相似度>0.90,表明供试品溶液稳定性较好。
2.2.9 指纹图谱的建立 取15 批忍冬藤标准汤剂和10 批忍冬藤配方颗粒样品,按“2.2.4”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定,将数据导入“中药色谱指纹图谱相似度评价系统”(2012 版),其叠加色谱图见图2。对15 批忍冬藤标准汤剂的指纹图谱进行多点校正和Mark 峰匹配后,生成忍冬藤标准汤剂的对照指纹图谱(R),见图3。共标定16 个共有峰,并指认了其中11 个成分,分别为新绿原酸(峰3)、马钱苷酸(峰5)、8-表马钱酸(峰6)、绿原酸(峰7)、隐绿原酸(峰8)、当药苷(峰10)、马钱苷(峰11)、断氧化马钱子苷(峰12)、异绿原酸B(峰14)、异绿原酸A(峰15)、异绿原酸C(峰16)。

图2 忍冬藤标准汤剂 (S1~S15) 和配方颗粒 (S16~S25) 的HPLC 指纹图谱Fig. 2 HPLC fingerprints of LJC standard decoctions (S1—S15) and dispensing granules (S16—S25)

图3 忍冬藤标准汤剂对照指纹图谱Fig. 3 Reference fingerprint of LJC standard decoctions
2.2.10 忍冬藤配方颗粒与标准汤剂的指纹图谱比较 采用“中药色谱指纹图谱相似度评价系统”(2012 版)计算相似度,忍冬藤配方颗粒与标准汤剂对照指纹图谱的相似度均>0.9,S16~S18 批配方颗粒与相应标准汤剂(S3)图谱相似度>0.95,表明配方颗粒的生产工艺较为稳定且化学成分与标准汤剂一致性较好。15 批忍冬藤标准汤剂与对照指纹图谱的相似度>0.9,说明不同批次忍冬藤饮片所制备的标准汤剂具有较高的相似度。
2.2.11 聚类分析 将15 批忍冬藤标准汤剂指纹图谱中16 个特征峰的峰面积按制成量折算配方颗粒峰面积,将折算后的峰面积和10 批配方颗粒的峰面积导入SPSS 20.0 软件进行聚类分析,结果见图4。结果发现,当刻度距离为15 时,可分为2 类,配方颗粒S16~S25 与标准汤剂S1~S13、S15 聚为一类,标准汤剂S14 单独聚为一类,说明配方颗粒的生产工艺较稳定,且化学成分与标准汤剂一致性较好。
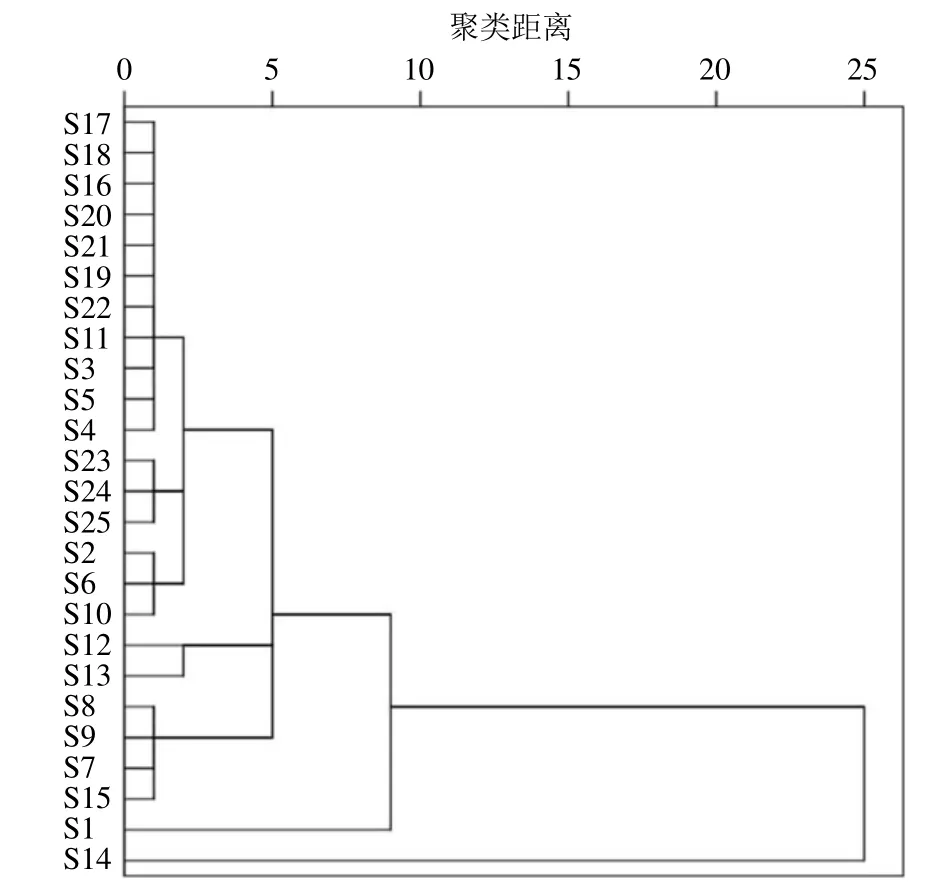
图4 15 批忍冬藤标准汤剂和10 批配方颗粒指纹图谱聚类分析Fig. 4 Fingerprint cluster analysis map of 15 batches of LJC standard decoction and 10 batches of dispensing granules
2.2.12 主成分分析(principal component analysis,PCA) 将15 批忍冬藤标准汤剂HPLC 指纹图谱中16个特征峰的峰面积按制成量折算配方颗粒峰面积,将折算后的峰面积和10 批配方颗粒的峰面积导入SPSS 20.0 软件进行PCA,以特征值>1 为提取标准得到3 个主成分,其方差贡献率分别为52.63%、23.89%、10.15%,累积方差贡献率为86.67%,可以代表16 个共有成分的大部分信息,得分图见图5。结果发现配方颗粒与标准汤剂的成分较为一致,但存在3 批配方颗粒(S23~S25)与其余配方颗粒及标准汤剂样品分布距离较远,分析其原因是由于该3 批配方颗粒峰10(当药苷)峰面积偏高所致。
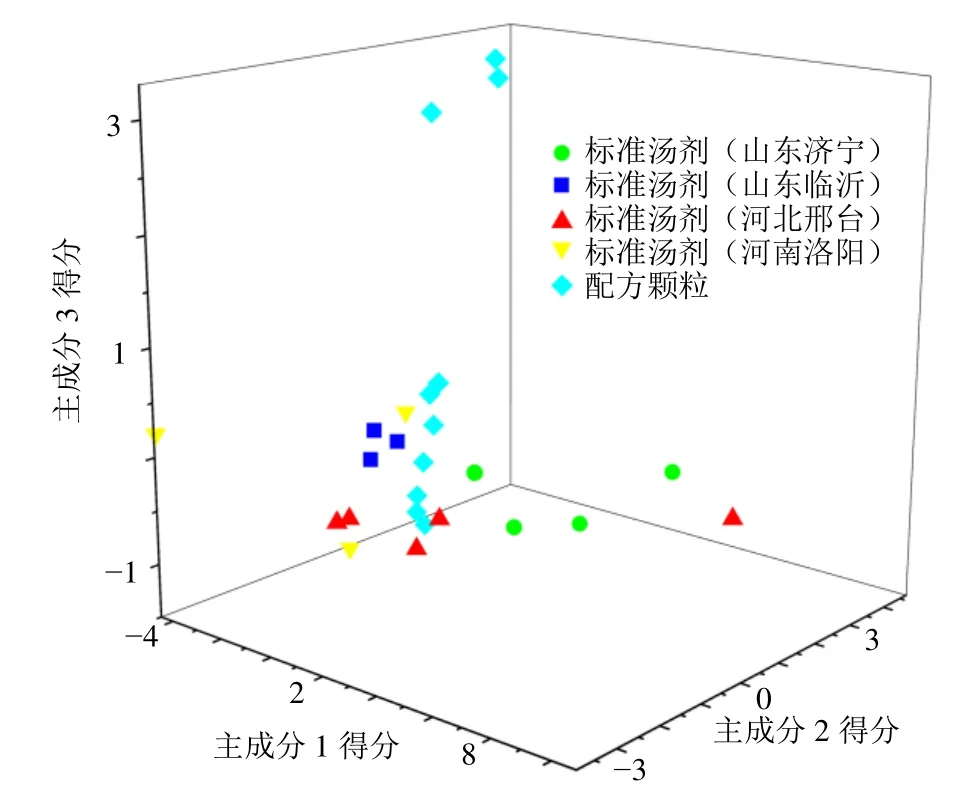
图5 15 批忍冬藤标准汤剂和10 批配方颗粒PCA 得分图Fig. 5 PCA score chart of 15 batches of LJC standard decoction and 10 batches of dispensing granules
2.2.13 偏最小二乘法-判别分析(partial least squares- discriminant analysis,PLS-DA) 将15 批忍冬藤标准汤剂指纹图谱中16 个特征峰的峰面积按制成量折算配方颗粒峰面积,将折算后的峰面积和10 批配方颗粒的峰面积导入SIMCA 14.1 软件进行PLS-DA,获得相应模型,模型参数为RX2为0.985,RY2为0.886,Q2为0.695,均大于0.5,表明拟合模型的准确度和预测能力较好,结果见图6。结果与相似度分析、PCA 结果相似,配方颗粒S16~S18与其对应标准汤剂S3 分布集中,10 批配方颗粒分布集中,表明配方颗粒生产工艺稳定性较好,成分与标准汤剂一致性较好,以上结果与聚类分析及PCA 相似。

图6 15 批忍冬藤标准汤剂和10 批配方颗粒PLS-DA 得分散点图Fig. 6 PLS-DA score scatter plots of 15 batches of LJC standard decoction and 10 batches of dispensing granules
2.3 忍冬藤配方颗粒的HPLC 定量方法研究
2.3.1 色谱条件 色谱柱为Agilent Zorbax SB-C18柱(250 mm×4.6 mm,5 μm);以乙腈-0.4%磷酸水溶液为流动相,梯度洗脱:0~40 min,6%~9%乙腈;40~55 min,9%乙腈;55~65 min,9%~75%乙腈;检测波长236 nm;体积流量1.0 mL/min;柱温30 ℃;进样量10 µL。理论板数按绿原酸峰计算不低于3 000。
2.3.2 混合对照品溶液的制备 取新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷对照品适量,精密称定,加入30%甲醇制成质量浓度分别为0.975 1、1.301 4、1.508 0、1.146 6、1.173 1、2.081 2 mg/mL 的混合对照品储备液,即得。
2.3.3 供试品溶液的制备 采用单因素实验分别对供试品提取方式、提取溶剂、提取时间和取样量等进行考察,确定供试品溶液制备方式为取忍冬藤配方颗粒或标准汤剂冻干粉适量,研细(过五号筛),取约0.2 g,精密称定,置具塞锥形瓶中,精密加入30%甲醇25 mL,称定质量,超声处理(功率250 W、频率40 kHz)30 min,放冷,用30%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
2.3.4 专属性考察 取忍冬藤配方颗粒所使用的辅料(糊精)适量,按照“2.3.3”项下方法制备成阴性对照溶液;取忍冬藤配方颗粒供试品溶液,新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷混合对照品溶液,空白溶液,阴性对照溶液,按“2.3.1”项下方法获得其色谱图,结果表明(图7)表明阴性对照无干扰,方法专属性良好。

图7 忍冬藤配方颗粒的专属性分析Fig. 7 Chromatogram of specificity determination of LJC dispensing granules
2.3.5 线性关系考察 采用逐级稀释法,精密量取适量新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷混合对照品储备液,置于10 mL 量瓶中,加入30%甲醇定容,稀释得到质量浓度分别为97.51、130.14、150.80、114.66、117.31、520.30 µg/mL的对照品溶液,分别稀释1、2、4、8、16 倍,从低到高浓度的混合对照品溶液编号分别为I~V,按照“2.3.1”项下色谱条件进样分析,每个质量浓度平行进样2 次,以质量浓度为横坐标(X),色谱峰峰面积积分值为纵坐标(Y)进行线性回归,得到各指标成分的回归方程和相关系数,结果分别为新绿原酸Y=11.290X-11.353,r=0.999 9,线性范围6.09~97.51 µg/mL;马钱苷酸Y=14.637X-7.810 6,r=1.000 0,线性范围8.13~130.14 µg/mL;绿原酸Y=18.175X-31.221,r=0.999 9,线性范围9.42~150.80 µg/mL;隐绿原酸Y=10.862X-22.52,r=0.999 8,线性范围7.17~114.66 µg/mL;当药苷Y=12.731X-4.369 5,r=1.000 0,线性范围7.33~117.31 µg/mL;马钱苷Y=15.108X-23.868,r=1.000 0,线性范围32.52~520.30 µg/mL。
2.3.6 中间精密度试验 由2 个分析人员在不同日期分别按“2.3.3”项下方法制备6 份供试品溶液,利用不同仪器按“2.3.1”项下色谱条件检测,结果忍冬藤配方颗粒中新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷峰面积的RSD 分别为1.96%、1.60%、2.97%、2.26%、2.48%、0.30%,结果表明方法中间精密度良好。
2.3.7 稳定性试验 取220501 批次忍冬藤配方颗粒供试品溶液,分别于制备后0、2、4、8、12、24 h,按“2.3.1”项下色谱条件进样测定,新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷峰面积的RSD 分别为1.66%、0.30%、0.88%、2.64%、0.14%、0.34%,结果表明供试品溶液在24 h 内稳定性良好。
2.3.8 重复性试验 精密称取220501 批次忍冬藤配方颗粒样品,共6 份,按“2.3.3”项下方法制备供试品溶液,按“2.3.1”项下色谱条件进样分析,新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷质量分数的RSD 分别为1.16%、0.48%、0.67%、0.53%、0.53%、0.71%,结果表明该方法的重复性良好。
2.3.9 加样回收率试验 取0.1 g 忍冬藤配方颗粒,分别加入新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷对照品储备液0.4、1.5、0.2、0.3、0.4、0.7 mL,按“2.3.3”项下方法制备溶液,平行制备6 份,按“2.3.1”项下色谱条件进样分析,计算加样回收率,结果表明,新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷的平均加样回收率分别为99.01%、102.18%、99.92%、97.72%、96.99%、97.42%,RSD 分别为2.26%、1.65%、1.20%、2.64%、2.33%、2.48%,符合分析要求。
2.4 忍冬藤配方颗粒的一测多评方法建立研究
2.4.1 相对校正因子(fi/s)计算 精密吸取“2.3.5”项下系列混合对照品溶液I~V 各适量,按“2.3.1”项下色谱条件进样测定,记录峰面积。以绿原酸为内参物(s),计算新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷的fi/s,计算公式fi/s=AsCi/AiCs,As为内标峰面积,Cs为内标质量浓度,Ai为待测物峰面积,Ci为待测物质量浓度。结果见表2。
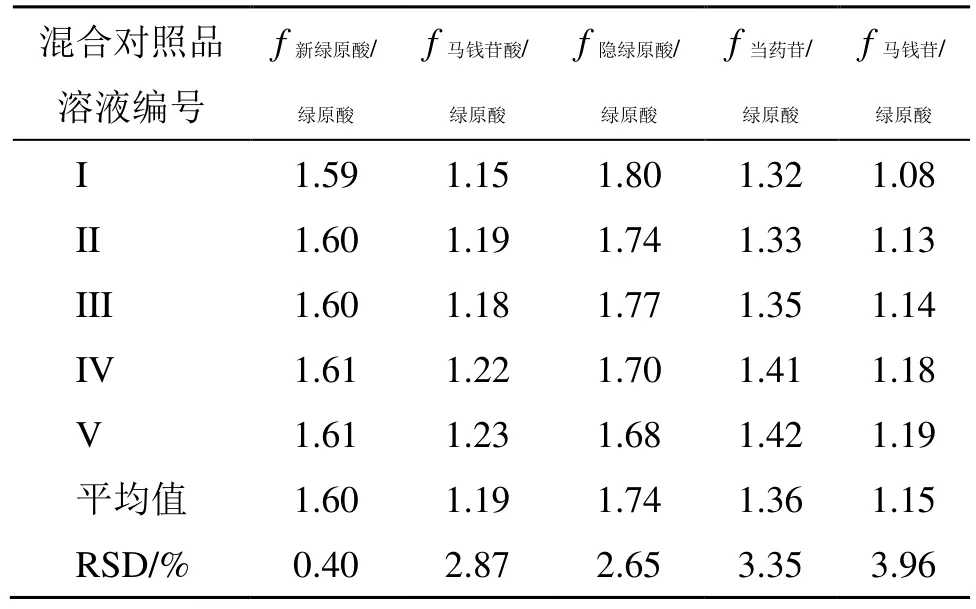
表2 fi/s 计算结果Table 2 fi/s of each component reference
2.4.2fi/s重现性考察 分别考察3 台不同Agilent 1260 高效液相色谱仪、1 台Waters e2695 高效液相色谱仪和6 根不同色谱柱对fi/s的影响,结果见表3,测得的fi/s的RSD 值在2.31%~2.72%,表明各待测组分fi/s在不同仪器和不同色谱柱之间重现性良好。

表3 不同仪器和色谱柱对fi/s 的影响Table 3 Effects of different instruments and chromatographic columns on fi/s
分别考察不同体积流量及柱温对fi/s的影响,结果见表4,测得的fi/s的RSD 值分别在0.56%~1.40%,表明各待测组分fi/s在不同体积流量及柱温之间重现性良好。
2.4.3 待测组分色谱峰定位 分别计算各待测组分与内参物绿原酸的相对保留时间(tR)与保留时间差(Δt),并考察其在不同仪器和不同色谱柱之间的重现性,结果表明(表5),相对保留时间波动较小,最终选择不同仪器和不同色谱柱中各待测成分的相对保留时间值的平均值作为峰定位依据。
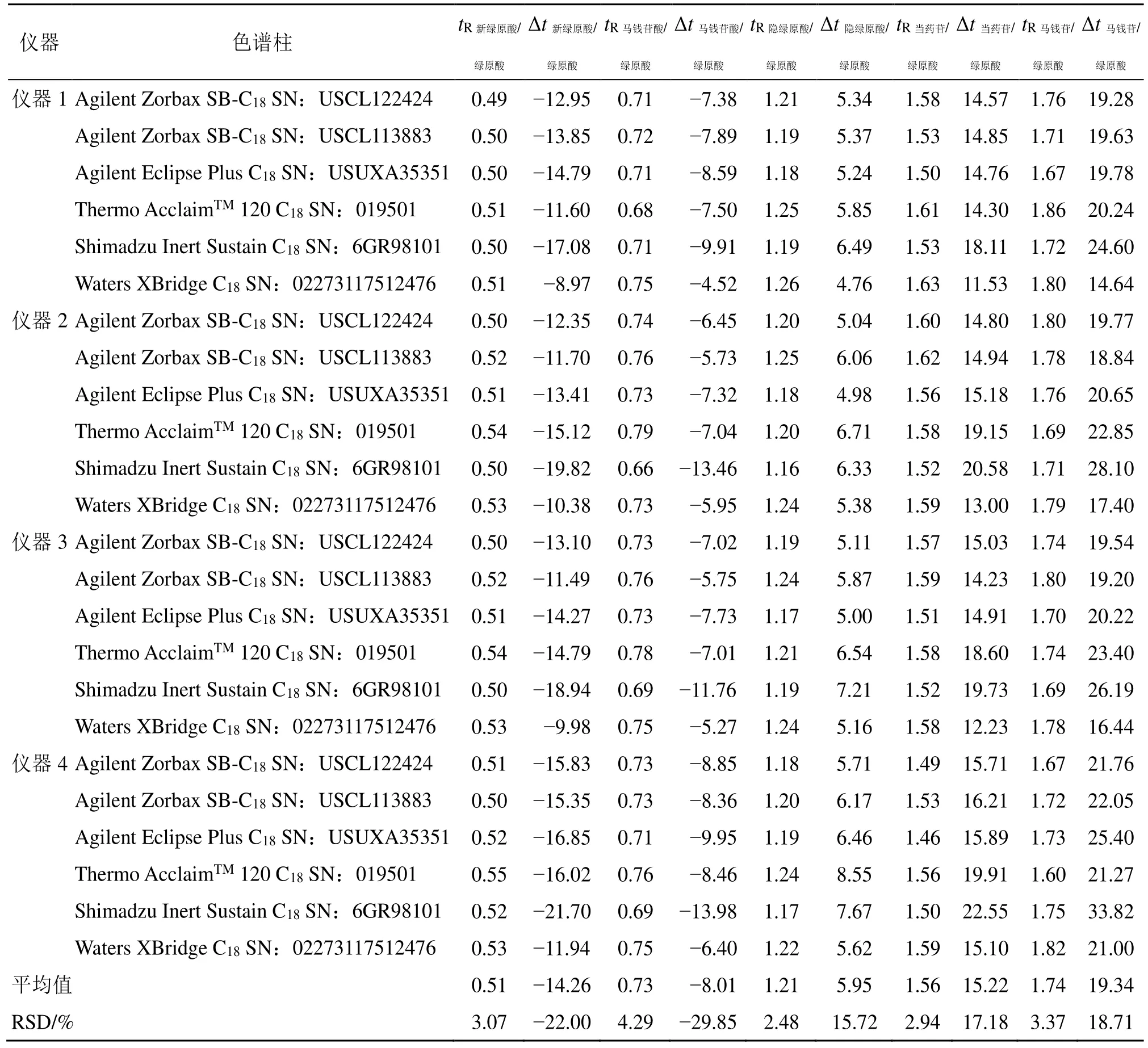
表5 不同仪器和色谱柱中各目标成分的相对保留时间及保留时间差Table 5 Values of r and ΔtR determined by different instruments and columns
2.4.4 一测多评法与外标法测定结果的比较 分别采用一测多评法和外标法计算待测成分的含量,结果见表6。外标法与一测多评法计算的含量经t检验比较,P远大于0.05,表明2 种方法测得的含量无明显差异,且2 组含量之间RSD<2%,表明所建立的一测多评法准确性良好,可用于忍冬藤配方颗粒及标准汤剂的含量测定。
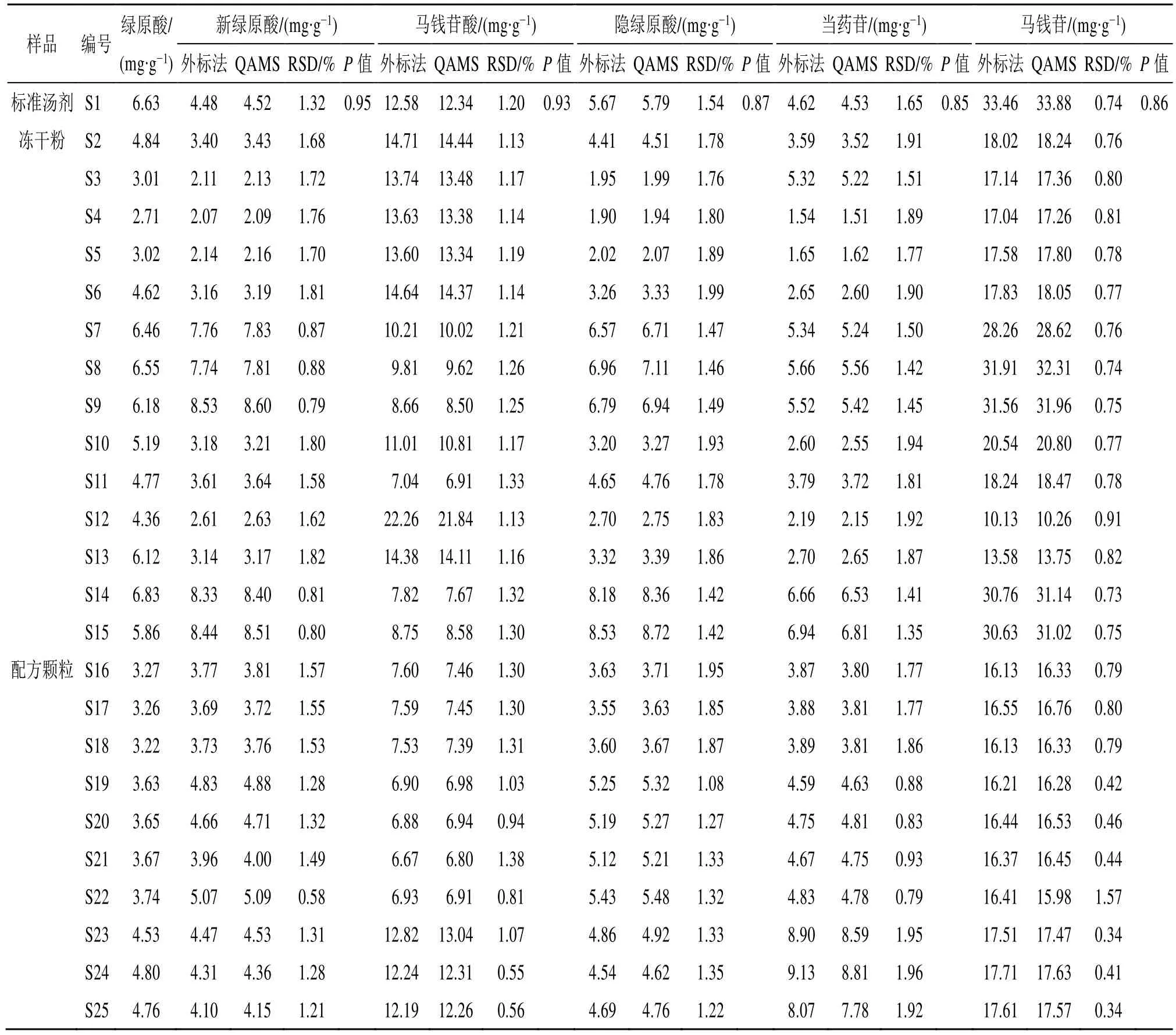
表6 外标法与QAMS 测定忍冬藤中6 种成分含量的比较Table 6 Comparison of six effective constituents determined by external standard method and QAMS in LJC
2.5 忍冬藤配方颗粒与标准汤剂出膏率、有效成分含量及转移率比较
对标准汤剂和配方颗粒的出膏率进行测定,结果见表7、8。15 批标准汤剂的出膏率在7.80%~14.57%,出膏率平均值为11.80%,平均值的70%~130%分别为8.26%~15.34%。3 批配方颗粒的出膏率为14.40%~14.80%,均在15 批标准汤剂出膏率平均值±30%范围内。分别取15 批忍冬藤标准汤剂和3 批配方颗粒,按“2.3.3”项下方法制备供试品溶液,并按“2.3.1”项下色谱条件测定新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷含量。由表7 可知,15 批标准汤剂中新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷质量分数分别为2.09~8.60、6.91~21.84、2.71~6.83、1.94~8.72、1.51~6.81、10.26~33.88 mg/g,平均值分别为4.76、11.96、5.14、4.78、3.98、22.73 mg/g。

表7 忍冬藤标准汤剂的出膏率,新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷的含量及转移率Table 7 Extraction rate of LJC standard decoction, content and transfer rate of new chlorogenic acid, loganic acid,chlorogenic acid, cryptochlorogenic acid, sweroside and loganin

表8 忍冬藤配方颗粒的出膏率、指标成分含量及转移率Table 8 Extraction rate, index ingredients content and transfer rate of LJC dispensing granules
为计算该6 种成分从饮片到配方颗粒和标准汤剂的转移率,需测定其在饮片中的含量。经过考察,确定其测定方法为分别取15 批忍冬藤饮片粉末(过三号筛)约1 g,精密称定,置具塞锥形瓶中,精密加入30%甲醇25 mL,称定质量,回流提取30 min,放冷,用30%甲醇补足减失的质量,摇匀,过0.45 μm 微孔滤膜,取续滤液,按“2.3.1”项下色谱条件进行测定,并计算饮片中新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷含量。6 种指标成分从饮片到标准汤剂的转移率分别为新绿原酸24.14%~41.75%、马钱苷酸40.64%~70.83%、绿原酸26.48%~44.22%、隐绿原酸29.58%~51.97%、当药苷28.96%~46.59%、马钱苷45.73%~84.73%,平均值分别为33.25%、54.53%、35.41%、42.23%、37.10%、65.19%。虽然各指标成分含量差异较大,但转移率较稳定,分析可知是由于相应饮片中指标成分含量差异大。根据《技术要求》,配方颗粒药效物质应与标准汤剂保持一致,需根据标准汤剂的含量及含量转移率范围制定合理含量上下限度。
配方颗粒在制备过程中加入了一定量的辅料,按制成量换算15 批标准汤剂中6 种成分的含量,新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷在配方颗粒中理论质量分数分别为1.57~5.14、4.20~19.81、2.04~6.28、1.46~5.49、1.14~4.84、9.31~32.10 mg/g,平均值为3.34、9.53、3.85、3.42、2.90、16.74 mg/g,分别计算±s、±2s、±3s、平均值的70%~130%范围,为更好的控制配方颗粒的质量,取指标成分含量下限为平均值的70%,含量上限为+3s,将该范围作为配方颗粒可接受的含量限度范围,即新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷质量分数限度范围分别为2.34~7.09、6.67~22.47、2.70~6.97、2.40~7.24、2.03~6.13、11.72~31.93 mg/g。经测定(表6),S16~S22 批配方颗粒6 种指标成分的含量符合所制定配方颗粒含量限度要求,S23~S25批配方颗粒当药苷含量略高于限度范围,其余指标成分含量符合所制定配方颗粒含量限度要求。S23~S25 批配方颗粒均购自山东一方制药有限公司,推测其生产工艺参数或生产设备可能与其他厂家存在差异导致当药苷含量略高于限度要求。
指标成分从饮片到3 批配方颗粒(S16~S18)的转移率分别为46.16%~47.20%、41.87%~42.26%、39.64%~40.17%、58.20%~59.42%、31.14%~31.26%、84.06%~86.26%,基本符合15 批标准汤剂转移率平均值±30%范围。以上数据说明配方颗粒制备工艺较为合理。
3 讨论
3.1 标准汤剂的制备
标准汤剂是指以传统中医药理论作为指导,选取主产区药材或道地药材,经加工炮制而成合格饮片后,按照临床应用时传统汤剂的煎煮方法,参照现代中药提取方法制备而成的单味中药饮片水煎剂。本研究购买15 批次代表性药材炮制成饮片制备标准汤剂。忍冬藤属于清热解毒类中药,药用部位为藤木。《技术要求》标准汤剂制备中规定,清热类药物不宜久煎,煮沸后再煎煮20 min 为宜,质地较硬的饮片可适当延长煎煮时间。结合现代临床用药习惯,在《医疗机构中药煎药室管理规范》相关规定的基础上,出膏率和新绿原酸等6 种指标成分的转移率为主要指标对标准汤剂制备的工艺参数进行优化对标准汤剂制备工艺参数进行考察,确定标准汤剂制备工艺。按照固化的工艺对饮片进行提取,对提取液进行浓缩、冻干,制备成标准汤剂,标准汤剂制备工艺合理,可用于配方颗粒工艺合理性判断及质量标准制定。
3.2 指标性成分的选择
忍冬藤的化学成分较为丰富,其中的主要活性成分为环烯醚萜苷类和有机酸类。对忍冬藤配方颗粒进行成分分析,新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷在忍冬藤中含量较大,生物活性较高[13-21],绿原酸和马钱苷也是《中国药典》忍冬藤药材及饮片质量控制所采用的指标成分。因此,将此6 种成分作为忍冬藤配方颗粒质量评价的指标。
建立一测多评法检测6 种成分含量的方法,其中,绿原酸化学性质稳定且廉价易得,作为内标物,建立其与新绿原酸、马钱苷酸、隐绿原酸、当药苷、马钱苷的fi/s,在不同液相色谱系统与色谱柱中RSD均小于5%,符合测定要求。故选择绿原酸为内标物,以降低检测成本。此方法的建立为全面考察忍冬藤质量提供了参考方法,提示在缺少对照品的情况下,通过fi/s及色谱峰的定位计算含量,可以实现忍冬藤中6 种成分的质量控制。该方法作为忍冬藤质量的一种有效评价方式,可为忍冬藤的质量评价提供参考和依据。
3.3 配方颗粒质量评价标准的建立及与标准汤剂对比分析
本研究收集了4 个产地的15 批忍冬藤药材,根据《技术要求》制备标准汤剂,采用高效液相色谱法建立了忍冬藤标准汤剂和配方颗粒的指纹图谱,建立忍冬藤标准汤剂和配方颗粒中新绿原酸、马钱苷酸、绿原酸、隐绿原酸、当药苷、马钱苷的含量测定方法。以出膏率、指纹图谱、6 种指标成分含量及转移率为指标,并结合化学模式识别分析,多维度衡量了忍冬藤配方颗粒与标准汤剂的一致性,为忍冬藤配方颗粒的生产工艺的研究提供依据。
配方颗粒出膏率在标准汤剂出膏率平均值±30%范围内;3 批配方颗粒与其对应标准汤剂的指纹图谱相似度均>0.95,10 批配方颗粒的指纹图谱相似度>0.9;聚类分析显示3 批配方颗粒可与其对应标准汤剂聚成一类,10 批配方颗粒可与14 批标准汤剂聚为一类;PCA 与PLS-DA 显示3 批配方颗粒对其应标准汤剂S3 分布集中,10 批配方颗粒分布较为集中;除S23~S25 批配方颗粒当药苷含量略高,指标成分的含量在标准汤剂按制成量换算后含量平均值的70%~+3s范围内;6 种指标成分从饮片到配方颗粒中的转移率基本符合从饮片到标准汤剂转移率平均值的70%~130%;以上结果说明忍冬藤配方颗粒制备工艺合理,与忍冬藤饮片临床汤剂物质基础基本一致。以上研究能够比较全面的反映忍冬藤配方颗粒的内在质量,可忍冬藤配方颗粒在临床中的应用提供研究基础,并为其他配方颗粒研究提供思路。
利益冲突所有作者均声明不存在利益冲突

