蒲公英多糖通过下调LncRNA CCAT1 表达抑制MDA-MB-231 细胞增殖、迁移和侵袭
刘晓燕 ,龙 凤 ,黄 勇 ,赵 玉,周 旋,潘靖宇,李 雪,叶海琳
1. 甘肃中医药大学,甘肃 兰州 730000
2. 西安宝石花长庆医院,陕西 西安 710000
3. 甘肃省中医药防治慢性疾病重点实验室,甘肃 兰州 730000
4. 甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室,甘肃 兰州 730000
乳腺癌是女性最常见的恶性肿瘤。2020 年全球癌症统计数据显示,乳腺癌新发病例约有226 万例,死亡68 万例[1]。近年来,乳腺癌的早期诊断和治疗虽然取得了较大进展,但大多数患者极易复发和转移,特别是三阴性乳腺癌(triple negative breast cancer,TNBC)患者。TNBC 是一种雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子2 受体(human epidermal growth factor receptor-2,HER2)均为阴性的乳腺癌亚型,占所有乳腺癌患者的15%~20%[2],由于TNBC 恶性程度高、侵袭性强且缺乏特异性靶向药物,因此,阐明TNBC 的发病机制、寻找新的治疗靶点和抗癌新药尤为重要[3]。
中药是抗肿瘤药物的重要来源,因其具有多靶点、多途径的药理活性,显示出相较于其他药物更明显的抗癌优势及广阔的应用前景[4]。现代临床及药理学研究表明,蒲公英除了具有抗炎、抗氧化等药理活性外,其抗肿瘤作用更为显著[5]。蒲公英多糖(dandelion polysaccharide,DP)是从蒲公英Taraxaci Herba根中提取的多糖类成分,由葡萄糖、半乳糖、阿拉伯糖、甘露糖、鼠李糖、葡糖糖醛酸组成[6],具有抗肿瘤、抗菌、抗炎、抗氧化、降血糖、提高免疫力的药理活性[7]。肝癌体内外生物模型研究表明,DP能够降低缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)和血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白的表达,并通过抑制磷脂酰肌醇3 激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路的激活抑制肝癌血管生成[6]。DP 也可通过降低铁转运蛋白和铁负荷的表达抑制肝癌铁代谢,从而抑制肝癌细胞HepG2 和Huh7 的生长,同时,经DP 处理后的荷瘤Hepa1-6 和H22 的小鼠肿瘤组织中的铁沉积显著低于阴性对照[8]。在乳腺癌中,DP 能够通过抑制细胞增殖、诱导细胞凋亡实现对人乳腺癌MCF-7、SK-BR-3 和T47D 细胞的抑制作用[9-10]。以上研究表明,DP 不仅可以通过多靶点、多通路形式发挥抗肿瘤药理学活性功能,而且具备不良反应少等优势。但DP 抗TNBC和影响TNBC 进展的研究甚少,具体机制尚不清楚。
长链非编码 RNA(long non-coding RNA,LncRNA)是一类长度大于200 个核苷酸的非编码RNA。研究表明,LncRNA 参与调节肿瘤细胞的发生发展,包括细胞增殖、凋亡、血管生成、迁移、侵袭和耐药性[11]。LncRNA 结肠癌相关转录因子1(colon cancer-associated transcript 1,CCAT1)被证实在乳腺癌中过度表达,是乳腺癌进展的潜在预后生物标志物,CCAT1 的下调通过负调控微小RNA-148b(microRNA-148b,miR-148b)的表达来改善乳腺癌细胞的放疗敏感性[12]。CCAT1 还可通过抑制miR-218/锌指蛋白(zinc finger protein X-linked,ZFX)信号通路促进TNBC 细胞增殖、迁移和侵袭[13]。近年来,以LncRNA 为靶点的中药有效活性成分抗肿瘤机制的研究日益增多。研究发现,冬凌草甲素联合敲低肌动蛋白丝相关蛋白1-反义RNA1(actin filamentassociated protein1 antisense RNA 1,AFAP1-AS1)可抑制人胰腺癌细胞增殖、迁移和上皮间质转化(epithelial-mesenchymal transition,EMT),并在体内抑制裸鼠胰腺癌细胞的成瘤性[14];在肝癌细胞中,黄芪甲苷通过下调 LncRNA 转化生长因子 β(transforming growth factor β,ATB)表达而抑制肿瘤细胞的迁移和细胞活力[15];姜黄素通过上调LncRNA母系表达基因3(maternally expressed gene 3,MEG3)表达来抑制吉西他滨耐药的非小细胞肺癌增殖,并诱导细胞凋亡[16];此外,有研究表明,蒲公英根提取物可以通过靶向下调lncRNA CCAT1 表达抑制胃癌细胞的增殖和迁移[17]。然而,DP 联合小干扰RNA(small interfering RNA,siRNA)靶向沉默的CCAT1抑制TNBC 进展的机制研究尚未见报道。
Akt/糖原合成激酶-3β(glycogen synthase kinase-3β,GSK-3β)信号通路是细胞内重要的信号转导途径之一,在多种癌症的发生发展中起着重要作用,如参与肿瘤细胞增殖、凋亡、迁移、侵袭、EMT 及DNA 修复等生物过程,该信号通路激活后可进一步激活下游信号因子影响肿瘤进展,如细胞周期蛋白D1(Cyclin D1)、周期蛋白依赖性激酶6(cyclindependent kinases 6,CDK6)等[18]。Cyclin D1 蛋白是最重要的癌蛋白之一,通过与CDK6 结合形成Cyclin D1-CDK6 复合物驱动细胞从G1期向S 期过渡,从而加速细胞增殖,已有研究证实Cyclin D1 在肿瘤细胞中的过度表达是由于CyclinD1基因的上游信号通路的激活所介导,其上游信号通路包括PI3K/Akt、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信号通路[19]。此外,最近的研究表明,过表达Cyclin D1、CDK6 也可促进肿瘤的迁移、侵袭和EMT[20-23]。因此,寻找能够抑制Akt/GSK-3β/Cyclin D1/CDK6 信号通路的天然产物对抑制TNBC 的发生发展具有重要意义。
本研究通过体外实验,观察DP 联合siCCAT1对MDA-MB-231 细胞增殖、迁移、侵袭及EMT 进程的影响,分析CCAT1 参与调控的信号通路,探寻DP 联合siCCAT1 抑制MDA-MB-231 细胞增殖、迁移、侵袭及EMT 可能的分子调控机制,从而为以CCAT1 为靶点研发治疗TNBC 的靶向药物及药物组合提供实验依据和奠定科学理论基础。
1 材料
1.1 细胞
人正常乳腺上皮细胞MCF-10A 细胞株(武汉普诺赛生命科技有限公司,批号CL-0525),传至3~4 代;人乳腺癌MDA-MB-231 细胞株(武汉普诺赛生命科技有限公司,批号CL-0150),传至7~8 代;人乳腺癌MCF-7 细胞株(中国科学院上海细胞库,批号CL-0149),传至7~8 代。
1.2 药品与试剂
DP(批号SP5220,质量分数≥90%)购自北京索莱宝科技有限公司;MCF-10A 细胞专用培养基(批号CM-0525)购自武汉普诺赛生命科技有限公司;DMEM 高糖培养基(批号C11995500BT)购自美国Gibco 公司;胎牛血清(批号S711-001S)购自南美Lonsera 公司;青霉素-链霉素混合溶液(批号J180034)购自美国HyClone 公司;CCK-8 试剂盒(批号CKO4)购自日本同仁公司;riboFECTTMCP Buffer(10×)、riboFECTTMCP Reagent、lncRNA Smart Silencer NC#1、RiboTMh-CCAT1_Smart Silencer-3、人属CCAT1 引物(批号分别为C10502-05、C10511-05 、 lnc3N0000001-1-5 、 lnc3211122065326 、LQP0002977/8)购自广州市锐博生物科技有限公司;含去gDNA 的定量反转录试剂盒、TB Green 染料法标准型定量试剂盒(批号分别为TKR-RR047A、TKRRR820A)购自日本Takara 公司;兔抗人Vimentin 多克隆抗体、兔抗人E-cadherin 多克隆抗体(批号分别为YT4879、YT1454)购自ImmunoWay Biotechnology Company;兔抗人N-cadherin 单克隆抗体、兔抗人GSK-3β 单克隆抗体、兔抗人p-GSK-3β 单克隆抗体、兔抗人CDK6 单克隆抗体(批号分别为ab76011、ab32391、ab75814、ab124821)购自英国Abcam 公司;兔抗人GAPDH 多克隆抗体、兔抗人p-PI3K 多克隆抗体(批号分别为AF7021、AF3241)购自美国Affinity 公司;兔抗人PI3K 单克隆抗体、兔抗人Akt单克隆抗体、兔抗人p-Akt单克隆抗体、兔抗人Cyclin D1 单克隆抗体(批号分别为4249T、4691T、4060T、2978T)购自美国CST 公司;HRP 标记的山羊抗兔IgG 二抗(批号S0001)购自美国Affinity 公司。
1.3 仪器
Heraguard ECO 型超净工作台(美国Thermo 公司);BX51TF 型倒置显微镜(日本Olympus 公司);FTC-8000 型LightCycler®96 型qRT-PCR 仪(瑞士罗氏公司);小型垂直电泳槽、PowerPac Basic 型小型Trans-Blot 转印槽(美国Bio-Rad 公司);c600 型多功能分子成像分析系统(美国Azure Biosystems 公司)。
2 方法
2.1 细胞培养
MCF-10A 细胞用专用培养基培养;人乳腺癌MDA-MB-231、MCF-7 细胞用含10%胎牛血清和1%青霉素-链霉素的DMEM 高糖培养基,在5%CO2、37 ℃条件下培养。当细胞融合度达到80%~90%,用TrypsinEDTA 溶液消化,1 000 r/min 离心5 min,按1∶2 进行传代再培养。
2.2 细胞转染及分组
使用 riboFECTTM CP 试剂盒和 RiboTM lncRNA Smart Silencer 试剂在MDA-MB-231 细胞中沉默CCAT1 表达。CCAT1 siRNA 的靶序列、以在人转录组中没有靶标的siRNA 作为非靶标对照(si-NC),均由广州锐博生物技术有限公司合成。用riboFECTTM CP 转染试剂在6 孔板中以30%~50%的细胞密度进行siRNA 转染,并将细胞孵育48 h。取对数生长期的MDA-MB-231 细胞,以200 μg/mL DP 处理的细胞作为DP(200 μg/mL)组;将si-NC、si-CCAT1 分别转染至MDA-MB-231 细胞中,作为siNC、siCCAT1 组;将siNC、siCCAT1 分别转染至MDA-MB-231 细胞中再用200 μg/mL DP 处理作为siNC+DP(200 μg/mL)、si CCAT1+DP(200 μg/mL)组;阴性对照组加入含或不含血清的DMEM 培养液。
2.3 CCK-8 检测细胞活力
取对数生长期的细胞,Trypsin-EDTA 胰酶消化后,制成单细胞悬液,将3×103个细胞接种到96 孔板中使其贴壁过夜,将培养液更换为含不同质量浓度(100、200、400、800 μg/mL)DP 的新鲜培养基,或将细胞按照“2.2”项下方法处理。设置空白组(不接种细胞和加入不含药物的培养基)、对照组(只接种细胞和加入不含药物的培养基),每组设4 个复孔。分别处理12、24 和48 h,或将细胞按照“2.2”项下方法处理细胞,孵育48 h。随后加入CCK-8 工作液(10 μL/孔),培养箱中放置2.5 h 后,采用酶标仪测定450 nm 处的吸光度(A)值,计算细胞存活率。
细胞存活率=(A实验-A空白)/(A对照-A空白)
国家的税制改革中规定了配合国家住房制度的改革,即企业和行政事业单位如果按照房改成本价进行住房的出售人取得的收入将免征增值税。当前,我国在进行大中型林场的棚户区改革建设,如果建立千套住房,每套住房的成本价是45万元的话,千套住房实现降低税负4500万元,这是进行营改增之后为林场提供的福利政策,同时也使林场的职工更加热爱林业建设。因此可以说营改增的利好政策主要包括三点:政府进行财政补助的利好;银行给予贷款房屋的利好;税收部门进行税收减免的利好。
2.4 生物信息学技术
在线数据库 AnnoLnc2(http://annolnc.gaolab.org/)和RNAinter(www.rnainter.org/search/)预测与CCAT1 相互作用的miRNA,通过取交集筛选出 miRNA。然后,通过在线数据库 ENCORI(http://starbase.sysu.edu.cn)预测 miRNA 的下游靶基因。再用DAVID 在线软件对交集出来的靶基因进行基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
2.5 qRT-PCR 检测CCAT1 基因表达
收集各组细胞后,用RNAiso Plus 试剂盒提取总RNA,超微量核酸蛋白测量仪在260 nm/280 nm 波长处检测RNA 浓度。根据试剂盒说明书使用riboSCRIPTTM mRNA/lncRNA RT-qPCR Starter Kit试剂盒通过qRT-PCR 法检测各组细胞CCAT1的表达水平,CCAT1引物由广州锐博生物技术有限公司提供,GAPDH引物由北京博迈德生物提供,引物序列见表1。去除基因组DNA 反应条件为42 ℃、2 min 或室温5 min;反转录反应条件为37 ℃、15 min,85 ℃、5 s。采用2-ΔΔCt法分析CCAT1相对表达。

表1 引物序列Table 1 Primer sequences
2.6 划痕实验
使用Mark 笔在6 孔板的背面作均匀穿过孔的直线,每孔穿过3 条线。取对数生长期的细胞,Trypsin-EDTA 胰酶消化后,将细胞以1×106个/孔均匀接种于6 孔板中并加入完全培养基,待细胞长到85%~90%,更换为无血清培养基培养细胞12 h。随后用200 μL 的无菌枪头作每孔中预先所画横线的垂线,PBS 清洗2 遍以除去漂浮的细胞,随后按“2.2”项下分组处理细胞后,于倒置显微镜随机选择3 个独立视野拍下0 h 划痕照片后,在培养箱中培养48 h,在0 h 拍摄的区域拍下48 h 划痕愈合的照片。
迁移率=(0 h 划痕面积-48 h 划痕面积)/ 0 h 划痕面积
2.7 Transwell 实验
Matrigel 基质胶、DMEM 培养基按1∶8 比例稀释混匀后,加入40 μL 均匀铺于Transwell 上室底部,于37 ℃孵育3 h 待其凝固,吸去上清液后,按“2.2”项下分组处理过的MDA-MB-231 细胞密度调整为5×105个/mL,取100 μL 加入上室中,下室每孔加入含20%胎牛血清的DMEM 培养基500 μL,37 ℃、5% CO2培养箱培养18 h,结束后用棉签拭子擦除小室上层未侵袭的细胞,4%组织细胞固定液固定,0.1%结晶紫染色。最后,倒置显微镜下随机选择5 个区域进行拍照,并人工计数,计算细胞侵袭率。
细胞侵袭率=各组细胞侵袭数量/空白组细胞侵袭数量
2.8 Western blotting 检测 E-cadherin 、 Ncadherin、Vimentin、PI3K、p-PI3K、Akt、p-Akt、GSK-3β、p-GSK-3β、Cyclin D1 和CDK6 蛋白表达
将处于对数生长期的MDA-MB-231 细胞以5×105个/孔接种于6 孔板,在37 ℃、5% CO2下培养过夜,细胞贴壁后,用预冷PBS 清洗2 遍,按“2.2”项下分组处理细胞48 h,收集细胞,提取细胞总蛋白,用BCA 试剂盒测定蛋白浓度,按照说明书加入合适比例的4×蛋白上样缓冲液,100 ℃水浴加热5 min,使蛋白变性。12 000 r/min 离心5 min,取上清并分装保存于-80 ℃。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜;于5%脱脂牛奶室温封闭60 min 后,分别加入GAPDH(1∶3 000)、E-cadherin(1∶1 000)、N-cadherin(1∶5 000)、Vimentin(1∶1 000)、PI3K(1∶1 000)、p-PI3K(1∶1 000)、Akt(1∶1 000)、p-Akt(1∶2 000)、GSK-3β(1∶5 000)、p-GSK-3β(1∶1 000)、Cyclin D1(1∶1 000)、CDK6(1∶5 000)抗体,于4 ℃孵育过夜;加入HRP 标记的山羊抗兔IgG 二抗(1∶3 000),于室温摇床孵育2 h 后,使用ECL化学液显色,Western 印迹成像系统拍照,Image J软件测定蛋白条带的灰度值,并进行统计分析。
2.9 统计学分析
3 结果
3.1 CCAT1 在人乳腺癌组织和细胞中的表达
lnCAR database 在线数据工具分析显示,与正常乳腺组织相比,CCAT1在乳腺癌组织中表达显著上调(图1-A)。与MCF-10A 及MCF-7 细胞相比,CCAT1在三阴性乳腺癌MDA-MB-231 细胞中的表达显著上调(P<0.01,图1-B)。此外,另有研究表明,CCAT1高表达组乳腺癌患者总生存期和无进展生存期明显短于CCAT1低表达组,且CCAT1的表达是乳腺癌患者总生存期和无进展生存期的不良预后因素[24]。上述结果表明,CCAT1在乳腺癌组织和细胞系中高表达并与患者生存期较短显著相关。
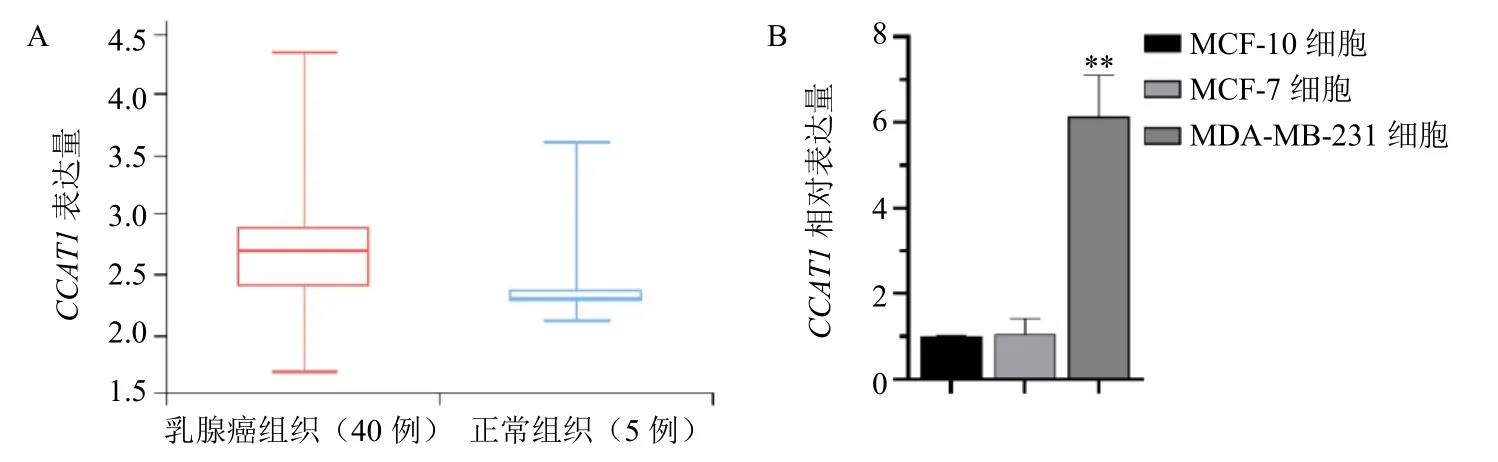
图1 LncRNA CCAT1 在乳腺癌组织及细胞中的相对表达量 (±s, n = 3)Fig. 1 Relative expression of LncRNA CCAT1 in breast cancer tissues and cells (±s, n = 3)
3.2 DP 联合siCCAT1 对乳腺癌细胞活力的影响
为了检测DP 对乳腺癌细胞毒性的影响,使用了2 种乳腺癌细胞系(MCF-7 和MDA-MB-231),和正常乳腺上皮细胞(MCF-10A)来评估DP 对乳腺癌的选择性。如图2-A~C 所示,DP 呈剂量和时间相关性地抑制MCF-7 和MDA-MB-231 细胞活力(P<0.05、0.01),而对MCF-10A 细胞活力无明显影响。如图2-D 所示,DP 对MCF-10A 细胞中CCAT1的表达水平无显著影响,而呈剂量相关性地下调MCF-7 和MDA-MB-231 细胞中CCAT1的表达水平,且DP 下调MDA-MB-231 细胞中CCAT1的表达更为明显(P<0.01)。综合以上实验结果,本研究采用能够抑制细胞存活率且对CCAT1的表达有显著抑制作用的质量浓度为200 μg/mL 的DP 及对DP 抑制作用更为敏感的MDA-MB-231 细胞进行后续研究。如图2-E 所示,与siNC 组比较,siCCAT1的表达水平降低(P<0.01)。如图2-F 所示,DP 和siCCAT1 均能下调MDA-MB-231 细胞中CCAT1的表达水平(P<0.01),且DP 联合siCCAT1 更加显著的降低了CCAT1表达水平(P<0.01)。如图2-G所示,与siNC 组比较,siCCAT1 可显著降低细胞活力(P<0.01),且DP 联合siCCAT1 对MDA-MB-231 细胞活力的抑制作用更为明显(P<0.01)。综上结果表明,DP 联合siCCAT1 抑制了MDA-MB-231细胞的活力。
3.3 DP 联合siCCAT1 对MDA-MB-231 细胞迁移和侵袭能力的影响
如图3 所示,与对照组比较,DP 能够显著抑制MDA-MB-231 细胞的迁移和侵袭(P<0.01);与siNC 组比较,siCCAT1 能够显著抑制MDA-MB-231细胞的迁移和侵袭(P<0.01),且DP 联合siCCAT1对MDA-MB-231 细胞迁移和侵袭的抑制作用更为明显(P<0.01)。上述结果表明,DP 和siCCAT1 抑制了MDA-MB-231 细胞的迁移和侵袭。
3.4 DP 联合siCCAT1 对MDA-MB-231 细胞EMT进程相关蛋白表达的影响
如图4 所示,与对照组比较,DP 组E-cadherin表达上调(P<0.01),而N-cadherin 和Vimentin 的表达均下调(P<0.05、0.01);与siNC 组比较,siCCAT1组E-cadherin 表达上调(P<0.01),而N-cadherin 和Vimentin 的表达均下调(P<0.01);DP 联合siCCAT1处理MDA-MB-231 细胞后,E-cadherin 表达相较于DP 组和siCCAT1 组显著上调(P<0.01),而Ncadherin 和Vimentin 的表达相较于单独应用DP 或siCCAT1 下调更为明显(P<0.01)。结果表明,DP 联合siCCAT1 抑制了MDA-MB-231 细胞EMT 进程。
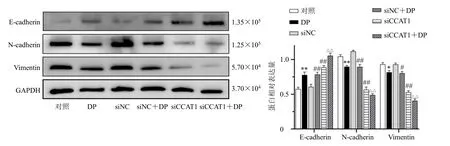
图4 DP 和siCCAT1 对MDA-MB-231 细胞EMT 进程相关蛋白表达的影响 (±s, n = 3)Fig. 4 Effect of DP and siCCAT1 on expressions of EMT process-related proteins in MDA-MB-231 cells (±s, n = 3)
3.5 基于生物信息学技术分析CCAT1 下游靶基因及其参与调控的相关信号通路
为了探索CCAT1 参与调节MDA-MB-231 细胞增殖、迁移和侵袭的分子机制,通过在线数据库AnnoLnc2 和RNAinter 预测与CCAT1 相互作用的miRNA,通过交集筛选出5 个miRNA,分别是miR-7-5p、miR-155-5p、miR-152-3p、miR-218-5p、miR-490-3p(图5-A),其中已有研究报道miR-152-3p、miR-218-5p、miR-490-3p 与CCAT1 之间存在互补位点[25-27];然后,通过在线数据库ENCORI 预测miR-152-3p、miR-218-5p、miR-490-3p 下游靶基因,共取得miRNA 相互交集的靶基因1 929 个,其中包括Akt 及GSK-3β(图5-B)等。之后用DAVID 在线软件对这1 929 个靶基因进行GO 功能及KEGG通路富集分析,发现这些靶基因主要富集在RNA 聚合酶II 启动子转录调控、信号转导、转录调控、DNA模板和蛋白磷酸化等关键生物过程(图5-C);KEGG信号通路富集结果显示,筛选出的靶基因主要富集在癌症、PI3K/Akt、MAPK 信号通路(图5-D)。PI3K、Akt、GSK-3β 是Akt/GSK-3β 信号通路中的关键调控分子。Cyclin D1 是Akt/GSK-3β 信号通路的下游效应分子,在肿瘤细胞中,Cyclin D1 与CDK6 形成Cyclin D1-CDK6 复合物,参与细胞生长、迁移、侵袭及凋亡的调控[28]。因此,推测CCAT1 可作为Akt/Cyclin D1/CDK6 信号通路的上游分子来参与调控MDA-MB-231 细胞增殖、侵袭及迁移。
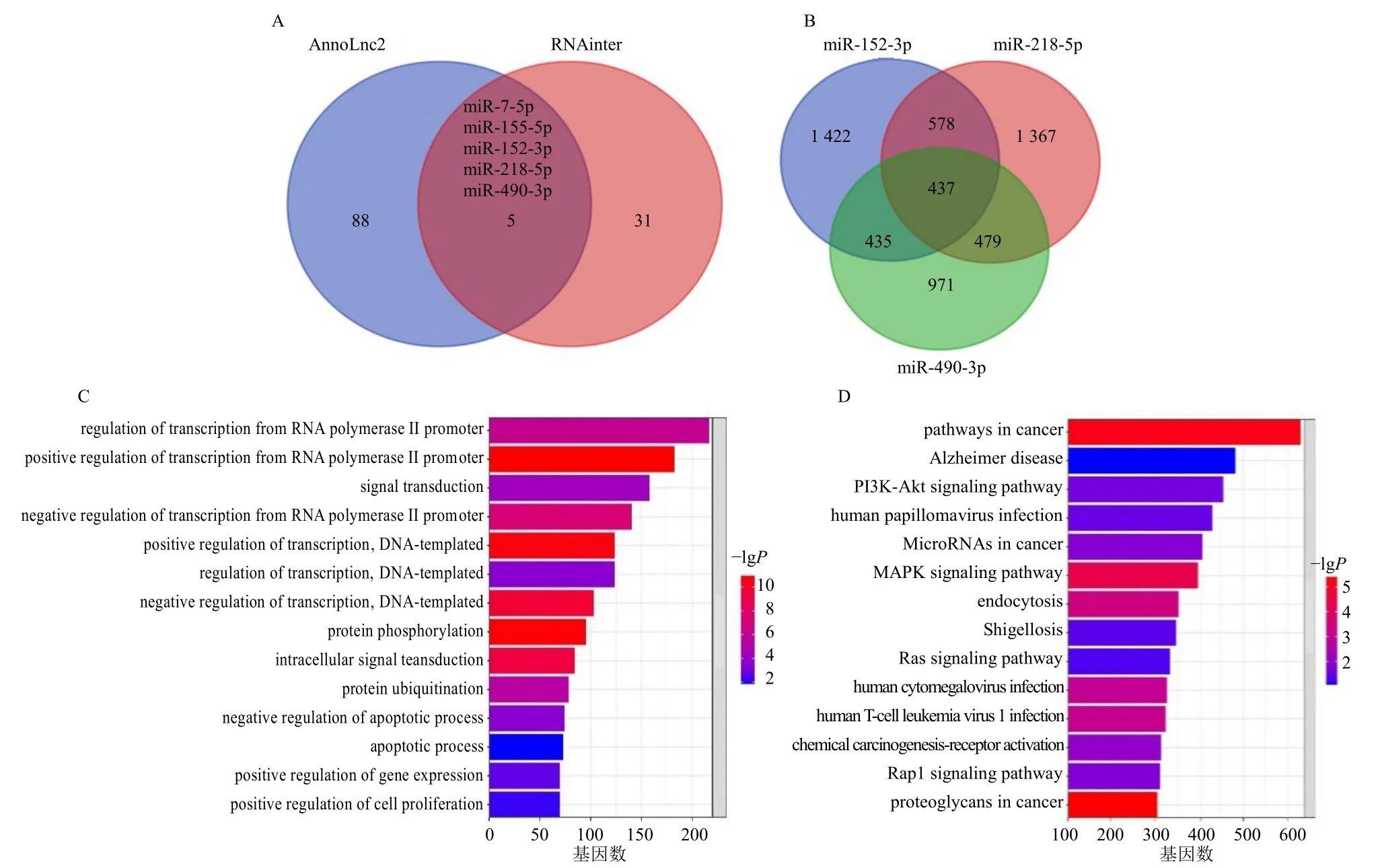
图5 生物信息学技术分析CCAT1 靶基因及其参与调控的相关信号通路Fig. 5 Bioinformatics technology analysis of CCAT1 target genes and related signaling pathways involved in regulation
3.6 DP 联合siCCAT1 对MDA-MB-231 细胞中Akt/GSK-3β/Cyclin D1/CDK6 信号通路中关键蛋白表达的影响
如图6 所示,与对照组比较,DP 下调了MDAMB-231 细胞中p-PI3K、p-Akt、p-GSK-3β 及Cyclin D1、CDK6 蛋白表达水平(P<0.05、0.01);与siNC组比较,siCCAT1 组p-PI3K、p-Akt、p-GSK-3β 及Cyclin D1、CDK6 蛋白表达水平下调(P<0.01),且DP 联合siCCAT1 较单独应用DP 和siCCAT1 下调更为显著(P<0.01)。以上结果表明,DP 和siCCAT1 抑制MDA-MB-231 细胞增殖、迁移、侵袭和EMT 进程的作用机制可能与抑制Akt/GSK-3β/Cyclin D1/CDK6 信号通路有关。
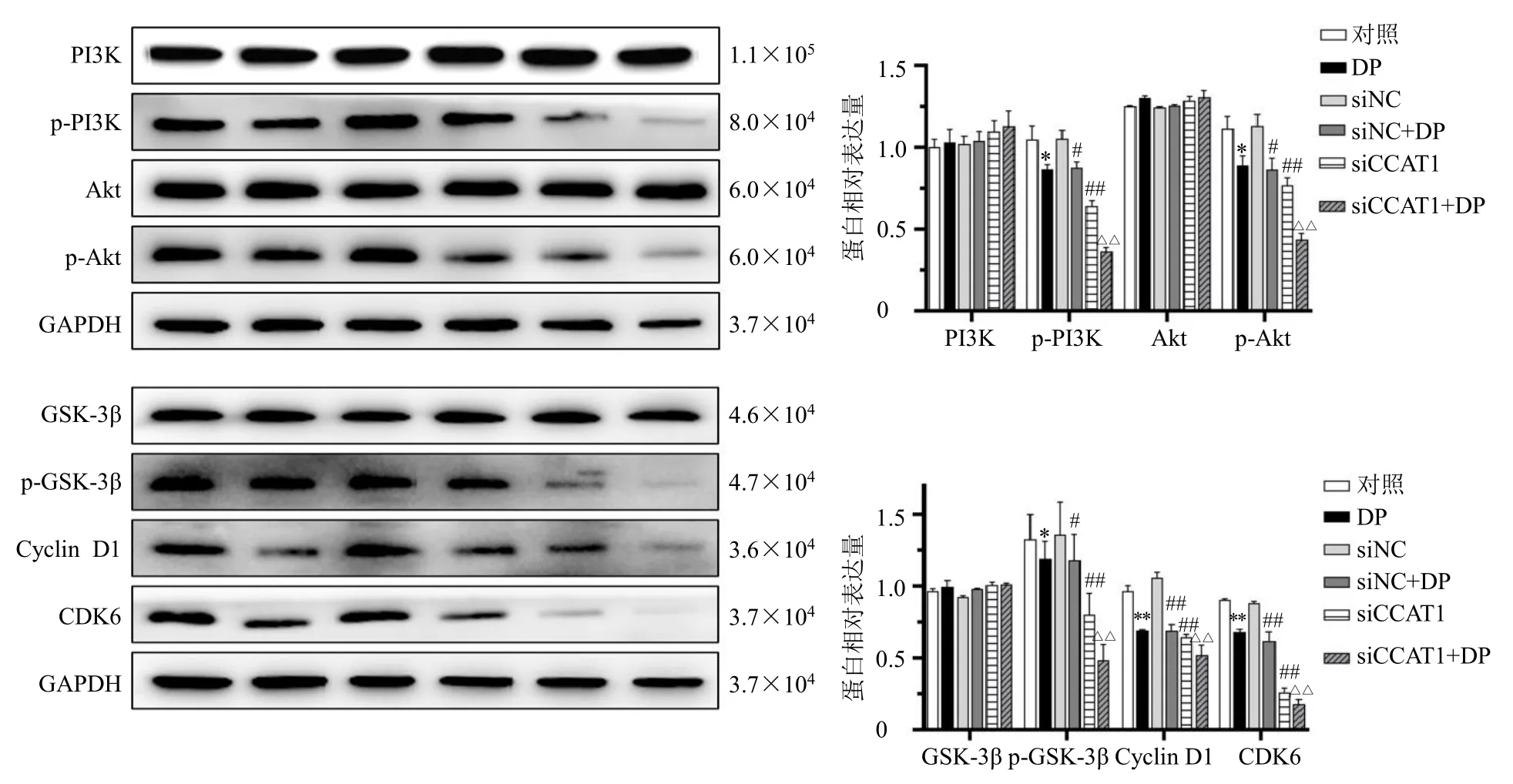
图6 DP 联合siCCAT1 对MDA-MB-231 细胞中Akt/Cyclin D1/CDK6 信号通路中关键蛋白表达的影响 (±s, n = 3)Fig. 6 Effect of DP combined with siCCAT1 on expressions of key proteins in Akt/Cyclin D1/CDK6 signaling pathway in MDA-MB-231 cells (±s, n = 3)
4 讨论
蒲公英有着悠久的药用历史,可用于治疗乳痈、瘰疬、疔疮肿毒等症[29]。蒲公英的化学成分非常复杂,主要包括多糖[30]、三萜[31]、黄酮[32]类化合物。近年来体内外实验研究表明,蒲公英全草提取物及蒲公英根提取物具有很强的抗癌活性,如蒲公英根提取物可通过降低活性氧水平和B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的表达来诱导黑色素瘤细胞凋亡[33];蒲公英根提取物还可通过抑制PI3K/Akt 、 Ras/Raf/ 细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路以及内源性胱硫氨酸-β-合成酶/硫化氢系统来影响食管鳞状细胞癌的进展[34];此外,蒲公英全草提取物与化疗药物紫杉醇和米托蒽醌联合用药后对癌细胞具有协同促凋亡作用,不仅能够增强前列腺癌DU-145 细胞对紫杉醇和米托蒽醌的敏感性,而且能够降低人前列腺癌异种移植瘤小鼠的肿瘤负荷,且对小鼠无不良反应[35]。DP 是从蒲公英根中提取的最主要的有效活性成分之一,有研究报道DP 可通过降低铁代谢和抑制血管生成在肝癌中发挥抗肿瘤作用[6,8]。本研究首次揭示DP 对乳腺癌细胞的抗癌作用,发现DP 可抑制MDA-MB-231 和MCF-7 细胞增殖,而对MCF-10A 细胞活力影响不明显。
随着高通量测序技术的发展,LncRNA 的功能开始受到广泛的关注,越来越多的研究表明,LncRNA 通过调控基因转录和转录后处理参与包括乳腺癌在内的各种癌症的生理过程,如细胞增殖、迁移、侵袭、凋亡、EMT 进程、干细胞分化和耐药性,并致力于从LncRNA 中发现新的乳腺癌诊断、治疗和预后靶点[36-37]。研究表明,Lnc RNA CCAT1在乳腺癌组织中表达上调,且CCAT1 高表达与乳腺癌患者的疾病进展和不良预后呈正相关,提示CCAT1 可能参与乳腺癌的发生发展,是乳腺癌患者潜在的预后标志物[24,38]。在此基础上,本研究通过数据库数据分析及qRT-PCR 结果表明CCAT1在乳腺癌组织和细胞中表达上调。同时,为了进一步验证CCAT1 在乳腺癌细胞中的表达情况,本研究采用qRT-PCR 检测乳腺癌细胞中CCAT1mRNA 的表达,与之前的研究结果一致,本结果显示CCAT1在人乳腺癌MDA-MB-231 和MCF-7 细胞中的表达高于MCF-10A 细胞中的表达,且在MDA-MB-231 细胞中异常高表达。此外,本研究发现,DP 可下调乳腺癌细胞中CCAT1的表达水平,提示CCAT1 可能是DP 治疗乳腺癌的潜在分子靶点。联合治疗被认为是恶性肿瘤临床治疗的最佳选择,在本研究中,DP 和siCCAT1 联合治疗显著增强了单独使用DP或siCCAT1 治疗对MDA-MB-231 细胞增殖、迁移、侵袭和EMT 的抑制作用,这表明DP 联合siCCAT1可作为联合用药组合提高乳腺癌治疗效果。
LncRNA 作为内源性的“海绵”或ceRNA 与microRNA(miRNA)相互作用,并通过调控下游靶基因影响肿瘤细胞的增殖、迁移和侵袭[39],如LncRNA SLC16A1-AS1 通过miR-552-5p/WIF1 途径抑制乳腺癌的增殖和转移[37];LncRNA LRP11-AS1通过miR-149-3p/NRP2 轴促进TNBC 细胞的增殖和迁移[40]。在本研究中,通过数据库预测了与CCAT1相互作用的miRNA,并检索了包括GSK-3β 在内的miRNA 下游靶蛋白,通过对这些靶蛋白KEGG 信号通路分析,筛选出富集最多的PI3K/Akt 信号通路。越来越多的研究表明,Akt/GSK-3β 信号通路在各种癌症中异常激活,并调控细胞增殖、凋亡、迁移、侵袭和EMT 进程,一旦Akt/GSK-3β 通路被抑制,癌症转移也会受到抑制[41-42]。研究报道,猕猴桃根提取物通过抑制Akt/GSK-3β 信号通路,抑制MDA-MB-231 细胞增殖、迁移、侵袭和EMT 进程,诱导细胞凋亡[43]。在TNBC 体内外生物模型中,抑制Akt/GSK-3β 信号通路可有效抑制TNBC 增殖和转移,逆转EMT 进程进程[44]。与报道一致,本结果显示,DP 或siCCAT1 均能有效抑制MDA-MB-231 细胞中Akt/GSK-3β 信号通路关键蛋白的表达水平,且DP 联合siCCAT1 蛋白表达水平下调更为明显,因此推测,DP 联合siCCAT1 可抑制Akt/GSK-3β通路参与的MDA-MB-231细胞恶性生物学行为。研究表明,活化的GSK-3β 可以激活下游核内转录因子Cyclin D1 蛋白的表达[45],Cyclin D1 是一种重要的细胞周期蛋白,在正常细胞中,Cyclin D1 的表达水平受到严格调控,但在肿瘤细胞中表达上调,通过与CDK6 结合形成具有活性的Cyclin D1-CDK6 复合物来驱动细胞从G1期向S 期过渡,而Cyclin D1 的过表达会促进Cyclin D1-CDK6 复合物的过度激活,导致细胞周期失控,从而加速肿瘤细胞增殖[19],如上调Cyclin D1 和CDK6 的表达可以促进未成熟卵巢畸胎瘤细胞增殖[46];山柰酚通过抑制CDK6/Cyclin D1 通路抑制人胆囊癌SGC996 和GBC-SD 细胞的增殖,并诱导细胞凋亡[47];最近的研究发现Cyclin D1、CDK6 过表达能够促进肿瘤细胞迁移、侵袭和EMT[23,48],因此推测DP 和siCCAT1抑制MDA-MB-231 细胞增殖、迁移、侵袭和EMT可能与抑制Cyclin D1/CDK6 信号通路有关,进一步验证发现,DP 或siCCAT1 均可下调MDA-MB-231 细胞中Cyclin D1、CDK6 蛋白表达水平,且DP联合siCCAT1处理MDA-MB-231细胞后Cyclin D1、CDK6 蛋白表达水平较单独使用DP 和siCCAT1 处理的细胞中Cyclin D1、CDK6 蛋白表达水平下调更为明显,提示DP 和siCCAT1 对Cyclin D1/CDK6 信号通路存在一定的抑制作用,这为靶向Cyclin D1、CDK6 抑制剂的研发提供了新的药理学依据。总之,本研究结果表明,DP 联合siCCAT1 抑制MDA-MB-231 细胞增殖、迁移、侵袭和EMT 的分子作用机制可能是通过阻断Akt/GSK-3β/Cyclin D1/CDK6 信号通路来实现的。
越来越多的研究表明,LncRNAs 通过调节EMT进程的发生参与肿瘤进展[49]。EMT 进程是肿瘤细胞迁移和侵袭的重要机制之一,在这个过程中,肿瘤细胞从上皮细胞表型过渡到高侵袭性间充质表型,一旦激活EMT 进程,肿瘤细胞就会发生一系列变化,包括紧密连接的溶解、顶端-基底极性的破坏和细胞骨架结构的重塑,这些变化都有利于肿瘤细胞迁移和侵袭[50],在分子水平上,上皮样标志物Ecadherin 表达降低、间充质标志物N-cadherin 和Vimentin 表达升高标志着细胞EMT 进程的发生[51]。多项研究表明,EMT 进程标志物可作为乳腺癌患者治疗和生存结果的预测因素[52]。本研究结果显示,DP 和siCCAT1 均可下调MDA-MB-231 细胞中Ncadherin、Vimentin 表达水平,上调E-cadherin 表达水平,且DP 联合siCCAT1 下调N-cadherin、Vimentin表达水平,上调E-cadherin 表达水平较单独使用DP和siCCAT1 更为显著,提示DP 通过下调CCAT1 的表达抑制了MDA-MB-231 细胞EMT 进程,且DP联合siCCAT1 获得更佳的抗癌疗效,这为靶向EMT的抗乳腺癌新药组合的开发提供了新的理论依据。
综上,本研究首次证实了DP 能够以剂量相关性的方式下调MDA-MB-231 细胞中CCAT1的表达,此外,DP 和siCCAT1 均能抑制MDA-MB-231细胞的增殖、迁移、侵袭和EMT,且DP 联合siCCAT1 的抑制作用更显著,这种抑制作用可能是通过阻断Akt/GSK-3β/Cyclin D1/CDK6 信号通路来实现的(图7)。本研究为DP 治疗TNBC 提供了药理学依据,为以CCAT1 为靶点研发治疗乳腺癌靶向药物及药物组合提供了依据。然而,DP 抗乳腺癌作用是通过多途径、多靶点实现的,后续还需进一步完善其抗乳腺癌的其他作用机制。此外,本研究为 DP 通过抑制 CCAT1/Akt/GSK-3β/Cyclin D1/CDK6 信号通路抗TNBC 提供了体外实验依据,研究结果缺乏临床应用性,未来需要通过动物体内实验更深一步验证DP 抗TNBC 的分子作用机制,以使其能够尽早进入临床,为肿瘤治疗提供新的方法。

图7 DP 在MDA-MB-231 细胞中的抗肿瘤分子机制Fig. 7 Molecular mechanism of DP against tumor in MDAMB-231 cells
利益冲突所有作者均声明不存在利益冲突

