纳米银对无脊椎动物毒性效应的研究进展*
陆 浩 孔祥云 侍崇敬 徐冰洁 张文超 秦粉菊 刘恒蔚 袁红霞
(苏州科技大学,苏州,215009)
纳米银(AgNPs)由于优良的物理、化学和生物特性,被广泛应用到航空、医学、农业、工业等领域,是目前使用量最多的纳米材料.其产量巨大,据估计目前全球AgNPs年产量在500—1000 t 之间[1].随着AgNPs 产品的大量使用,其在生产、运输、使用及后期处理中不可避免地会流入环境中,导致环境中AgNPs 含量不断增加[2].现有分析技术还很难检测AgNPs 在环境中的真实浓度,Giese 通过建模估算了AgNPs 流入到不同环境中的范围值(表1)[1],发现AgNPs 含量在环境中不断增加.土壤和水体是AgNPs 汇集的主要场所[3−4].Sun 等预计欧盟污水处理厂污泥中AgNPs 含量在(0.008—0.01)mg·kg−1之间,自然和城市土壤中AgNPs 每年增加量为(0.91—1.8)ng·kg−1[5].Deycard 等报道污水中可能检测出的AgNPs 含量在(6.9±2.0)mg·kg−1[6].环境中的AgNPs 会通过食物链进入生物体产生毒害作用,已经在许多动物体中广泛研究,包括软体、甲壳、鱼类、鸟类和哺乳类动物等.同时如本文中所讨论的AgNPs 理化性质、环境、涂层等因素都会影响其毒性作用.
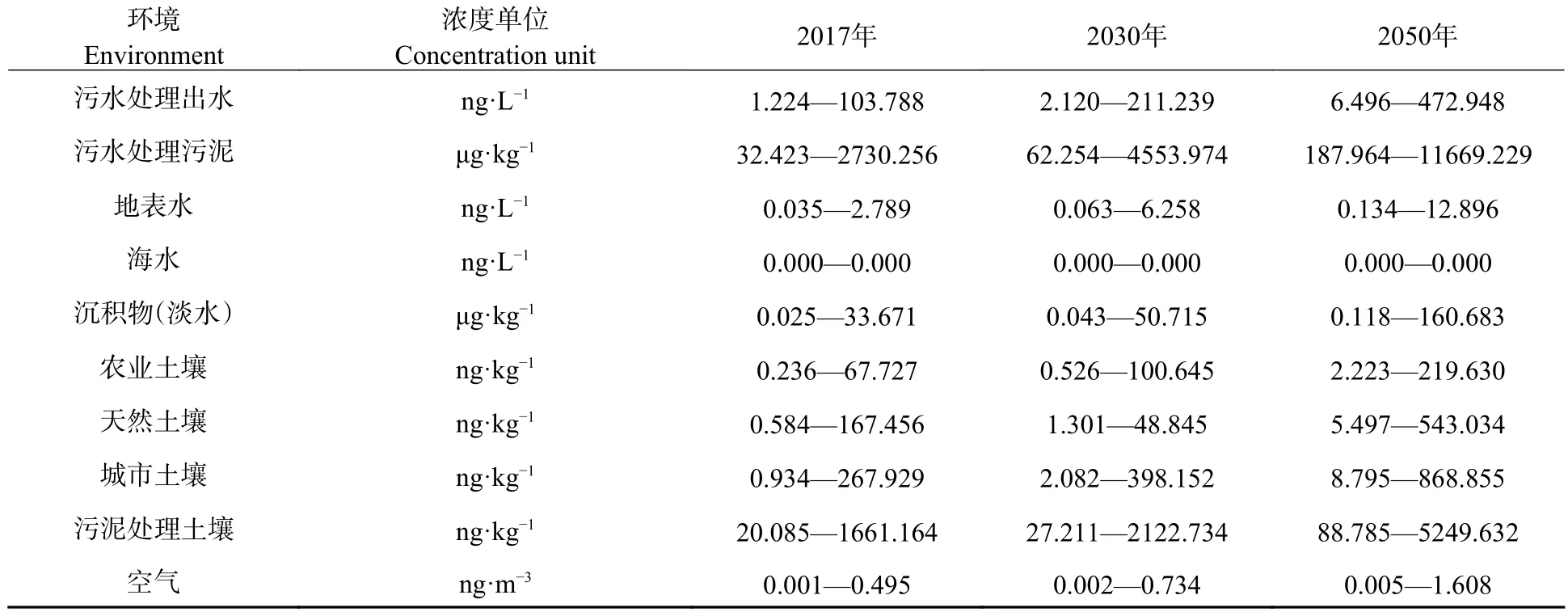
表1 AgNPs 在不同环境中的浓度范围[1]Table 1 Concentration range of AgNPs in different environments[1]
目前国内外文献关于AgNPs 毒性的研究进展主要从生物种类(如微生物、植物、动物等)、生物个体(如小鼠、斑马鱼、水蚤、昆虫等)或者特定环境(如水、土壤等)等角度总结,其中涉及到对无脊椎和脊椎动物的毒性[7−9].而无脊椎动物种类数占动物总种类数的95%,是生态系统的重要组成.由此,AgNPs 的扩大生产和广泛应用更易对无脊椎动物构成严重危害.相较于脊椎动物,蚯蚓、秀丽隐杆线虫、贻贝、水蚤等无脊椎动物具有生理特征代表性、便于获取和培养、繁殖周期短、饲养成本低、无伦理限制等特点[10−14],已被广泛应用于AgNPs 生态毒性测试.研究性文献中因实验对象、暴露时间、毒性指标、AgNPs 的理化性质、暴露浓度等差异,对这些研究结果很难进行比较分析,AgNPs 的毒性机制也仍不清晰.
本文主要从累积效应、急性毒性、生长发育毒性、组织病症、生殖毒性、遗传毒性和回避行为等方面总结了AgNPs 对无脊椎动物的影响.除此之外,AgNPs 的理化特性、表面涂层、暴露途径、环境[15−18]等因素都可以影响AgNPs 对无脊椎动物的毒性.从无脊椎动物所获得的AgNPs 毒性效应,可用于推测AgNPs 对生态系统的影响以及对脊椎等其他动物体可能产生的毒性.但迄今还未见AgNPs 对无脊椎动物毒性效应的研究综述.本文通过阅读大量国内外文献,较为系统地总结了AgNPs 对无脊椎动物的影响,并对未来研究方向及重点做了进一步展望.
1 AgNPs 对无脊椎动物的影响(Effects of AgNPs on invertebrates)
1.1 累积效应
生物累积是纳米材料致毒的前期行为,是对生物产生危害的一种机制[19].AgNPs 在环境和生物之间可以进行迁移转化,使其在无脊椎动物体内的累积作用研究尤为必要[20−21].由于研究所用的受试生物、培养环境、粒径、表面涂层、暴露时间以及浓度不同,很难通过生物累积量来判断各类无脊椎动物对AgNPs 生物累积能力高低.但可以看出,不同无脊椎动物对AgNPs 都具有一定程度的生物累积能力.通常,消化系统是无脊椎动物积累AgNPs 最高的部位.Li 等研究显示AgNPs 暴露组威廉环毛蚓体内的Ag 主要分布在消化系统,且消化系统中的Ag 含量占整个威廉环毛蚓中总Ag 的68.9%,AgNPs在消化系统中的高积累可能是土壤中释放的高浓度AgNPs 被肠道上皮细胞吸收所造成,肠粘膜中的一些关键受体(如Na+、K+、ATP 酶)、与肠道及其微生物群落相关的特定氧化还原和溶质条件可能会促进AgNPs 的摄取;此外,Ag 在消化系统中的高积累可能还与无脊椎动物的解毒策略有关,AgNPs 在肠细胞中可以与金属硫蛋白(MT)结合,产生的Ag-MT 复合物被隔离在溶酶体中,阻碍了AgNPs 向机体其他部位的转移[22].
Cozzari 等研究表明,沙蚕从水溶性银中累积Ag 的效率高于AgNPs[23].同样,Bao 等研究了AgNPs及硝酸银对淡水蜗牛不同组织的银负荷,结果发现,蜗牛从硝酸银中累积的银含量高于AgNPs[24].造成这种现象的原因,可能是由于摄取途径的不同,硝酸银主要通过质子耦合通道、质子泵、吞噬和胞饮作用等非特异性摄取途径大量积累,AgNPs 则主要是通过内吞途径来积累[25](图1),并且由于AgNPs 容易聚集并形成生物电晕,也降低了其生物累积量[26].但是Cong 等研究了硝酸银和AgNPs 对沙蚕的生物累积,发现沙蚕对于两种形式的银负荷没有差异[27].这表明不同的无脊椎动物,对于两种形式银的累积差异,至今仍没有统一的定论.表2 集中列出了AgNPS 对无脊椎动物的生物累积.

图1 AgNPs 对无脊椎动物毒性机制Fig.1 Toxicity mechanism of AgNPs in invertebrates
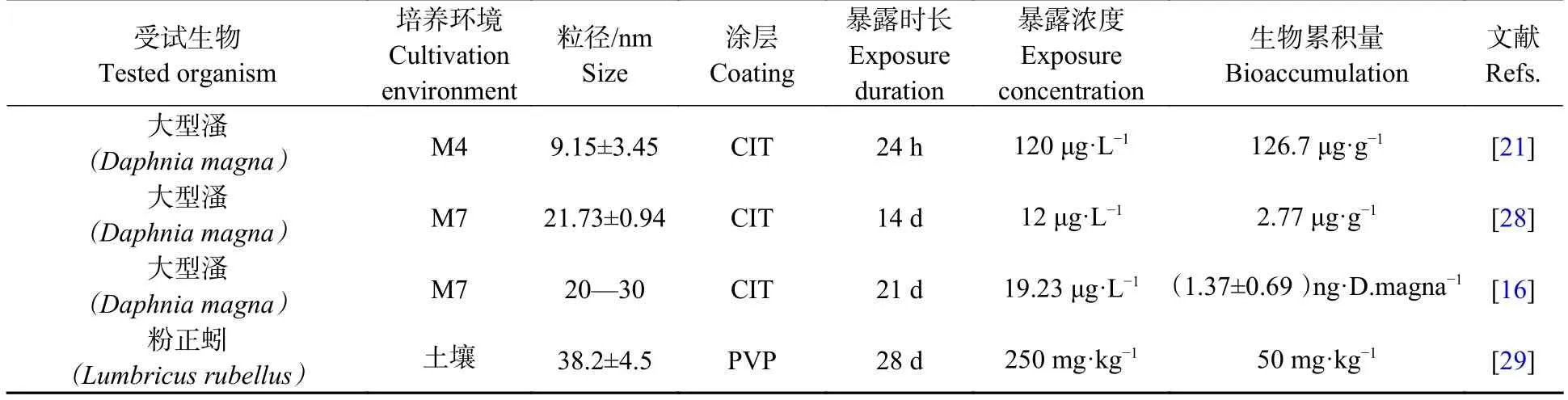
表2 AgNPs 对无脊椎动物的生物累积Table 2 Bioaccumulation of AgNPs in invertebrates
1.2 毒性效应
(1)急性毒性和生长发育毒性
AgNPs 对无脊椎动物的急性毒性结果,可以用来直接快速、直观的判断AgNPs 毒性的强弱.急性毒性测试指标主要为半数有效浓度(50% effect concentration,EC50)和半数致死浓度(50% lethal concentration,LC50)(表3).有研究表明,AgNPs 对无脊椎动物的急性毒性在很大程度上是因为AgNPs 颗粒的溶解[38].Ivask 等将大型溞的EC50标准化为溶解的Ag+,发现AgNPs 的溶解校正EC50值与AgNO3相似,这就表明AgNPs 的急性毒性是由释放的Ag+引起的,但10 nm 的AgNPs 急性毒性却高于Ag+,原因可能是由于10 nm 及更小的AgNPs 颗粒与细胞相互作用后在细胞外表面或细胞内部溶解,从而更具生物利用度[39].
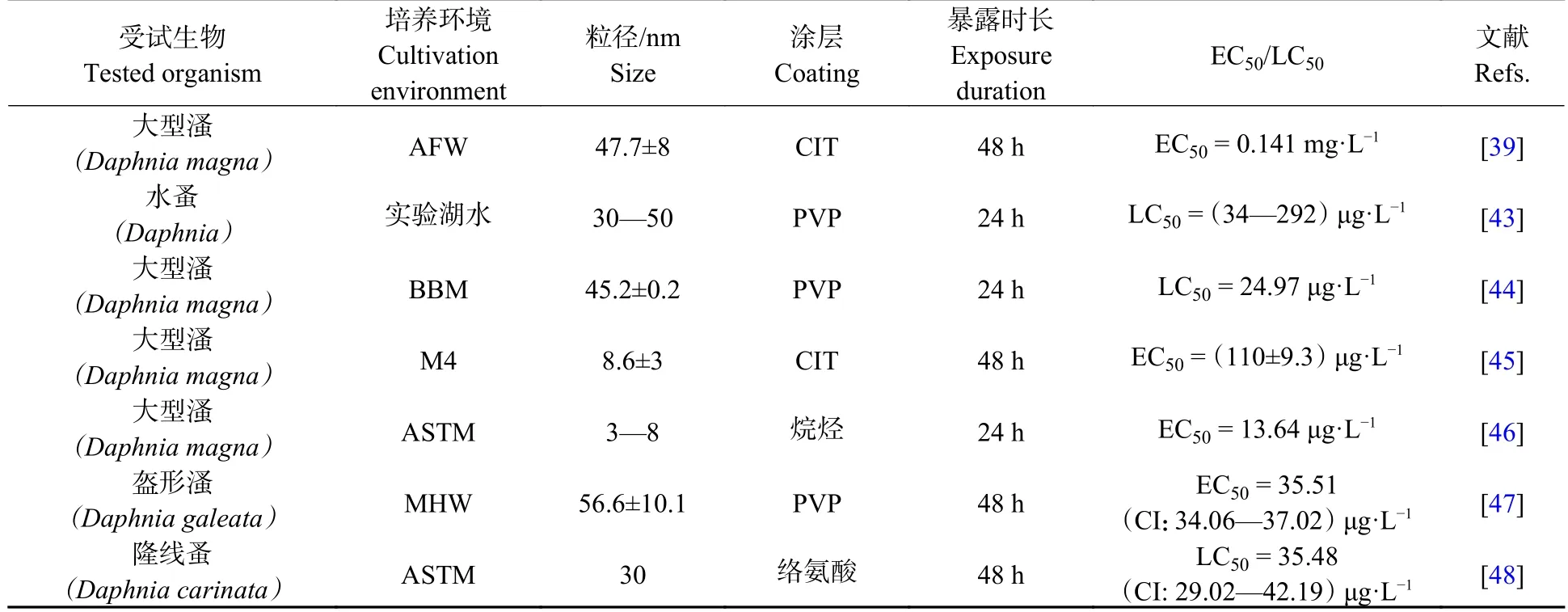
表3 AgNPs 对无脊椎动物急性毒性数据Table 3 Acute toxicity data of AgNPs to invertebrates
急性毒性试验只是初步了解AgNPs 对无脊椎动物的毒性高低.在自然环境中,无脊椎动物会长期暴露在含有AgNPs 的环境中.有研究报道,在长期接触下,AgNPs 会影响无脊椎动物的生长发育[40].Zhao 等发现,AgNPs 可以显著抑制大型溞的体长,造成抑制的原因可能是因为食物质量的下降,水中AgNPs 和藻类在大型溞肠道结合,导致大型溞对食物吸收率下降,从而影响大型溞的生长发育[41].Mehennaoui 等研究了不同粒径AgNPs 对淡水钩虾生长发育的影响,结果发现10 nm AgNPs 比60 nm AgNPs 更具有抑制效果,可能因为小粒径的AgNPs 在动物内部溶解,并释放出更有抑制效果的Ag+,研究指出对于生长发育的抑制,可能是因为淡水钩虾甲壳上有关吸附的感官被破坏;另一种假设是生物体运动量的减少,更加有利于防御机制的能量再分配[30].但AgNPs 并非只对无脊椎动物的生长发育产生抑制效果,Mackevica 等发现,大型溞在低浓度(10 μg·L−1)AgNPs 暴露下,反而促进了其生长发育[42].
(2)组织病症
组织病症相较于死亡率和体重的变化对低水平AgNPs 暴露更敏感[22].有研究发现,蜗牛经AgNPs 食物相暴露14 d 后,其胃肠道、肾脏、消化腺以及足出现不同程度组织学形态变化.蜗牛胃肠道出现明显的黏膜损伤与细胞死亡脱落,肾脏组织细胞出现不规则排列、部分细胞脱落,消化小管排列疏松、细胞质内出现较多圆形空泡、部分基底破损、组织细胞部分糜烂脱落,足组织胶原蛋白原纤维排列疏松、细胞间隙增宽并出现较多嗜碱性颗粒团块[17].AgNPs 对消化腺的损害,会使蜗牛消化食物的能力下降,从而对蜗牛的生长发育产生影响[55].Chen 等也发现,400 mg·L−1AgNPs 对家蚕组织结构的损害,家蚕的基底膜被破坏,杯状细胞扩张,柱状细胞变形,此外还观察到异常的细胞结构和许多片状结构的出现,这表明AgNPs 会对组织产生不良影响,并可能对主要靶器官,例如对家蚕的消化器官产生有害影响[56].
(3)生殖毒性
AgNPs 会诱导无脊椎动物生殖细胞的凋亡,从而抑制其繁殖.Luo 等发现秀丽隐杆线虫捕食暴露于1、5、10 μg·mL−1AgNPs 的大肠杆菌后,其性腺细胞凋亡的数量显著增加,性腺减数分裂区的生殖细胞死亡率显著增加[57].但也有研究发现,在低浓度AgNPs 暴露下,大型溞的繁殖得到了促进,推测可能是因为AgNPs 具有优良的灭菌性能;而随着AgNPs 浓度的提高,大型溞的产溞数显著减少,则是因为高浓度时AgNPs 毒性较大,对大型溞的机体造成了不可逆的损伤,从而对大型溞的繁殖产生了不良影响[28];另一种推测是因为AgNPs 抑制了大型溞的摄食,导致其能量储备减少,进一步影响了大型溞的繁殖[58].氧化应激是AgNPs 诱导生殖毒性的主要机制,Lim 等对秀丽隐杆线虫中氧化应激及其信号通路进行研究,发现AgNPs 会导致野生型(N2)秀丽隐杆线虫中活性氧自由基(reactive oxygen species,ROS)增加,低氧诱导结合蛋白(HIF-1)、谷胱甘肽S 转移酶(glutathione s-transferase,GST)的激活以及繁殖潜力下降,其中PMK-1 p38 丝裂原活化蛋白激酶(MAPK)在AgNPs 诱导的氧化应激中起重要作用[59].
(4)遗传毒性
遗传毒性是化学毒性测试和风险评估中重要的毒性终点之一[60].AgNPs 的遗传毒性机制,目前认为主要是以下两种:第一种是通过诱导ROS 增加,干扰DNA 复制、转录、抑制相关蛋白质,还会导致嘧啶和嘌呤衍生的氧化损伤;第二种是AgNPs 直接进入细胞作用于细胞器(例如,纺锤体、着丝粒等)[61],抑制复制、转录,导致染色体丢失,断裂[62],见图1.Choi 等研究了AgNPs 对赤子爱胜蚓的遗传毒性,发现AgNPs 会引起赤子爱胜蚓DNA 损伤,AgNPs 暴露可以使细胞内ROS 增加,引起细胞氧化应激,最终导致DNA 损伤[63].同样,Alaraby 等通过彗星实验发现,AgNPs 对果蝇产生遗传毒性是因为氧化应激所引起的DNA 损伤[64].Botelho 等研究发现,不同浓度和不同时间AgNPs 暴露增加了片脚甲壳动物Parhyalehawaiensis的微核、核芽和核异常的比例[65].AgNPs 不仅会对亲代产生毒性效应,对其子代也会造成损害.目前已有研究观察到AgNPs 对土壤线虫繁殖的多代效应,Wamucho 等发现秀丽隐杆线虫多代暴露于AgNPs 会诱导未暴露子代的表观遗传变化[66].同样,Pakrashi 发现,AgNPs 不仅对大型溞母体产生毒害,而且使母体中AgNPs 约1%—2%的总累积Ag 转移到新生水蚤中,这就表明AgNPs 可能会对水蚤的繁殖产生更持久的不利影响[67].
(5)回避行为
回避行为是动物遇到不利环境的逃避反应,它是一个生态相关的测量结点,用来快速判断污染物的毒性强弱.回避试验装置简单,操作便捷,反应快速,周期短,是一种很好地检测AgNPs 毒性的方法.目前,人们已经做过蚯蚓、秀丽隐杆线虫、土鳖虫等无脊椎动物的回避试验,通过测定一定浓度AgNPs 对无脊椎动物个体行为的影响程度来判定其毒性大小[68].Brami 等研究了蚯蚓对AgNPs 的回避试验,发现蚯蚓对AgNPs 回避行为比繁殖等传统终点更为敏感,在最低浓度(12.5 mg·kg−1)时就可以观察到回避现象,但目前还不清楚回避行为是由AgNPs 释放的Ag+触发,还是AgNPs 触发[10].在现有文献中主要用以下3 种机制来解释土壤无脊椎动物的回避行为:第一种是污染物使土壤中微生物群发生变化,导致土壤无脊椎动物适口性的改变(如:AgNPs 以及Ag+会改变微生物群落结构);第二种是土壤无脊椎动物具有化学和机械感受器,金属颗粒的神经毒性作用或生物化学感觉器敏感性可以使它们主动避开有害环境或移动到更有利的环境;第三种是由于污染物进入到土壤无脊椎动物体内,引起土壤无脊椎动物的不适,从而引起回避行为[69−71].
2 AgNPs 对无脊椎动物毒性的主要机制(Main mechanism of AgNPs toxicity to invertebrates)
目前,关于AgNPs 对无脊椎动物的毒性机制仍不是十分清晰.根据现有研究总结其可能的机制如图1 所示.AgNPs 暴露后,释放Ag+,离子与颗粒通过内吞等方式进入细胞,在细胞内产生大量ROS,ROS 与细胞膜表面蛋白结合,破坏细胞膜的完整性,从而导致细胞膜损伤[72].线粒体是AgNPs 诱导氧化应激的主要靶细胞器之一,线粒体中高水平的ROS 导致线粒体损伤,最终导致细胞凋亡[73].细胞内ROS 的增加,会导致氧化应激并破坏细胞成分,造成氧化型DNA 损伤,链断裂,核酸修饰,脂质过氧化,蛋白质变性,抗氧化酶的激活以及抗氧化分子的消耗;此外,AgNPs 诱导的ROS 通过激活细胞信号传递,触发炎症反应[72−73].
Bao 等发现,蜗牛暴露于AgNPs 后,足部和消化道在Ag 浓度很低的情况下也会诱发显著的氧化应激,其中过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)活性较对照组酶活显著增加,这些氧化应激可能是由于AgNPs 与生物体细胞的接触触发的[24].Pan 等研究发现,AgNPs 对原生动物嗜热四膜虫的毒性是由于高活性氧水平引起的,从而导致了脂质过氧化和线粒体功能障碍,为了对抗氧化胁迫,嗜热四膜虫激活了抗氧化系统,增加了谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)和其他抗氧化剂的活性[74].Chen 研究了家蚕中AgNPs 的毒性机制,表明ROS 的增加诱导了肌醇加氧酶(MIOX)基因表达下调,影响线粒体形态并导致氧化损伤,且AgNPs 也会抑制超氧化物歧化酶(superoxide dismutase,SOD)活性,引起持续的氧化应激,从而诱导细胞凋亡[56].Ahamde 等研究了AgNPs 在果蝇中的毒性机制,发现经AgNPs 暴露后,细胞内产生大量ROS,导致膜损伤、氧化应激以及线粒体损伤,最终导致细胞凋亡;此外,还发现氧化应激导致细胞周期检查点蛋白p53 和细胞信号蛋白p38 上调,这两种蛋白参与DNA 损伤和凋亡等多种过程,是评估遗传毒性的分子标记,说明氧化应激诱导了DNA 损伤[75].
3 影响AgNPs 对无脊椎动物毒性效应的因素(Factors influencing the toxic effects of AgNPs on invertebrates)
AgNPs 的理化性质、表面涂层、环境、暴露途径等因素都可以影响AgNPs 对无脊椎动物的毒性(图2).表4 集中汇总了部分AgNPs 对无脊椎动物毒性的影响因素.

图2 AgNPs 对无脊椎动物毒性的主要影响因素Fig.2 Main influencing factors of AgNPs toxicity to invertebrates

表4 AgNPs 对无脊椎动物毒性的主要影响因素Table 4 Main influencing factors of AgNPs toxicity to invertebrates
3.1 理化性质
AgNPs 的理化性质,包括AgNPs 的尺寸、形貌、晶型、表面特性等[84].AgNPs 的理化性质对无脊椎动物的毒性有很大影响.目前普遍认为AgNPs 粒径越小其毒性越强,AgNPs 粒径在20—80 nm 的毒性效应主要由其溶解释放的Ag+引起,而粒径较小的AgNPs 颗粒(10 nm)更容易被生物体利用,毒性效应更大[39].Hou 等使用40 nm 和110 nm AgNPs 对大型溞做了毒性研究,结果发现,40 nm AgNPs 比110 nm AgNPs 的LC50值更低,这可能是由于40 nm AgNPs 的溶解速率比110 nm AgNPs 快,小粒径AgNPs 颗粒比表面积更高,生成焓更高[44].Moon 等使用AgNPs 颗粒、纳米银线、纳米银板分别对秀丽隐杆线虫进行毒性测试,结果发现AgNPs 颗粒和纳米银板对秀丽隐杆线虫的生长和繁殖具有抑制现象,而纳米银线的影响却微乎其微,其中AgNPs 颗粒毒性最大,从侧面也说明AgNPs 颗粒在毒性水平上起着重要作用,AgNPs 颗粒毒性大于纳米银线及纳米银板可能是因为球形更容易在消化道中溶解[79].
3.2 表面涂层
为了提高AgNPs 的性能,可以使用不同的表面涂层.目前比较常用的表面涂层有PVP、CIT、聚乙烯醇(polyvinyl alcohol,PVA)[85−87]等.使用PEG 可以降低AgNPs 颗粒表面能,从而增加其胶体稳定性[88];CIT 具有低分子量,并通过静电斥力保护AgNPs;亲水性的PVP 具有空间稳定性[89].不同表面涂层AgNPs 对无脊椎动物毒性大小也不一样.Hou 等通过大型溞的急性毒性实验,发现CIT-AgNPs 的LC50比PVP-AgNPs 的LC50更低,说明CIT 包覆的AgNPs 毒性更大,这可能是因为PVP 涂层的稳定性使Ag 能够被完整的封装,减少了Ag+的释放,因而AgNPs 毒性降低[44].
3.3 环境
由于生态系统中物理化学等变量的变化,生物体对AgNPs 的可变敏感性正受到越来越多的关注[43].例如环境中不同的光照、盐度、pH、温度、暴露介质等,都可能影响AgNPs 对无脊椎动物的毒性.Lish 等研究了AgNPs 在不同环境条件下对卤虫无节幼体的急性毒性效应,发现环境条件可以改变AgNPs 的稳定性,使其稳定性下降,导致更多的Ag+释放,从而导致其毒性的改变[83].Conine 等则是研究了不同湖泊水中AgNPs 对水蚤的毒性效应,发现颗粒物C:N 和C:P 比率、总溶解有机碳(dissolved organic carbon,DOC)、总溶解磷(total dissolved phosphate,TDP),都会影响AgNPs 的浓度,从而对水蚤产生毒性影响,C:N 是影响水蚤存活率的最大因素[43].在土壤暴露中,通过活性污泥的加入,可以使部分AgNPs 转变成AgS,而AgS 具有高的化学稳定性,从而降低了AgNPs 的毒性;并且由于活性污泥中含有丰富的食物,导致蚯蚓的体重增加了34%—176%[90].
3.4 暴露途径
AgNPs 不同的暴露途径对无脊椎动物的毒性也不同.Wang 研究了水体暴露和饮食暴露两种途径下AgNPs 对大型溞生长、繁殖、生物累积等指标的影响.发现在生长和繁殖实验中,水体暴露下的AgNPs 会刺激大型溞的繁殖和蜕皮,在高浓度下会显著抑制大型溞的繁殖和蜕皮,而饮食暴露下的AgNPs 在所有浓度下都会显著抑制大型溞的繁殖和生长;在生物累积实验中,水体暴露下AgNPs 在最低浓度时,在大型溞体内累积量达到最高,之后随AgNPs 暴露浓度增加而累积量减少;饮食暴露下,大型溞体内Ag+量随着AgNPs 暴露浓度增加而增加[28].同样,Qing 研究了土壤相暴露和食物相暴露下AgNPs 对蜗牛毒性的影响,发现食物相中AgNPs 的毒性大于土壤相中AgNPs 的毒性;在相同AgNPs 浓度下,食物相导致蜗牛消化腺中脂质过氧化物(lipid hydroperoxide,LPO)含量,CAT 和SOD 活性极显著增加,分别是土壤相的1.5、1.7、2.5 倍[17].
4 总结与展望(Conclusions and prospects)
由于AgNPs 材料的优良特性,使其被广泛应用到农、工、医等各种领域,而AgNPs 的毒性问题,一直是人们关心的重点.到目前为止,国内外已有很多关于AgNPs 毒性的文献,相关实验结果并不一致甚至自相矛盾.本文结合文献中的相关研究结果,总结了AgNPs 对无脊椎动物的毒性效应及其影响因素.AgNPs 可以在环境和生物链中迁移转化,最终累积到无脊椎动物体内,对无脊椎动物造成毒性损害,影响无脊椎动物的生长发育、破坏无脊椎动物的组织结构以及损害其系统功能.AgNPs 引起细胞氧化应激,会造成无脊椎动物DNA 损伤、线粒体损坏、染色体畸变以及细胞凋亡.此外,AgNPs 的理化性质、表面涂层、环境、暴露途径等因素,都会影响AgNPs 对无脊椎动物的毒性大小.最后基于目前的研究提出一些展望,为AgNPs 对无脊椎动物毒性的研究提供新的思路.
(1)AgNPs 与AgNPs 溶解Ag+之间的毒性没有研究清楚,是AgNPs 溶解Ag+所引起的毒性,还是AgNPs 与Ag+共同引起的毒性,这方面在无脊椎动物毒性机制中需要更深层的研究.
(2)生物制备AgNPs 具有反应条件温和,绿色环保,成本低等优点,已经成为近些年研究的热点.随着生物合成法技术的成熟与完善,环境中生物AgNPs日益增多.无脊椎动物是生物类群和生态系统的重要组成部分,后续应加强生物AgNPs 对无脊椎动物的毒性效应研究.
(3)随着AgNPs 被释放到环境中,会与环境中其他污染物相互作用.可能会影响AgNPs 在环境中的理化性质和生物学活性.因此有必要加强AgNPs 与其他污染物的联合效应及其共存特性研究.
(4)尽管目前关于AgNPs 对无脊椎动物毒性的研究在逐渐增多,但大多数研究只考虑了对无脊椎动物的急性毒性试验.因此,需要更多的研究来确定无脊椎动物体内低浓度AgNPs 颗粒的长期影响,隔代影响,以便进行适当的安全评估和识别生物标志物.
(5)目前AgNPs 的试验生物以水生无脊椎动物为主,如:水蚤、大型溞、贻贝等,后续应加深对陆生无脊椎动物的影响研究,为AgNPs 在土壤中的评价提供依据.
(6)需要建立评价AgNPs 对无脊椎动物单一和复合污染毒性的标准方法,以完善AgNPs 的生态毒性安全评价系统,进而便于政府规范AgNPs 的生产和使用.

