斑马鱼在化学品高通量毒性评价中的应用*
王 俊 刘 力 徐颖君 刘俊杰 程 波 张 蒙 庞少臣** 梁 勇 宋茂勇,3
(1.武汉工程大学环境生态与生物工程学院,武汉,430205;2.江汉大学持久性有毒污染物环境与健康危害湖北省重点实验室,环境与健康学院,武汉,430056;3.中国科学院生态环境研究中心环境纳米技术与健康效应重点实验室,北京,100085)
1 化学品风险评估的新需求(Current requirements of chemicals risk assessment)
截至2022年美国化学文摘社(Chemical Abstracts Service,CAS)登记的现有化学品已达1.95 亿种,且每日有数千种新开发的化学品登记入册.全球化学品管理计划,如《经济合作与发展组织高产量化学品》(OECD High Production Volume Chemicals)、《美国国家环境保护局高产量化学品挑战》(United States Environmental Protection Agency High Production Volume Challenge)和欧盟《关于化学品注册、评估、授权和限制的规定》(Registration,Evaluation,Authorization and Restriction of Chemicals,REACH)等,都推出了“无数据,无市场”的指令,强制要求只有已知生态毒理学特性的化学品才会被授权商业化和引入市场[1−2].化学品毒性安全评估一般通过哺乳动物毒性测试来实现,一种新药的开发也需要大量哺乳动物开展安全性评估.然而,随着全球化学品的不断增加和测试要求的不断提高,传统的毒性分析方法不仅存在成本高昂、效率低以及低剂量效应难以识别等问题,还面临无法提供化学品发挥毒性的机理信息,在跨剂量、物种和生命阶段的数据外推中存在不确定性等困境[3−4].并且,传统的基于哺乳动物的毒性评价方式不符合“减少,替代,优化”的“3R”(Replacement,Reduction,Refinement)原则.因此,美国国家研究委员会提出了21 世纪毒性测试的新框架,呼吁利用现代计算化学、分子与细胞生物学工具加速发展以高通量体外测试和非哺乳类动物模型替代方法为主的毒性评价新模式[5].模式生物斑马鱼作为优秀的脊椎动物模型,已经成为化学品毒性评价的强大工具[6−7].
2 斑马鱼是高通量的药物筛选和化学品毒性测试中重要的动物模型(Zebrafish is an important animal model in high-throughput drugs screening and chemicals toxicity testing)
斑马鱼(Daniorerio)是分布于南亚地区溪流中的一种身体略呈纺锤形,头小而稍尖,全身布满深蓝类似斑马纵纹的热带鱼类.斑马鱼的胚胎在体外快速发育,通体透明,易于观察形态发生和器官形成的过程,是研究脊椎动物胚胎发育的理想模型.斑马鱼的大规模遗传筛选研究获得了大量基因突变体,并确定了这些突变基因在胚胎发育中的功能,揭开了斑马鱼可以用于基因、基因组学和脊椎动物发育过程研究的序幕[8−10].斑马鱼和人类基因组有70%同源性,80%的人类疾病相关基因与斑马鱼具有同源性[11−12].斑马鱼与人类的生理组织结构、细胞信号、分子功能和调控过程具有进化上的保守相似性[13].斑马鱼已经成为人类疾病的强大临床前模型,被用于各种癌症、肾脏疾病、心血管疾病、血液疾病以及神经系统疾病等疾病及治疗药物的研究[14].
斑马鱼作为药物活性高通量筛选的脊椎动物模型,在人类临床候选药物发现中发挥重要作用[15].2000年,人们证明通过直接在培养液中加入少量化合物,就可以在96 孔板中使用斑马鱼进行药物筛选[16].斑马鱼胚胎体型微小,胚胎能在24、48、96 甚至384 孔板中培养,使得高通量地开展实验和检测成为可能.斑马鱼饲养条件简单,其对水质要求不苛刻,成本低廉,大大降低高通量筛查的成本.根据欧盟动物保护法,受精5 d 以内的斑马鱼胚胎或幼鱼不属于动物保护范畴,可以替代哺乳动物测试,这使得斑马鱼胚胎的使用符合3R 原则.斑马鱼胚胎及幼鱼透明或半透明的特性为光学成像提供便利,允许通过高通量成像技术对细胞、组织和器官等评价终点进行无创测量,以获取大量生物表型数据.另外,斑马鱼遗传操作方便,已经建立了许多细胞或组织特异性标记和信号转导报告的遗传品系[17],这些品系不仅可用于表型数据的成像记录,还可用于活体水平的机制研究.目前,研究人员广泛使用斑马鱼开展药物的高通量筛选,已经发现数百个小分子药物在鱼类和人类中具有保守的生物活性,其中部分药物还进入了临床转化研究[18].
斑马鱼在药物活性发现中的出色表现,为其在化学品毒性高通量筛查方面应用奠定了基础.斑马鱼作为毒性评价的动物模型,早期更多应用于环境污染物的毒性评价.斑马鱼是经济合作与发展组织推荐的化学品危害及环境风险评估的常规测试鱼种,被广泛应用于急性毒性、内分泌干扰、发育毒性、生殖毒性和遗传毒性的测试和评价.在美国环保署开展的ToxCast 化学品毒性测试项目中,斑马鱼和多种体外细胞模型被用于化学品的高通量毒性测试[3].该项目根据所获得的化学品生物活性和体外特征建立动物体内毒性效应和表型的预测方法,为识别更多潜在有毒化学品奠定基础.ToxCast Ⅰ和Ⅱ项目利用的斑马鱼毒性评价终点包括死亡率、孵化率和畸形率,这些毒性数据能够为化学品毒性评估的优先排序提供帮助[19].斑马鱼的发育毒性测试正在成为登记化学品致畸性评估的替代方法被应用于药物安全性评价[20].在药物研发前期尽早地识别有毒的候选药物能够极大降低后续研发中断导致的经济损失,这使得利用高通量技术分析候选药物对特定器官毒性的研究兴趣不断增加.近年来,利用斑马鱼模型开展神经系统、心血管系统、肝脏和耳听力等方面高通量毒性评价的研究取得许多新进展[21].
斑马鱼作为一个整体动物其分析通量低于培养细胞.但是,斑马鱼比细胞具有更高的生物学相关性和生理复杂度,可以提供单细胞无法提供的多细胞生物的动态、互动和多器官事件(图1),可以绕过体外数据向体内转化的障碍.虽然斑马鱼与人类的相关性低于小鼠,但是利用斑马鱼模型可实现高通量的生物分析,获取大量的数据(图1)[22].斑马鱼既有生物相关性和复杂度又具有一定的分析通量,是细胞与哺乳类动物模型之间的桥梁[21].因此,斑马鱼是21 世纪毒性测试中重要的非哺乳类动物替代模型.
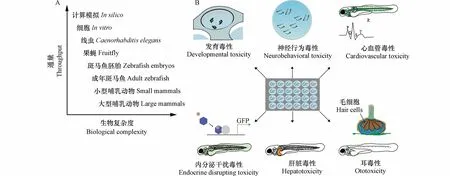
图1 斑马鱼在化学品高通量毒性评价中的应用(A)由于斑马鱼既有生物复杂度又具一定的分析通量,它在高通量的药物筛选和化学品毒性测试中具有独特的位置;(B)斑马鱼在化学品高通量毒性评价中的主要应用方向,包括发育毒性、神经行为毒性、心血管毒性、内分泌干扰毒性、肝脏毒性和耳毒性等方面的评价.Fig.1 High-throughput toxicity testing of chemicals in zebrafish(A)Zebrafish has a unique position in high-throughput drugs screening and chemicals toxicity testing due to its relative biological complexity and analytical throughput.(B)The main application directions of zebrafish in high-throughput toxicity testing includes assessment of developmental toxicity,neurobehavior behavior toxicity,cardiovascular toxicity,endocrine disrupting toxicity,hepatotoxicity and ototoxicity
3 斑马鱼高通量毒性评价研究进展(Advances in high-throughput toxicity assessment by zebrafish)
斑马鱼幼鱼体长为3—5 mm,可以在多孔板中培养和暴露,发育的前5 d 通过自身的卵黄获取营养,这些特性为高通量实验和分析提供了便利.斑马鱼受精后发育至24 hpf(hours post fertilization)所有器官原基基本形成;发育至48—72 hpf,除了消化系统外的大部分器官发育完全;发育至76 hpf,肝脏、胰腺和肠道发育完全;发育至96 hpf,胃肠道发育完全;发育至5 dpf(days post fertilization),所有器官基本发育完全[21].斑马鱼作为一种完整脊椎动物的模型,被广泛应用于药物和环境污染物的急性毒性、胚胎发育毒性和神经行为毒性的高通量筛查.近年来一些特定器官的毒性评价如心血管发育、肝毒性、耳毒性和肾脏发育毒性等评估模型持续发展.以下本文将总结斑马鱼高通量毒性测试在药物毒性预测和化学品毒性风险评估中应用的研究进展.
3.1 发育毒性
发育毒性和致畸性测试是化学品安全性评估的重要部分,这类测试通常是在哺乳动物中评估化学品对母体和胎儿的毒性.由于成本低、操作简单和效率高的优势,斑马鱼胚胎越来越多地被用于化学品的致畸性安全评价.许多研究机构和药物公司利用斑马鱼胚胎开发了致畸性的分析方法和定量预测模型[23−29].这些方法一般在4—6 hpf 开始暴露胚胎并持续至120 hpf,毒性评价的终点包括死亡率、孵化率和畸形情况,其中畸形的评价指标包括脊柱、脑部、眼睛、耳、下颚、心脏、体节、脊索、鱼鳍、鱼鳔等器官的解剖学结构和形态,以及活动能力、心脏和血液的循环功能、色素形成、水中的姿态等,最后根据浓度-效应曲线、畸形指数或半最大活性浓度判定阳性.这些方法与哺乳动物发育毒性研究结果有很好的一致性,一些实验室的一致性能够达到87%[24],最低的也能达到62%[25].由于许多化学品在不同物种中引起的毒性结局不同,因此不同动物模型的毒性评价结论普遍存在差异.例如,ToxCast 项目中214 种化学品的发育毒性测试结论在斑马鱼与小鼠(52%)、小鼠与家兔(58%)、家兔和斑马鱼(47%)中的一致性约为50%[30].小鼠(55%)、大鼠(61%)和家兔(58%)单独对120 种致畸性药物的阳性识别率约为60%,大鼠和家兔组合以后的识别率可达到100%[31].另外,啮齿动物和非啮齿哺乳动物模型分别单独预测上百种已知具有人体毒性的药物的识别率仅为71%[32].因此,斑马鱼胚胎是非常有价值的发育毒性预测模型,正被探讨可作为哺乳动物胚胎发育毒性测试的替代方法用于特殊情况下的风险监管[21].另外,不同实验室之间数据的差异反映出不同实验设计、检测终点、畸形指数计算方法和阳性阈值划定标准对毒性评估结论的影响.例如,有些实验室认为去除绒毛膜暴露增加了毒性反应的敏感性[33],但另一些研究人员认为去除绒毛膜增加了复杂性和不确定性.因此,未来迫切需要科学团体协作建立一个被广泛接受的测试标准.目前,已经有研究人员对暴露胚胎形态学改变的统一描述术语提供了建议[34].多个实验室联合梳理出一些导致斑马鱼发育毒性测试产生性能差异的影响因素,以寻求当前最佳的测试实施方案[35−36].
3.2 神经行为毒性
神经毒性测试评估化学品对神经系统的病理学和神经行为改变,是对化学品基本毒性数据的补充.神经行为不仅能够反映神经系统在分子、细胞和器官层面的结构完整性,而且能够综合指示神经系统的功能,因而是神经毒性评价的重要组成部分[37].斑马鱼具有丰富且稳定的可测量的行为模式,包括运动、探索、焦虑、惊吓、认知和社交等[38−39].目前,斑马鱼中已开发出一系列评估化学品对感觉、运动和认知功能影响的行为学测试方法[40−41],并且研究发现精神类药物、尼古丁、毒死蜱、二嗪农、苯并芘、酒精和重金属等对斑马鱼行为学改变与其在哺乳类动物中作用相似[42−43].商业化和自主研发的行为学高通量分析系统被广泛运用于环境化学品神经毒性的评估[44−51].这些系统通过视频追踪记录和软件分析幼鱼(< 7 dpf)运动的速度、距离和转弯角度等信息,实现幼鱼睡眠与觉醒[52]、光运动反应[53]、视听刺激运动[54]、明暗变化运动反应[55]等神经行为的高通量分析.三家实验室分别利用斑马鱼神经行为毒性高通量测试方法对Tox21 Phase Ⅲ项目确定的91 种参考化学品进行分析,对神经毒物的识别率分别为49%[46]、62.5%[48]和96%[46].不同实验室之间数据的差异,一方面是由于测试方法设计的差别,例如,胚胎暴露之前的脱膜处理可能会增加胚胎对毒物反应的敏感性,从而增加了阳性率[47].另外一方面则是由于不同实验室判定神经毒物标准的严格程度不同[46,48],神经行为异常可能是由于骨骼系统或者肌肉系统异常导致,在无明显发育毒性浓度下考察神经行为变化情况的判定方法更加科学合理[48].利用斑马鱼大规模开展化学品的神经行为毒性测试的研究相比于发育毒性研究要少很多,未来需要更多高质量的数据证明斑马鱼神经行为测试方法对人类神经毒物的预测能力.
3.3 心血管毒性
目前,评价药物和环境污染物心脏毒性的体内和体外方法相对有限,主要评价终点包括心脏的结构、电生理和收缩性等[56].电生理变化是当前主要的心脏毒性评价方法,但由于人类和啮齿类动物心肌细胞中离子通道表达的差异,导致两者的心脏电生理存在明显不同[56].相比于啮齿类动物,斑马鱼心脏电生理特征与人类更加相似[57],因而是化学品心脏毒性评价的重要替代方法.研究人员已经在斑马鱼成鱼和幼鱼中开发出多种心电图测定的方法[58−60].另外,许多针对幼鱼的成像及分析方法可以测定心率、心电图QT 间隔、射血分数、房室传导、心房和心室的搏动节律及血液动力学特征[61−64],为高通量的心血管毒性评价提供了有力工具.利用心率和搏动节律两个评价终点对23 个已知可导致人类心电图QT 间隔延长的药物进行测试,发现斑马鱼识别心脏毒物的特异性为76%,敏感性为80%;针对水溶性差的药物改用显微注射的暴露方式可以将预测的敏感性增加至96%[65].针对96 种有心脏毒性报道的药物,研究人员比较分析人类诱导多能干细胞分化的心肌细胞和斑马鱼幼鱼两种模型的预测能力,发现斑马鱼模型具有更好的心脏毒性预测能力[66].利用针对幼鱼的心脏输出量、心率和血流3 个心血管参数的高通量分析方法,研究人员发现32 个心血管药物中17 个药物产生明显心血管毒性,并且在3 个药物中观察到的最低效应浓度接近环境剂量[67].另外,心血管系统是脊椎动物胚胎中第一个发挥功能的器官系统,反映出心血管系统在发育和怀孕期间的关键作用.斑马鱼胚胎发育过程中血管新生的动态特征被用于识别阻燃剂对胚胎血管损坏的早期事件[68−69].这显示出斑马鱼在环境污染物心血管毒性风险评估中的应用前景.
3.4 内分泌干扰
斑马鱼的内分泌系统在发育前5 d 基本发育完全[70].例如,垂体激素基因从48 hpf 开始表达[71],催化雄激素合成的芳香化酶和雌激素受体等基因在24 hpf 就能检测到[72−73],甲状腺从3 dpf 开始产生甲状腺激素[74].在斑马鱼中已开发出许多内分泌信号传导的转基因报告品系,包括雌激素信号Tg(ERE:GFP)[75]和Tg(ERE:Gal4ff;UAS:GFP)[76−77],甲状腺激素信号Tg(tshβ:EGFP)[78],以及糖皮质激素信号Tg(GCRE-HSV:U123:EGFP)[79].利用这些转基因品系的幼鱼可以开展具有内分泌干扰作用化学品的高通量毒性测试.例如,利用转基因Tg(ERE:Gal4ff;UAS:GFP)的半透明Casper斑马鱼和高内涵成像系统,研究人员开发了雌激素干扰物检测的半自动定量方法[80].Casper斑马鱼中的两个色素基因(roy和nacre)突变,使得在Tg(ERE:Gal4ff;UAS:GFP)-Casper中能够检测到更强的报告基因信号.通过共聚焦成像可以检测到EE2 在环境浓度(ng·L−1)下的雌激素激动作用,展示出该方法在未来活体高通量内分泌干扰评价中的应用前景.但是,高内涵系统成像的分辨率要低于共聚焦,成像精度会影响检测的灵敏度.例如,该研究中高内涵只检测到1000 μg·L−1的BPA 暴露胚胎中的信号,而共聚焦成像在62.5 μg·L−1的BPA 暴露胚胎就能检测到信号.因此,增加高通量检测的成像分辨率是未来重要的研究方向.
3.5 肝脏毒性
目前,准确预测药物的肝脏毒性是药物开发中的一个挑战.不同物种肝脏中生物转化和代谢途径的差异使得肝脏相比于其它器官中毒性预测的准确率要低[81].近年来利用斑马鱼模型开展药物肝脏毒性高通量筛查的研究兴趣不断增加[81−82].相比于哺乳动物,斑马鱼肝脏包含除免疫细胞(Kuffer 细胞)以外的所有细胞类型,这些肝脏细胞执行胆汁分泌、糖原储存、外源物代谢与解毒、脂类生成,以及分泌血清蛋白等功能[83].人类肝脏中负责外源物质Ⅰ相和Ⅱ相的代谢酶在斑马鱼都能找到同源基因[84].尽管许多药物和环境污染物在斑马鱼和人类中的代谢过程不完全相同,但大部分保持相似的代谢路径[84].通过转基因导入人源的细胞色素P450 酶基因可以提高斑马鱼肝代谢毒性的预测能力[85].斑马鱼幼鱼的肝脏毒性评价终点包括肝脏大小、肝脏组织凋亡、卵黄脂类消耗和滞留情况[64].两家药物公司比较了体外培养肝细胞高内涵分析方法与斑马鱼体内基于肝脏表型的分析方法对50 种已知肝毒性药物的预测能力,发现斑马鱼与哺乳动物预测结果一致率为84%,敏感度为86%,特异性为77%,表明斑马鱼与哺乳类动物模型的肝脏毒性预测有良好相关性[82].并且,将斑马鱼模型与2D 或3D 培养肝细胞的体外模型结合有望提高毒性预测的准确性[82].目前已有一些利用斑马鱼幼鱼研究环境污染物对水生鱼类肝毒性的研究[36,86−87],但以斑马鱼幼鱼肝毒性模型开展大规模化学品风险分类的研究相对较少.未来需要更多的研究来评估斑马鱼幼鱼与人类外源物代谢的相关程度,以及针对幼鱼开发更多的肝毒性评价终点.
3.6 耳毒性
斑马鱼的身体外侧有一个由毛细胞组成的称为侧线的感觉系统,它能够感应水流对身体不同部位的微小变化.侧线毛细胞的生理行为跟哺乳类内耳的毛细胞很相似.与哺乳类动物的毛细胞被耳朵包裹在内部的复杂解剖学结构不同,斑马鱼侧线毛细胞位于身体表面,容易通过成像进行观察和定量,这使得斑马鱼的侧线被开发成筛查具有损伤听力耳毒性药物的高通量模型[88].侧线毛细胞模型已经被用于评价水环境污染物如双酚A、铜离子、微塑料、纳米银等对水生生物感觉系统的不利影响[89−95],目前该模型还没有被应用于大规模化学品毒性筛查.
4 斑马鱼高通量分析技术的研究进展(Advances in high-throughput technology for assay in zebrafish)
体外培养细胞的高通量自动化分析技术已经非常成熟,但目前斑马鱼的高通量分析还未能达到体外高通量分析的吞吐力,操作、放置和分析斑马鱼胚胎仍然是劳动密集型的工作.下文将总结近年来高通量的药物筛选和化学品毒性评价中鱼卵收集、分类和转移、培养和暴露、成像及分析4 个步骤中的技术革新情况,以展示斑马鱼高通量毒性测试涉及的实验室任务自动化的前景.
4.1 斑马鱼胚胎收集的高效化
斑马鱼怀卵量大、繁殖力强,使得斑马鱼胚胎或幼鱼特别适合高通量的生物分析.随着实验数量和规模的增加,时间、空间和工作量都会不同程度的增加,实验室收集鱼卵的传统方法不再能满足大规模和高通量实验的需求.长期从事斑马鱼化学筛选的Leonard Zon 实验室开发了一种能够快速收集大量处于相近发育阶段斑马鱼胚胎的新系统[96].这种方法利用鱼类在浅水中产卵的自然趋势,允许多达350 条的斑马鱼同时进行繁殖,同一条鱼被安排在多个时间间隔内产卵以收集到发育阶段相近的胚胎.整个系统由3 个主要部分组成:外室、产卵平台和分离器.系统运行时会充满水,将雌鱼和雄鱼分别放置在产卵平台内并且位于分离器下方和上方.分离器被移除,雄鱼和雌鱼在深水中一起游动,产卵平台升起后雄鱼和雌鱼在浅水中交配产卵.受精卵会从产卵平台的底部掉下来,将鱼从繁殖容器中取出后可收集容器底部的受精卵.这种方法极大地利用了斑马鱼的繁殖力,能够在10 min 内获得最高可达1 万颗发育时期相近的胚胎,是对传统方法的一次巨大的改进.
4.2 斑马鱼胚胎分类和转移自动化
化学筛选需要将单个斑马鱼胚胎转移到标准的多孔板中,斑马鱼胚胎的手工转移是一项繁琐费力的工作.COPAS(Complex Object Parametric Analyzer And Sorter)系统是能够分选20—1500 μm 生物颗粒的商业化流式分选和检测系统.该系统可根据胚胎的光学长度、光密度和荧光信号等分选参数对不同生存情况或荧光信号的斑马鱼胚胎进行分选.类似于流式细胞仪,COPAS 通过鞘流精确地将胚胎分配到多孔板或培养容器中,速度最高可达1 个胚胎/秒,分选纯度达98%,并且对斑马鱼胚胎的生存能力没有明显的影响.COPAS 的分析和分选功能已被应用于肺结核病的新型抗生素和胰岛素治疗药物的斑马鱼高通量自动筛选研究中[97−98].但是,COPAS 的价格接近流式细胞分选仪,高昂的价格限制了该系统的广泛应用.实验室研究人员开发了另一种成本相对较低的可将单颗斑马鱼胚胎批量转移到96 孔板的自动化系统[99].该系统包括一个放置96 孔板的平台和与之相匹配的用于捕获和固定胚胎的定制24 孔板.该装置通过抽掉装置底部空气形成的低真空环境达到固定和排列单颗斑马鱼胚胎的效果.随后,翻转该装置并通过相机的帮助与平台上96 孔板的1/4 相对齐,完成胚胎的转移.该系统完成一个96 孔板的胚胎转移大约需要360 s,成功率可达94.3%.此外,研究人员还设计了微机械大颗粒流式分拣机(micromechanical large particle in flow sorter,MILPIS),该系统利用受精卵和非受精卵光学透明度的不同,在微流控芯片中嵌入红外发射和接收器,通过检测区分透明度来分选两类胚胎[100].
4.3 斑马鱼胚胎培养和暴露自动化
斑马鱼胚胎暴露一般在静态或半静态的多孔板中进行,一些可编程的自动移液工作站已经广泛应用于胚胎的暴露和换液操作[101].近年来,微流控芯片技术为胚胎的培养及暴露提供了许多自动化运行的解决策略[102−103].与传统多孔板相比,微流控芯片技术的独特优势是可实现多个操作的自动化.例如,Donald Wlodkowic 实验室设计的微流控芯片可快速装入和固定鱼卵,并且实现了胚胎暴露微环境的自动灌注,避免了传统的耗时耗力的液体处理任务[104−105].该微流控芯片设计了可容纳12×21 个胚胎的腔室阵列,利用胚胎自身重力和底部的低压吸力捕获和固定斑马鱼胚胎[105].微流体芯片通过定制接口与液体蠕动泵相连,使得胚胎长期固定在流动的暴露液中[105].该微流控芯片的培养环境与普通静态培养条件下测定的硫酸铜等化学品对胚胎的死亡率和致畸率有良好的相关性,但该系统只能捕获及固定有绒毛膜保护的圆形斑马鱼胚胎,只适用于受精后48 h 之内的测试[105].另外,微流控芯片可实现自动化功能的集成,如梯度发生器[106−109]和温度控制[110]等功能.研究人员将微流控培养腔室阵列与浓度梯度发生器相结合,设计出一种可为7 个胚胎培养腔室独立输送并连续给药的芯片装置[109].胚胎被手动转移到培养室中,每个培养室可容纳几个胚胎,将芯片倾斜20°放置可以清除废物和排出废液.这种微灌流暴露方式可以克服化学品挥发和被吸附导致的暴露浓度下降的问题.除了水溶液的给药方式,自动显微注射技术可以为易挥发和难溶化学品提供更直接高效的递送[111].
4.4 斑马鱼成像及数据分析自动化
通过自动化成像及分析技术高效地获取发育毒性、行为学改变、特定组织器官变化和心率等生理指标变化的数据是整个斑马鱼高通量筛查中最重要的环节.针对不同检测终点的高通量成像策略各不相同.利用简单的成像设备如数码相机和细胞成像仪等可以快速进行发育毒性分析.Donald Wlodkowic 实验室设计的微流控芯片采用透明的聚甲基丙烯酸甲酯树脂制造,为固定胚胎的成像提供了便利[105,112].芯片外形大小特地设计成96 孔板的尺寸,方便利用高分辨相机或细胞成像仪采集图像.这种微流控芯片技术图像采集方便,同时集成了自动化捕获、固定、暴露胚胎等功能,为发育毒性和致畸性评价提供了一个廉价的高通量、自动化的解决策略.
虽然成年斑马鱼具有更丰富的行为学特征和检测方法[41],但是成鱼的分析通量要低于幼鱼.针对幼鱼行为的高通量检测方法主要是测定及量化幼鱼自发或刺激诱发运动行为中的各类特征,包括位置偏好、位移、速度、运动启动频率、休息期时长、躯干弯曲程度和方向变化等[113−115].斑马鱼幼鱼的行为学实验一般在灯箱或光板上的培养皿或多孔板中进行,照相机从顶上方拍摄,图像采集软件可同时自动追踪及拍摄多条幼鱼的运动视频.无论采用高帧率或低帧率的相机都可开发出匹配算法和软件[55,116],量化幼鱼运动中各种可测量的特征,以确定药物或化学品诱导的行为学表型.商业化的分析软件如Zebralab(Viewpoint Life Sciences)和Ethovision(Noldus Information Technology)提供一些量化行为学特征的标准分析流程,并且在实验视频记录同时进行实时分析,大大提高分析速度;一些开源的软件包则提供可靠和灵活数据处理方法.
胚胎或幼鱼中特定细胞或组织器官的清晰且高通量的成像需要更加复杂光学成像设备和辅助硬件的支撑.这类成像面临的首要挑战是如何使胚胎或幼鱼固定并将其旋转至能清晰检测到感兴趣细胞和组织的成像面.脊椎动物自动筛查技术Vertebrate Automated Screening Technology(VAST)系统是目前针对斑马鱼胚胎及幼鱼最成熟的自动化成像系统.该系统通过微流控液流将胚胎或幼鱼从多孔板送入一个超薄硅硼酸盐玻璃毛细管中,通过步进马达精确控制毛细管绕中心轴旋转(360 度),使斑马鱼胚胎可以根据用户定义自动定向[117].毛细玻璃管组件安装在一个三轴定位台上,可支持宽场和共聚焦荧光显微镜成像,成像速度可达每条鱼20 s,可在35 min 内扫描完成一个96 孔板.经优化后,整个系统的操作流程可自动地多线程运行,检测速度大大提高[118].该系统已被Union Biometrica 公司以VAST BioImager 商标商业化[119].研究人员将VAST 与定制的转盘共聚焦结合,实现了少突胶质细胞髓鞘的高分辨自动成像[120].最近,一种利用声波来操纵液体和液体中颗粒的声学流体技术被应用于斑马鱼的非接触式固定[121].研究人员研制出的声流体旋转镊子通过声波激发的偏振单流涡旋对流体通道内的幼鱼旋转,采集幼鱼旋转过程中的二维图像序列,最后利用基于计算机视觉的算法将二维图像重建成三维模型.这种精细的声学流体控制技术可降低旋转不均匀导致的三维模型失真.这种声流体旋转镊子可灵活地与多种光学显微镜兼容.这些装载、固定和卸载胚胎及幼鱼的样品制备自动化技术极大地推动了光片显微成像[122−123]和光学投影断层扫描[124−125]等高速三维成像技术在斑马鱼表型评估中应用.
随着高通量自动显微成像技术的进步,利用有效的计算机策略对大规模图像数据进行分析的需求增加.基于体外细胞图像的高内涵分析方法在化学筛选中已经非常成熟[126],这些针对细胞的图像解决策略在基于图像的斑马鱼表型分析中具有巨大的应用潜力.目前,已有许多针对斑马鱼特定分析需求的自动化图像分析方法[127−128].例如,可用于发育毒性和致畸性评价中胚胎形态识别和分类的图像处理方法.其中,FishInspector 能够自动识别图像中幼鱼的轮廓、眼睛、下颚尖、卵黄囊、鱼鳔、耳石、脊索和色素等;根据幼鱼3D 重建模型,研究人员计算幼鱼的表面向量与X轴之间角度,通过角度分布的直方图精细地量化幼鱼身体的形态特征,包括水肿和体轴弯曲程度等[121].斑马鱼中图像自动处理的应用还包括荧光标记细胞数目的定量[98,120,129],组织和器官大小测量[121,130−131],行为特征的无监督聚类分析[52−53]和基因表达的三维解剖学结构注释[124,132]等.相比于过去遗传和药物筛选中依靠人工视觉的表型判断,计算机技术提供的自动和无偏向分析方法不仅提供可靠的定量数据,而且使得分析流程具有可追塑性和可重复性.随着高通量成像技术的不断发展,斑马鱼中高通量图像分析未来面临的挑战是如何根据各类成像技术的特点创建汇聚各项分析功能的精简平台,以便科研人员容易掌握及广泛使用.
5 总结与展望(Conclusion and prospect)
斑马鱼已成为强有力推动人类临床前研究的脊椎动物模型,在高通量的药物筛选和化学品毒性评价中发挥重要作用.本文系统地总结了当前斑马鱼高通量毒性测试及高通量分析技术的研究进展和所面临的问题挑战.为进一步促进斑马鱼高通量分析技术在化学品毒性预测和生态风险评估中应用,助力新污染物治理中化学物质风险评估技术标准体系的建设,未来在以下几个方面有待开展更多的研究:(1)需要有效整合高通量分析流程中各个功能模块,建立经济、集约化的斑马鱼高通量分析平台;(2)需要一个斑马鱼高通量毒性测试的实施指南,为可靠的毒性预测提供统一的实施建议;(3)需要建立大量化学品的斑马鱼高通量毒性评价的数据库,方便系统比较不同研究平台的测试结论,以优化测试指标和方法,并提供斑马鱼毒性预测能力的大数据支持;(4)需要将斑马鱼体内模型与其它高通量分析模型如3D 培养细胞或类胚体等组合,努力提高毒性预测的准确性.

