力学增强且降解延缓的编织型丝素纤维人工韧带材料研究
万 玥,刘 影,王 玥,姜博宸,刘明洁,王 璐,关国平
(东华大学 a.纺织学院,b.纺织面料技术教育部重点实验室, 上海)
人体前交叉韧带(anterior cruciate ligament, ACL)是维持膝关节稳定的主要韧带[1]。ACL损伤是常见的运动损伤,尤其在剧烈运动中易发生挫伤、撕裂或断裂。ACL损伤后若不及时处理易引发骨关节炎,严重者会引起半月板撕脱,造成不可逆的损伤[2]。ACL损伤自愈能力较低,临床上常采用韧带移植的方式进行修复[3]。常见的韧带移植包括自体移植物、同种异体移植物以及人工韧带。自体移植物强度较高、不存在免疫排斥反应,是临床治疗的首选。但是,自体移植物来源有限、易导致供区炎症及肌肉萎缩,且移植后出现常见移植物萎缩断裂等并发症[4]。同种异体移植物除了存在着类似的问题,还有隐性疾病传播风险[5]。
人工韧带移植是临床治疗韧带断裂的有效手段[6]。临床上曾使用较多的为LARS®人工韧带,其力学性能优良、生物学惰性。然而,由于不可降解性,LARS®人工韧带植入体内后,常发生应力遮挡、疲劳松弛、滑膜炎等并发症[7-14]。因此,开发可降解人工韧带材料成为新的研究方向[4,15-17]。可降解人工韧带的研究中,材料降解带来的力学衰减周期与组织再生周期不适配以及材料力学的衰减过快是关键的问题。组织再生周期为6~24星期,在该周期内维持人工韧带的力学性能且能以较好的生物相容性促进自体韧带生长是人工韧带的研制目标。丝素纤维来源于天然蚕丝,是一种天然蛋白长丝。它具有优良的力学性能、可加工性和生物相容性[18]。Fan等[19]用丝素纤维编织组织工程支架用于ACL修复,植入体内24星期后得到的再生ACL与天然ACL结构类似,且力学性能稳定。Zhi等[20]比较了涤纶与丝素纤维人工韧带材料在ACL重建方面的效果,结果表明丝素纤维人工韧带材料具有更好的诱导组织生长的效果。吴佳蔚等[21]设计并制备了一种编织基丝素纤维人工韧带材料,对其在磷酸缓冲盐溶液(PBS)和酶溶液条件下的体外降解性能进行了研究,发现在酶降解液中,1星期即出现絮状物,2星期后质量下降明显,这表明该丝素纤维人工韧带的降解速度较快。尽管如此,文献[22-23]研究发现丝素纤维人工韧带材料在动物体内的力学及降解性能仍有待改进。
聚氨酯(polyurethane,PU)是由聚酯或聚醚类聚合物和二异氰酸酯分别作为软段和硬段的聚酯类聚合物。通过引入可降解的聚醚或聚酯低聚物二元醇可制备降解性聚氨酯。可降解聚氨酯具有良好的生物相容性、弹性和易加工性。通过选择不同的软段和硬段,可以调控其降解周期和力学性能[24]。因此,可降解聚氨酯在生物材料方面的研究较广泛,如人工血管、人造皮肤、骨组织工程、手术缝合线等[25]。羟基磷灰石(hydroxyapatite,Hap)是天然骨组织的主要成分,在人体骨组织中为纳米级的针状结晶体[26]。张海松等[27]研究表明,Hap在体外具有调节干细胞分化、促细胞黏附及矿化等作用。
因此,本研究以丝素纤维为原材料编织“壳芯”结构的人工韧带原型材料(artificial ligament, AL),再制备由PU和Hap制成的PU/Hap分散液,对AL的“内芯”和“壳”分别进行涂层,制备了力学性能增强、降解延缓的丝素纤维人工韧带材料(coated artificial ligaments, CAL),以期满足动物试验及临床应用需求。
1 材料与方法
1.1 AL的设计与制备
ACL是由胶原纤维组成,具有前内侧束和后外侧束两个基本功能束,表现为双束结构。从仿生学角度考虑,模仿ACL结构制备人工韧带,采用编织结构模拟胶原纤维的取向排列,这种编织结构通过两条内芯和一层外壳的结构来模拟ACL的双束结构。
本研究采用脱胶柞蚕丝复丝(辽宁采逸野蚕丝制品有限公司)于24锭编织机上进行编织。先将纱线通过全自动绕纱机卷绕在编织机的锭子上,共卷绕24个锭子。随后,依次安装在24锭编织机上,衬入直径1.2 mm的不锈钢棒,编织得到“内芯”。将2根“内芯”并在一起后,再在外面编织1层“壳”。最终得到由2根“内芯”和1层“壳”构成的“壳芯”结构AL。AL结构示意图如图1所示。

图1 AL结构示意图Fig.1 The structure schematic of AL
1.2 CAL的制备
将PU(AR,Sigma-Aldrich,Shanghai)颗粒溶解于DMF(N,N-Dimethylformamide)(AR,Sigma-Aldrich, Shanghai)中,得到质量分数为10%的混合溶液,并将其置于恒温磁力搅拌器上以250 r/min的转速搅拌均匀。将Hap(棒状,粒径为60~80 nm,上海麦克林生化科技有限公司)用少量DMF分散,在超声波机中超声振荡15 min以得到均匀的分散液。用注射器将Hap分散液以0.1 mL/s的速率缓慢滴加于PU溶液中,使得Hap与PU的质量比为3∶20,并用磁力搅拌器以250 r/min的转速搅拌均匀。
在“内芯”内衬入直径为1.2 mm的不锈钢棒,用毛刷将制得的PU/Hap分散液均匀涂覆至“内芯”表面。在电热鼓风干燥箱中烘干,烘干温度为40 ℃,烘干时间为120 min。取出后在电子天平上称重,记录涂层前后的质量。重复以上步骤,共涂覆3次。将涂覆完毕的2根“内芯”作为芯轴,在24锭编织机上编织外壳,再以同样的方式对外壳涂层3次,制得CAL。CAL的制备流程如图2所示。
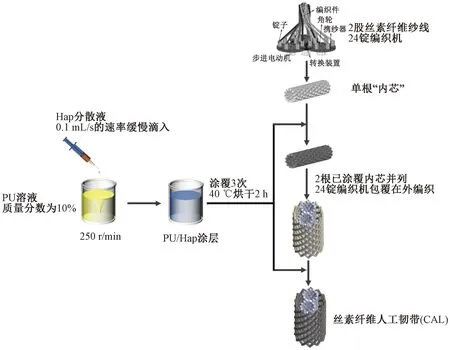
图2 CAL的制备流程Fig.2 The preparation process of CAL
1.3 表面形貌观察
使用体视显微镜观察AL和CAL样品的表面形貌,对于降解过程中的样品表面形貌,采用扫描电子显微镜进行观察和拍照。
1.4 力学性能测试
样品长度为5 cm,在自动多功能力学性能测试仪上测试其拉伸性能,包括拉伸断裂强力和拉伸断裂伸长率。样品断裂强度与弹性模量分别由式(1)和式(2)计算所得。通过弹性回复试验测试样品的抗形变能力及维持膝关节稳定性的能力。抗疲劳性通过1 000次周期性拉伸试验测试,定伸长率为10%。初始隔距为20 mm,拉伸速度为100 mm/min,停留时间为1 s。
(1)
式中:σ为断裂强度,MPa;F为断裂强力,N;S为样品截面积,mm2。
(2)
式中:E为弹性模量,MPa;σ为断裂强度,MPa;ε为应变,%。
1.5 体外降解
降解试验的操作均在超净工作台中完成,所有耗材及器具均灭菌处理,使用前在超净工作台中紫外线照射30 min以上。降解液为PBS(即用型PBS片剂,pH=(7.4±0.2),BBI生命科学有限公司)配制的蛋白酶XIV(Protease type XIV Bacterial From Strepto, P5147-5G,Sigma)溶液,降解温度为37 ℃,摇床转速为60 r/min[26]。体外降解14、28、56和84 d后分别取样,每3 d更换一次降解液。
1.6 细胞相容性
将玻璃片为空白组,试验分为2组,分别为AL组和CAL组,以比较AL和CAL的细胞相容性。将AL样品和CAL样品按照24孔板的孔尺寸裁剪,并在超声波清洗机中用PBS超声清洗30 min,常温干燥后放入24孔板孔中,在酒精缸中酒精熏蒸24 h灭菌。试验前将样品在恒温摇床中37 ℃预热10 min。
将人皮肤成纤维细胞(HFF-1,中科院细胞库)以每孔4×104个的数量种植在每个样品表面,在温度为37 ℃、体积分数为5%的CO2环境下培养。在培养的1、4和7 d进行CCK-8试验(CCK-8试剂盒,500 T,上海翊圣生物科技),并利用式(3)计算细胞增殖率。
(3)
式中:M为细胞增殖率,%;A试验为不同样品在450 nm处的吸光度;A空白为空白孔板在450 nm处的吸光度。
通过荧光染色法观察细胞形态,采用DAPI染色液(50 mL,上海翊圣生物科技)将细胞核染成蓝色,用鬼笔环肽染色液(300 T,上海翊圣生物科技)将细胞骨架染成红色,使用激光共焦显微镜观察并拍照。
1.7 组织相容性
组织相容性通过大鼠皮下包埋试验进行评价,试验分为AL和CAL两组。每组样品的每个时间点均采用3只SD大鼠(14~16周龄,上海雷根生物科技有限公司)(n=3),植入后的第14、28、42 d后取出。通过石蜡包埋切片及HE染色来观察并评价样品的组织相容性、组织长入材料情况及材料的降解情况。
2 结果与讨论
2.1 表面形貌
CAL整体呈浅金黄色,手感柔软,具有一定的硬挺度。条干均匀,结构规整,宏观表面光滑。由图3可知,AL的平均直径为(4.82±0.47)mm(n=10),其表面平整,可见毛羽,编织结构较为疏松,孔结构规则、均匀,保形性良好。

图3 AL的体视显微镜图像Fig.3 Microscope images of AL
为探究不同涂覆层数对AL表面毛羽与孔结构的影响,对AL表面进行不同次数的涂层,其显微外观如图4所示。涂层前的AL表面毛羽及孔结构较为明显(图4(a)),涂层后表面变得光滑、孔结构不明显(图4(b)~4(c))。经过3次涂层后形成的CAL表面紧致、光滑,毛羽服贴,无明显孔结构存在(图4(d))。本研究采用PU/Hap涂层的目的在于通过物理包覆的方式隔绝丝素纤维与组织液的接触,从而延缓及调控材料的降解。随着降解的延缓,其力学性能衰减也将得到延缓。同时,涂层有望提高AL的起始力学性能。由图4可见,完整均匀的涂层使得CAL的力学性能有望得到增强,同时延缓其降解速度。

图4 AL和不同涂层次数的CAL样品体视显微镜图像Fig.4 Stereo microscopic images of CAL samples with AL and different number of coating times
2.2 力学性能
2.2.1 拉伸断裂性能
图5为CAL与AL的拉伸断裂强力测试结果,表1为CAL与AL力学性能对比。由图5和表1可知,涂层对提高AL的力学性能有积极作用。AL的拉伸断裂强力为435.84 N,CAL的拉伸断裂强力为491.38 N,提高了12.70%。AL的拉伸断裂伸长率为(52.00±17.84)%;CAL的拉伸断裂伸长率为(79.60±11.71)%。说明涂层显著强化了AL的力学性能。计算可知CAL的拉伸断裂强度为(62.28±2.54) MPa,高于ACL的拉伸断裂强度(48.24 MPa)[28]。这是由于涂层的存在增加了纤维之间的抱合力,使得断裂强度增大。CAL的弹性模量为128.90 MPa,也高于ACL的弹性模量(111.00 MPa)[29]。说明CAL在小应变时即可提供较大的应力,能够满足移植早期人体活动对人工韧带力学性能的要求。涂层后的模量增加,整体力学性能提高,与天然韧带组织的力学性能较好地吻合[27]。

表1 CAL与AL力学性能对比Table 1 Comparison of mechanical properties of CAL and AL
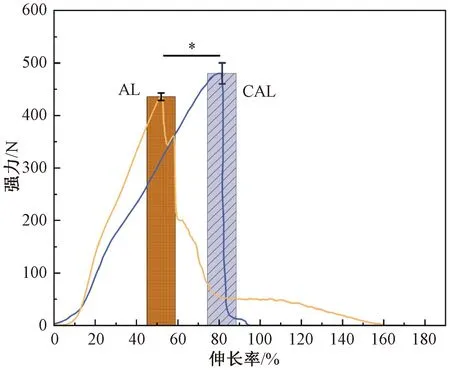
图5 CAL与AL的拉伸断裂强力测试结果Fig.5 Tensile breaking forces results of CAL and AL
2.2.2 弹性回复性能
CAL样品的单次加载-卸载循环典型曲线如图6所示。由图6的测试结果可知,CAL样品的弹性回复率为(76.83±1.77)%。与文献[30]的人工韧带产品相比,表现出了更优异的回弹性。这说明CAL在关节活动过程中能很好的匹配关节的屈伸运动,维持膝关节的稳定性。
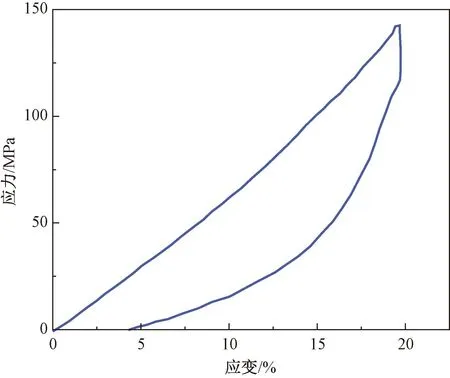
图6 CAL的弹性回复性能测试典型曲线Fig.6 Typical curve of elastic recovery performance test of CAL
2.2.3 耐疲劳性能
人工韧带在植入人体后需要提供较长时间的支撑。Uchio等[31]研究表明,韧带组织完全再生大约需要2 a的时间。其中,人工韧带承担主要力学支撑的时长约为30星期。CAL经历1 000次的加载卸载循环测试后,其断裂强度和弹性回复率如图7所示。CAL的断裂强度下降了2.89%,弹性模量增加了3.52%。对疲劳测试前后的两组数据进行t检验显示CAL测试前后的力学性能无显著性差异(P>0.05)。与文献[32]的数据相比发现,CAL的力学性能衰减较小,耐疲劳性更优,这是由于PU/Hap涂层具有天然优异的耐磨及耐疲劳性能。在与AL复合时,PU/Hap涂层包覆在AL最外面并填充了纱线间的孔隙,既承担了部分拉伸过程中的拉伸力,降低了CAL的力学损耗,又维持了纱线之间的相对位置,减少了纱线之间的摩擦,降低了纱线的磨损,从而使CAL整体的耐疲劳性能得到了提升。
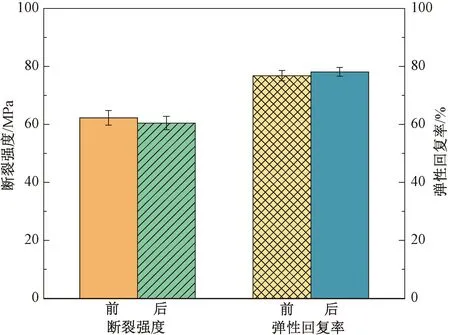
图7 CAL在1 000次加载卸载循环测试后的力学性能对比Fig.7 Comparison of mechanical properties of CAL after 1 000 loading and unloading cycles
2.3 体外降解性能
2.3.1 降解过程中的形貌变化
不同降解时间内CAL表面的扫描电镜照片如图8所示。在降解初期,CAL的涂层表面完整,PU与Hap形成完整的包覆;降解第2 星期,涂层表面部分位置出现了类似蜂窝状的结构。随着降解时间的增加,CAL的涂层表面呈现蜂窝状结构的区域扩大,同时可见针状的Hap再结晶,到第12 星期时,几乎全部涂层表面区域都呈现蜂窝状结构。然而,CAL的芯轴表面直到第12 星期蜂窝状结构也未出现。由此可见,外壳发挥了明显的保护作用,CAL芯轴的降解速率得到了明显延缓,可以推断,CAL的降解过程应该是先外壳、后芯轴的,且外壳降解快、芯轴降解慢。这表明本研究设计的“壳芯”结构能达到延缓人工韧带在体内的降解速度的目的。相应地,CAL的力学性能衰减也将会得到延缓。

图8 在不同降解时间点CAL的外壳与芯轴的扫描电镜图Fig.8 SEM images of the shell and core of CAL at different degradation time
2.3.2 降解过程中的力学衰减
样品降解过程中的拉伸断裂强力变化曲线如图9所示。与AL相比,CAL及芯轴在降解过程中拉伸断裂强力保持平稳,说明涂层可以明显延缓人工韧带的力学衰减。而AL的拉伸断裂强力在最初的1 星期内有明显的下降,在随后的2 星期内保持平稳,最后又出现了急速的下降,降解5 星期后,力学性能呈缓慢下降的趋势。但与芯轴相比,CAL和AL的力学性能始终高于芯轴,证明了“壳芯”结构对人工韧带力学性能的增强。
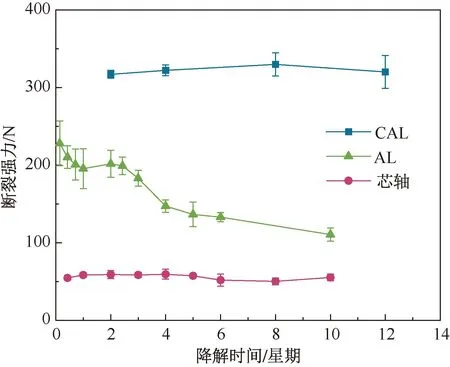
图9 降解不同时间试样的拉伸断裂强力变化曲线Fig.9 Curves of tensile breaking forces of samples after varying degradation time
在降解第12 星期,CAL断裂强度为(48.79±2.64) MPa,与ACL的断裂强度48.24 MPa相近[28],这说明在12 星期的降解后,CAL仍保持优良的力学性能,可为膝关节提供足够的力学支撑。分析结果进一步说明,本研究设计的“壳芯”结构及PU/Hap涂层较好地实现了力学性能增强及延缓降解的目标。
2.3.3 降解过程中的质量损失率
CAL、AL和芯轴降解试验中的质量损失率趋势如图10所示。由图10可知,与AL相比,CAL和芯轴的降解由于涂层的存在而明显延缓,因此两者质量损失率显著低于AL。CAL和芯轴样品从第1 星期开始出现质量损失,在第2和第6 星期之间,质量损失率增加较快,后趋于平稳。该结果与降解过程中的形态变化规律和力学性能衰减趋势相吻合。CAL与芯轴的质量损失率之间无显著性差异(P>0.05)。降解12 星期后,芯轴的质量损失率为9.45%,CAL质量损失率为8.18%,均低于以往研究中相同条件下的CAL的质量损失率(降解第70 d,质量损失率为28.3%)[33],这说明涂层的存在对人工韧带材料的降解起到了调控作用。

图10 不同降解时间样品的质量损失率Fig.10 Mass loss rates of samples after varying degradation time
2.3.4 降解过程中的结晶度
降解试验中,不同降解时间样品的X射线衍射(XRD)结果如图11所示。结晶度结果如表2所示。丝素蛋白的特征衍射峰位于20.40°和9.60°,而Hap的特征峰一般出现在25.20°和32.00°两个位置[34]。丝素纤维在降解过程中先降解非结晶区,故结晶度随降解时间的延长而升高。由图11可知,CAL芯轴与CAL外壳的结晶峰变化基本一致,CAL芯轴的结晶峰变化较小,外壳位于32.00°的结晶峰变化较大。这说明CAL内部芯轴的降解速率相较于CAL外壳更慢,因为芯轴被外壳包裹,且涂层延缓了丝素纤维与降解液的接触,从而延缓了材料的降解。以上结果证实了“壳芯”结构对样品整体降解周期的调控作用,与其他研究结果相一致。

表2 不同降解时间样品的结晶度

图11 不同降解时间样品的XRD结果Fig.11 XRD results of samples after varying degradation time
2.3.5 降解过程中的傅里叶红外光谱
AL和不同降解天数的CAL红外光谱如图12所示。与AL的红外图谱相比,CAL在2 990 cm-1和1 033~1 093 cm-1附近出现吸收峰,表明PU/Hap涂层的成功上载。观察CAL的降解,发现2 990 cm-1附近的亚甲基逐渐减小,表明PU在逐渐降解。从第2 星期开始,3 324 cm-1附近的羟基吸收峰逐渐减弱,到第8 星期时基本消失。这表明第8 星期时,芯轴表面的Hap已全部降解或剥落,因为3 324 cm-1附近的羟基吸收峰归属于Hap。同时1 033~1 093 cm-1附近的磷酸基团吸收峰逐渐增强,说明Hap发生了重结晶,这也与XRD测试中结晶度逐渐增高的结果一致。
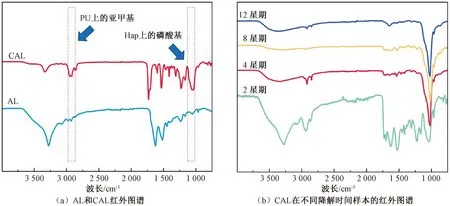
图12 样品红外图谱Fig.12 FTIR results of samples
2.4 细胞相容性
CAL和AL的CCK-8测试结果如图13所示。由图13可知,细胞在两种材料表面均能正常生长,细胞数量随培养时间的增加而增加;在分别培养1和4 d时,细胞在CAL表面的活性更高,这可能是由于PU/Hap涂层的表面光滑平整,有利于细胞的黏附铺展;在培养第7 d时,两者之间没有显著性差异(P>0.05),且两者的细胞相对增殖率均高于80%,细胞相容性良好。

图13 AL和CAL的CCK-8试验结果Fig.13 CCK-8 results of AL and CAL
不同培养时间CAL和AL的细胞荧光染色照片如图14所示。由图14可知,培养7 d后的CAL和AL表面均有较多细胞黏附生长;与AL相比,CAL表面的细胞数量更多、细胞活性更高;CAL表面的细胞更加铺展,胞体的突起增多,说明细胞相容性优良。
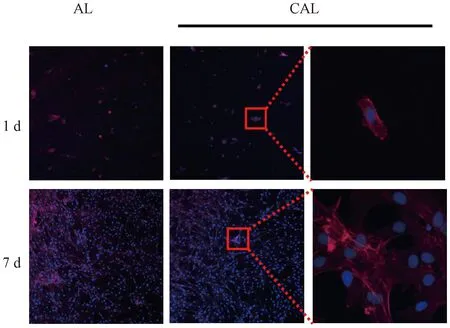
图14 AL和CAL表面细胞在不同培养时间的荧光染色照片Fig.14 Fluorescent micrographs of cells on AL and CAL after varying culture time
2.5 组织相容性
为进一步考察CAL和AL的体内生物相容性,本研究还开展了CAL和AL样品的大鼠背部皮下埋植试验。将AL和CAL样品分别在植入鼠背部皮下14、28和42 d后取出,进行石蜡包埋切片及H.E.染色,并利用生物显微镜观察并拍照。移植术后大鼠状态良好,术后2 d伤口处已基本愈合;4 d后有毛发长出,缝合处无炎症症状;7 d后伤口愈合良好。
样品在不同植入时间的组织切片显微照片如图15所示。由图15可知,植入14 d后,2种样品中均观察到少量淋巴细胞浸润,可见疏松结缔组织进入材料内部。与CAL相比,AL材料内部的组织长入更明显、更充分。这可能是由于CAL样品表面及芯轴表面存在涂层的缘故。在植入28 d后,淋巴浸润均有所减轻。材料内部的新生结缔组织更加明显、饱满,CAL样品中的增加更明显。而且,新生组织中可见血管新生。植入42 d后,2种材料内部空隙已经基本被新生组织填充,可见明显的血管新生,如图15红色方框所示。CAL样品中可见明显的2根芯的轮廓,新生组织填充在纱线及纤维之间的空隙中,新生血管丰富。新生组织与材料之间无明显界限,炎症细胞基本消失。以上结果表明,CAL的组织相容性良好,不会引发明显的炎症反应。CAL的涂层延缓了材料的体内降解,其多孔结构有利于新生组织的长入。由此可知,本研究开发的力学性能增强、降解延缓的CAL有望满足临床对力学性能及组织再生的要求,这为可降解人工韧带产品开发提供了积极参考。
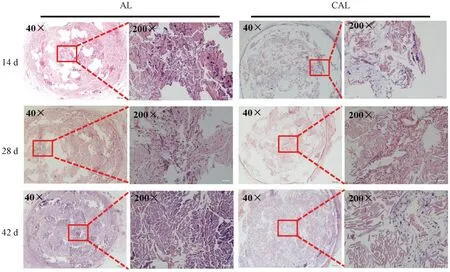
图15 AL和CAL样品在不同植入时间的组织切片显微照片Fig.15 Tissue section micrographs of AL and CAL samples at different implantation times
3 结 语
本研究针对目前人工韧带产品在临床应用中存在的问题,旨在开发一种具有力学性能优良、降解性能可控的可降解人工韧带材料。期望在人工韧带移植早期,能够提供充分的力学性能及可控的力学衰减。同时,随着人工韧带材料的降解,自体韧带组织能够再生。因此,本研究以力学性能及生物相容性良好的丝素纤维为原材料,编织了一种“壳芯”结构的人工韧带材料。运用PU/Hap溶液对其涂层,实现了力学性能增强及降解延缓的目标。该人工韧带材料结构规整、质感接近天然韧带组织,其力学性能及生物相容性良好,涂层延缓了CAL在体内外的降解。此外,大鼠背部皮下埋植试验结果表明,炎症反应轻微,新生组织长入到CAL材料内部。这提示本研究开发的CAL有望满足临床移植和组织原位再生的需求。本研究为开发新一代人工韧带产品提供了新的思路。

