MRI 扩散加权成像表观扩散系数预测食管癌患者同步放化疗疗效的价值
赖芳芳
龙岩市第二医院 (福建龙岩 364000)
食管癌作为常见消化道肿瘤,其病因较为复杂,涉及不良饮食习惯、亚硝胺类化合物接触、长期饮酒吸烟等多种因素,约占全身恶性肿瘤的2%,且近年来发病率逐年升高[1]。目前,对于不可手术的食管癌患者,临床多采取同步放化疗治疗,以有效杀灭肿瘤细胞,遏制肿瘤病灶进展[2]。但治疗期间需要根据疗效及时调整治疗方案,以提高患者的整体获益。MRI 作为现代医学常用影像学技术之一,可有效观察肿瘤病灶生长情况,指导临床治疗[3]。扩散加权成像作为一种新型MRI 成像技术,其通过测定表观扩散系数,可反映组织内水分子运动情况,从而判断细胞密度、细胞外间隙等改变情况,明确病情变化[4]。目前,已有研究证实MRI 扩散加权成像对食管癌具有较高的诊断价值,且表观扩散系数与患者预后有关[5]。基于此,本研究探讨MRI扩散加权成像表观扩散系数预测食管癌患者同步放化疗疗效的价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2020 年10 月至2022 年10 月我院收治的76 例食管癌患者作为研究对象。其中,男45 例,女31 例;年龄43~76 岁,平均(59.62±4.58)岁;肿瘤分期:Ⅲ期49 例,Ⅳ期27 例;肿瘤位置:上段21 例,中段35 例,下段20 例。本研究经医院医学伦理委员会批准(伦理审批号:20200912),且取得患者及家属的知情同意。
纳入标准:符合食管癌相关诊断标准[6];具有同步放化疗治疗指征;Karnofsky 功能状态评分≥70 分,体力状况(performance status,PS)评分≤2 分;意识清楚。排除标准:合并脏器原发性病变;合并胃癌、宫颈癌等其他部位恶性肿瘤;合并传染或感染性疾病;合并出血倾向或有血液疾病;入组前接受手术、放化疗等相关治疗;合并精神障碍;交流障碍。
1.2 方法
1.2.1 同步放化疗
全部患者均采用直线加速器(德国Siemens,型号:Primus)进行调强放射治疗,以常规分隔体外照射,1.8 Gy/次,5 次/周,总剂量为60~66 Gy;放射治疗剂量达40 Gy 时,行胸部CT、消化道钡剂造影检查,根据疗效调整放射治疗照射野。放射治疗期间,给予顺铂[齐鲁制药(海南)有限公司,国药准字H20073653,规格:20 mg]化疗,75 mg/m2,21 d 为1 个化疗周期。放化疗同步治疗2 个周期,治疗期间密切监测白细胞计数、血小板计数、放射性皮炎、胃肠道反应等,并积极给予对症处理。
1.2.2 疗效评价
同步放化疗治疗结束后依据实体瘤的疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)[7]评价疗效:病灶完全消失,未见新病灶,肿瘤标志物水平于正常范围维持时间≥4 周为完全缓解;病灶最长径总和减少≥30%,肿瘤标志物水平于正常范围维持时间≥4 周为部分缓解;病灶最长径总和减少<30%,但增大<20%为稳定;可见新病灶,或原有最大径增大≥20%为进展。完全缓解、部分缓解为有效,稳定、进展为无效。
1.2.3 MRI 检查
所有患者均于治疗前、治疗4 周、治疗结束时行MRI检查。设备采用Optix1.5T MRI(美国GE公司),线圈为8 通道头颈联合线圈,行快速恢复和自旋回波序列平扫、横断面T1WI、横断面抑脂T2WI、矢状面T1WI、冠状面抑脂T2WI 扫描,扩散加权成像选用短时间反转恢复平面回波扩散加权成像序列背景抑制。扫描参数:TR 7 075 ms,TE 74 ms,层数24,层厚5 mm,层间距0.5 mm,视野23 cm×23 cm,矩阵256×256,激励次数2,扫描时间64 s,b 值800 s/mm2。扫描结束后,经肘静脉团注Gd-DTPA造影剂(江苏恒瑞医药,国药准字H20153167,规格:15 ml:5.654 g),0.2 ml/kg,推注流率为2.5 ml/s。而后行横断面增强扫描,扫描参数如下:TR 3.8~4.8 ms,TE 1.5 ms,反转角12°,层数40,层厚3.6 mm,视野26 cm×26 cm,矩阵320×224,20 s/期,共扫描12 期。最后行矢状面、冠状面三维快速扰相梯度回波序列增强扫描,参数与横断面增强扫描相同。扫描结束后将数据传输至GEADW4.4 工作站,由经验丰富的MRI 医师使用Functool 测量肿瘤表观扩散系数:取肿瘤最大层面,将整个病灶区域作为感兴趣区,测定肿瘤平均表观扩散系数,共测量3 次,取平均值作为最终结果。
1.3 观察指标
依据RECIST 评价同步放化疗疗效,比较不同疗效患者不同治疗阶段的MRI 扩散加权成像表观扩散系数,分析治疗前MRI 扩散加权成像表观扩散系数预测食管癌患者同步放化疗疗效的价值。
1.4 统计学处理
采用SPSS 23.0 统计软件进行数据分析。计量资料以±s表示,两组比较采用t检验,多组比较采用方差分析。计数资料以率表示,采用χ2检验。预测价值采用ROC 分析,曲线下面积(area under curve,AUC)>0.9 表示预测价值高,>0.70~0.90表示有一定预测价值,>0.5~0.7 表示预测性能差。P<0.05 为差异有统计学意义。
2 结果
2.1 不同治疗阶段MRI 扩散加权成像表观扩散系数比较
76 例食管癌患者治疗前、治疗4 周、治疗结束时的表观扩散系数分别为(1.13±0.35)、(1.39±0.46)、(2.34±0.57)×10-3mm2/s。治疗4 周、治疗结束时的表观扩散系数均高于治疗前,差异有统计学意义(F=140.364,P<0.05)。
2.2 不同疗效食管癌患者的MRI 扩散加权成像表观扩散系数比较
76 例中同步放化疗治疗有效50 例,无效26 例。治疗有效组治疗前、治疗4 周、治疗结束时的表观扩散系数均高于治疗无效组,差异有统计学意义(P<0.05),见表1。
表1 不同疗效患者MRI 扩散加权成像表观扩散系数比较(×10-3mm2/s,±s)
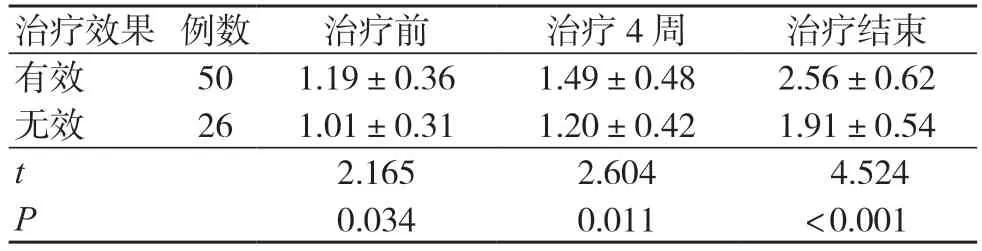
表1 不同疗效患者MRI 扩散加权成像表观扩散系数比较(×10-3mm2/s,±s)
治疗效果 例数 治疗前 治疗4 周 治疗结束有效 50 1.19±0.36 1.49±0.48 2.56±0.62无效 26 1.01±0.31 1.20±0.42 1.91±0.54 t 2.165 2.604 4.524 P 0.034 0.011 <0.001
2.3 ROC 分析
ROC 分析显示,治疗前MRI 扩散加权成像表观扩散系数预测食管癌患者同步放化疗疗效的AUC为0.933(95%CI:0.879~0.986),预测价值高,最佳截断值为1.090,此时灵敏度为0.900,特异度为0.846,约登指数为0.0746,见图1。
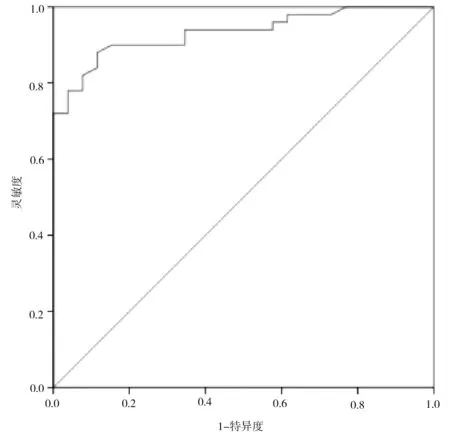
图1 治疗前MRI 扩散加权成像表观扩散系数预测食管癌患者同步放化疗疗效的ROC 曲线
3 讨论
食管癌作为高发消化道肿瘤,其好发于中老年男性,疾病早期手术治疗效果好,但70%的患者到院就诊时已处于疾病中晚期,无法行手术切除治疗[8]。同步放化疗作为中晚期食管癌患者的常用治疗方案,可利用放射线、化疗药物促使肿瘤细胞坏死,从而延长患者生存时间。但同步放化疗治疗期间,需寻求重要评估指标,以个体化调整治疗方案,提高整体疗效。
MRI 作为临床常用影像学检查,其组织分辨力高,成像技术类型多,且检查无辐射性,对肿瘤、心脑血管疾病等均具有较高的诊断价值[9]。扩散加权成像作为MRI 常用成像技术,其主要通过检测活体组织水分子的扩散运动判断细胞微观病变[10]。研究指出,扩散加权成像信号衰减除受组织内水分子扩散运动影响外,还受血流灌注或其他生理运动影响,因而单独依靠扩散加权成像组织信号强度无法完全体现分子运动情况[11]。表观扩散系数是扩散加权成像检测到的扩散系数,其可反映水分子扩散运动范围与速度,客观反映细胞内水分子运动情况[12]。陈熙等[13]研究发现,肿瘤患者MRI 扩散加权成像表观扩散系数显著,且表观扩散系数对病灶性质具有较高评估价值。目前,已有研究将MRI扩散加权成像表观扩散系数作为肿瘤定性、病理分级的主要影像学指标之一。陈倩等[14]研究表明,低分化程度、Dukes 高分期的直肠癌患者,其MRI扩散加权成像表观扩散系数显著降低,且表观扩散系数对直肠癌病灶分化程度、Dukes 分期具有一定预测价值。同时,也有研究发现,MRI 扩散加权成像表观扩散系数可用于局部宫颈癌患者腔内后装放射治疗疗效预测,且治疗2 次后表观扩散系数差异更大[15]。本研究结果显示,食管癌患者同步放化疗治疗4 周、治疗结束时的表观扩散系数均高于治疗前,且治疗有效组治疗前、治疗4 周、治疗结束时的MRI 扩散加权成像表观扩散系数均高于治疗无效组,说明MRI 扩散加权成像表观扩散系数与食管癌患者同步放化疗疗效有关,可用于疗效预测;进一步绘制ROC 曲线发现,治疗前MRI 扩散加权成像表观扩散系数对食管癌患者同步放化疗疗效的预测价值高,证实上述推测。分析原因在于,食管癌患者治疗前肿瘤细胞快速增殖,会导致正常细胞组织结构异常,增加细胞密度,从而会限制水分子运动与扩散,表观扩散系数降低[16];随着同步放化疗治疗的进行,肿瘤细胞膜受损,细胞膜通透性增加,细胞密度降低,从而利于组织内水分子扩散,表观扩散系数升高[17]。但也有研究发现,肿瘤治疗周期可能出现表观扩散系数降低的情况,这一结果可能与肿瘤细胞耐药、炎症引起的细胞间质纤维化等有关[18]。因此,未来应动态监测食管癌患者同步放化疗期间MRI 扩散加权成像表观扩散系数,根据表观扩散系数变化合理调整治疗方案,或增加靶向治疗,以提高整体疗效,改善患者预后。除MRI扩散加权成像表观扩散系数外,还有多种血清学、影像学等指标可能与食管癌患者同步放化疗疗效有关,但本研究并未将MRI 扩散加权成像表观扩散系数与其他指标进行对比,未探讨联合检测的预测价值,且本研究为单中心小样本研究,研究结果存有局限,未来需进一步研究探讨。
综上所述,MRI 扩散加权成像表观扩散系数对食管癌患者同步放化疗疗效有较高预测价值。

