上消化道肿瘤患者术后早期肠内营养喂养不耐受风险预测模型的构建
李婷婷,李晓琴,杨如美,王祝平,王 洁
(1.上海交通大学医学院附属瑞金医院卢湾分院,上海 200020;2.上海市静安区市北医院,上海 200443)
肠内营养(enteral nutrition,EN)具有经济、安全、有效等优点,是上消化道肿瘤术后患者营养支持的首选途径。术后早期肠内营养可改善患者胃肠黏膜屏障功能,促进胃肠蠕动恢复,维持充足的血液供应,实现体内高抵抗力和免疫力,防止术后继发感染,帮助患者术后恢复[1-2]。肠内营养过程中可能出现一些并发症,其中肠内营养喂养不耐受(enteral nutrition feeding intolerance,ENFI)就是最常见的并发症之一,患者会感到恶心、呕吐、腹胀、腹泻等不适,发生率可达30.5%~65.7%[3-4],症状严重时需暂停或中止肠内营养,导致患者营养障碍,增加术后并发症发生率,延长患者住院时间,增加医疗费用[5]。临床预测模型是一种预测患者结局风险、做出医疗决策、改善临床结局的量化工具[6],在现代医疗中起着重要作用。本研究通过分析上消化道肿瘤患者术后ENFI 危险因素,构建风险预测模型,以便医护人员早期识别ENFI 高风险患者,尽早实施预防性干预措施,降低术后早期ENFI发生率,减轻临床症状,促进患者术后康复。
1 对象与方法
1.1 对象选取2021 年5 月至2022 年12 月收治于我院普外科择期手术的上消化道肿瘤患者为研究对象。纳入标准:①符合《中国肿瘤临床诊断指南(2022)版》[7]中诊断标准,且经组织病理学检查确诊为上消化道肿瘤;②年龄≥18周岁;③行手术治疗;④术后早期经鼻肠管实施肠内营养。排除标准:①病历资料记录不全者;②术后并发症停用肠内营养者;③伴心、肝、肾等严重器质性病变患者。根据两组率的比较样本量计算公式:nc=[πt(1-πt)/k+πc(1-πc)](μ1-α/2+μ1-β)2/(πtπc)2,当nc=nt时,k=1,nt=nc=[(0.5×0.5+0.3×0.7)] ×(1.96+0.84)2/(0.5-0.3)2=90.16,考虑失访率15%,每组约104 例,故两组样本量共取210 例。根据患者是否发生术后早期ENFI 分为耐受组(n=89)与不耐受组(n=121)。
1.2 观察指标及资料收集方法基于文献研究,并结合相关专家意见,自行设计本研究相关资料调查表,包括:一般人口学资料[年龄、性别、手术部位、营养风险筛 查-2002(Nutrition Risk Screening,NRS-2002)]、手术实施情况(手术时间、麻醉时间)、术后7 d 患者肠内营养使用情况(肠内营养开始时间、术后7 d 内日用总量、ENFI 发生情况、是否胃肠内补钾制剂)、术后疼痛情况、术后下床活动时间、生化检查(血清白蛋白、血糖、血钾)。患者的一般人口学资料及治疗护理相关资料均通过医院电子病历系统进行回顾性收集,双人核对录入资料。
1.3 ENFI 的判断标准根据欧洲重症监护医学学会[8]确定的ENFI定义,结合目前临床实际情况,确定本研究中肠内营养喂养不耐受的判断标准为:①肠道不良反应的症状,呕吐或反流、腹胀、腹泻、胃肠道出血、肠鸣音减弱或消失、便秘;②72 h肠内营养尝试,不能由肠内营养途径实现20 kCal/(kg·d)的能量供给目标;③胃残余 量(gastric residual volume,GRV)≥500 mL/24 h 或GRV>250 mL/6 h 即视为高水平GRV。研究对象出现以上任一则视为发生ENFI。
1.4 统计学方法使用SPSS 20.0 进行数据统计分析,符合正态分布的计量资料采用均数±标准差表示,组间比较采用独立样本t检验。计数资料采用频数和构成比表示,组间比较采用χ2检验。将单因素分析中有统计学意义的因素作为自变量,采用二元logistic 回归分析其独立影响因素并绘制风险预警模型的ROC曲线;分别用受试者工作特征(operator characteristic curve,ROC)、校准曲线和霍斯默-莱梅肖(Hosmer Lemeshow,H-L)检验来评估预测效能。以P<0.05 表示差异有统计学意义。
2 结果
2.1 调查对象一般资料本次研究共纳入上消化道肿瘤术后患者210 例。男性患者137 例,女性患者73例;平均年龄(60.27±8.58)岁;食管癌9 例,胃癌82 例,十二指肠球部肿瘤30 例,胰腺癌22 例,肝癌28 例,胆管癌21 例,胆囊癌18 例。术后发生ENFI 为121 例,发生率为57.62%。其中,男73 例,女48 例;平均年龄(64.36±10.76)岁;26 例(21.49%)发生反流或呕吐,37例(30.58%)发生腹胀,16 例(13.22%)发生胃部不适,19 例(15.70%)发生腹泻,11 例(9.09%)发生便秘,高GRV 12 例(9.92%)。患者出现ENFI 时间为(2.43±1.54)d,持续(1.74±0.59)d,有24 例(19.83%)因此而中断EN。
2.2 上消化道肿瘤患者术后发生早期ENFI的单因素分析单因素分析结果显示,麻醉时间、营养风险筛查NRS 2002、肠内营养开始时间、胃肠内补钾、术后疼痛评分、术后下床活动时间、血清白蛋白、血糖对上消化道肿瘤术后患者发生早期ENFI的发生有影响,差异有统计学意义(P<0.05),见表1。

表1 两组患者术后早期肠内营养耐受情况的单因素比较[n(%)]
2.3 上消化道肿瘤患者术后早期ENFI 的多因素分析以发生ENFI 与否为因变量,将单因素分析中具有统计学意义的项目设为自变量(赋值情况见表2),进行logistic 回归分析。结果显示,低蛋白血症、高血糖、胃肠内补钾、术后疼痛≥4 分、术后3 d 后下床活动是上消化道肿瘤术后患者发生ENFI 的独立危险因素(P<0.05),详见表3。

表2 自变量赋值表
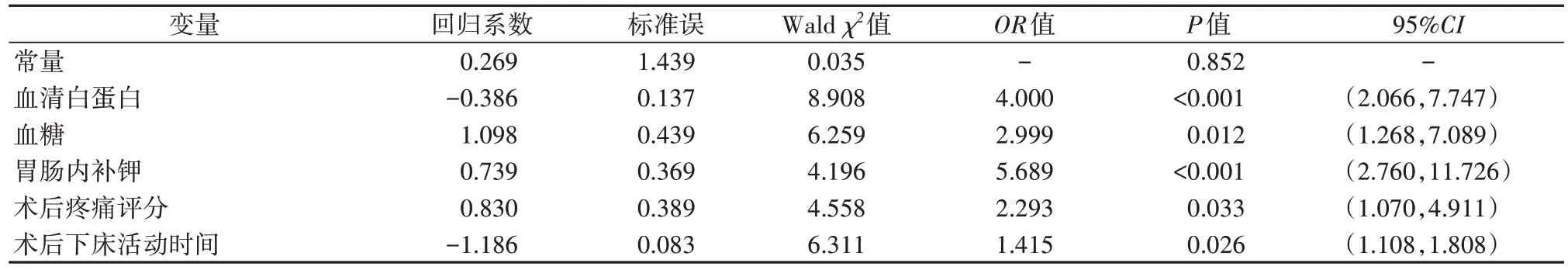
表3 上消化道肿瘤患者术后发生 ENFI的logistic回归分析
2.4 预测模型的构建及验证以回归分析中有意义5个独立影响因素,血清白蛋白(X1),血糖(X2),胃肠内补钾(X3),术后疼痛评分(X4),术后下床活动时间(X5),构建上消化道肿瘤患者术后ENFI 风险预测模型,根据β值及独立预测因子建立模型表达式[9]:Logit(P)=0.269-0.386×X1+1.098×X2+0.739×X3+0.830×X4-1.186×X5。采用H-L 检验预测模型拟合优度,结果显示χ2=6.523(P=0.367),提示模型拟合度良好。绘制模型的ROC 曲线,曲线下面积(area under the curve,AUC)为0.916[P<0.05,95%CI(0.891,0.940)],最大约登指数为0.689,灵敏度为0.857,特异性为0.832,表明模型有良好的预测效能,见图1。
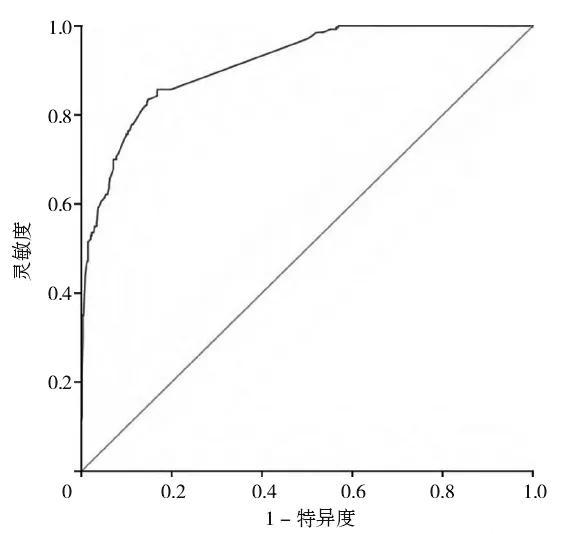
图1 上消化道肿瘤患者术后早期ENFI风险预测模型的ROC曲线
3 讨论
3.1 上消化道肿瘤患者术后早期ENFI 发生率较高国内临床研究显示我国约有43.7%[5]的住院患者使用肠内营养。肠内营养不耐受是肠内营养实施过程中最常发生的问题之一[10],增加了患者营养不良的风险。本研究结果显示上消化道肿瘤患者术后早期ENFI 的发生率为57.62%,与国外研究结果[3-4]相似。说明此类患者ENFI 的发生风险较高,应引起临床广泛重视,而ENFI 的早发现、早预防、早干预是临床关注的重点。因此本研究希望通过构建上消化道肿瘤患者术后早期ENFI 预测模型帮助临床医护人员早期识别ENFI 高风险患者,降低上消化道肿瘤患者术后早期ENFI的发生率,促进患者术后康复。
3.2 上消化道肿瘤患者术后早期ENFI 危险因素分析
3.2.1 低血清白蛋白本研究中,不耐受组中血清白蛋白低于35 g/L 的患者有76 例(62.81%),与张庆男等[11]得出结论相似,其研究发现ENFI在血清白蛋白低于30 g/L 的患者中的发生率增加了2.5 倍。可能是因为此时的机体血浆胶体渗透浓度降低,易引起呕吐、腹泻等不耐受症状[12]。上消化道肿瘤患者手术前、后若出现低蛋白血症,则ENFI的症状更为明显和持久。苏小平等[13]的研究显示较高的血清白蛋白水平是危重患者发生早期肠内营养喂养不耐受的保护性因素。因此对于上消化道肿瘤的患者,术前应尽可能纠正患者营养不良状态,提高患者血清白蛋白水平,术后动态监测血清白蛋白指标,及时干预从而减轻术后发生ENFI的几率。
3.2.2 高血糖本研究结果显示,不耐受组术后血糖>10 mmol/L 患者有95 例(78.51%)。手术创伤、麻醉、精神紧张等因素导致术后血糖应激性上升,从而造成血糖控制困难[14]。高血糖可引起胃肠收缩力减弱,使得胃排空延缓,患者更易发生ENFI[15]。研究发现血糖>10.0 mmol/L 时,人体易发生腹胀、恶心、呕吐[16]。Chapman等[17]的研究得到类似结果,当血糖>11.1 mmol/L可能会加重胃轻瘫的症状,延缓胃排空,因此这也提示了医护人员应早期对患者进行血糖管理,控制患者手术前后血糖水平,降低ENFI发生的风险。
3.2.3 胃肠内补钾制剂本研究中经胃肠内补钾制剂的患者发生ENFI的有82例(67.77%),与曾佳琪等[18]的研究结果一致。上消化道肿瘤患者因术中体液丢失,术后短期内无法恢复正常饮食,易出现低钾血症。因此,患者在早期行EN时,常同时经胃肠进行补钾治疗。钾制剂是高渗性溶液,对胃肠道的刺激作用较强,易引起腹泻等不耐受症状[19]。护士在进行胃肠内补钾制剂时应合理调整使用时间和次序,避免在患者空腹时给予,并在使用前进行稀释,避免短时间内快速进入患者胃肠道,同时应密切关注患者补钾后有无发生腹泻症状。若严重腹泻,应及时改变给药途径,防止症状加重。
3.2.4 术后急性疼痛≥4 分、术后3 d 内下床活动本研究收集患者术后7 d内的疼痛评分,结果显示术后平均疼痛≥4分的患者发生ENFI的有39例(32.23%)。既往研究表明,通常在术后7 d 内,约10%~57%的患者有中重度疼痛,称为术后急性疼痛,在上腹部手术尤甚[20]。术后中重度疼痛易导致患者胃肠道功能障碍,进而出现术后ENFI。相较术后轻度疼痛患者,术后疼痛控制不佳的患者更易发生ENFI,与Wu 等[21]的研究结果相同。而适当的术后镇痛方案可以有效缓解术后疼痛,促进胃肠道功能的恢复[22]。此外,科学合理的术后早期活动有利于促进胃肠功能恢复。研究表明腹部手术下床活动时间与肛门排气呈正相关,活动越早排气越早[23-24]。术后早期活动还能促进机体新陈代谢,增强EN的吸收和利用,改善患者术后营养[25]。本研究显示术后3 d 内下床活动是ENFI 的保护因素,下床时间越早,患者ENFI 发生率低,同时能缩短管饲肠内营养时间,恢复经口进食。医护人员在进行EN治疗时也应关注患者术后活动情况,鼓励患者早日下床活动的同时,控制术后疼痛,拟定患者活动计划,帮助术后患者尽早下床活动,早日恢复胃肠功能,降低ENFI发生。
3.3 上消化道肿瘤患者术后早期ENFI风险预测模型临床意义AUC 为0.7~0.9 时通常被认为模型的预测效能较好,本研究模型AUC 为0.916,证明模型区分能力较好,能有效预测上消化道肿瘤患者术后早期ENFI风险,筛选高危患者。当模型最大约登指数为0.689时,其灵敏度为0.857,表明模型准确预测ENFI 的概率较高;特异度为0.832,表明模型预测不发生ENFI 的预测能力也较好。此模型便于医护人员早期识别ENFI高危人群,能够帮助指导护士预先开展针对性干预措施,具有较强的临床实用性。
4 小结
由于本研究为单中心研究,样本缺乏多中心的证据支持,同时样本量有限,对构建的风险预警模型只进行了定性评价,没有对模型进行进一步的验证,在不同患者中的应用效果可能会有所差异。因此,今后可对模型进行内外部验证,进一步检验该模型的预测效果,便于临床的推广应用。

