一种BAC载体的构建及其在CYP2A6单倍型分析中的应用
赵芳玲 綦钰莹 蔡剑平 戴大鹏
高质量的大片段基因组文库的构建是基于图谱的基因克隆和物理图谱构建的必要技术平台,这极大地方便了基因组学的研究工作,成为人类基因组计划顺利进行的重要支撑[1~3]。最早使用的克隆载体是λ噬菌体,其插入片段为20kb左右,且仅能应用于一般基因的克隆。随后发展出的Cosmid载体的插入片段增大到45kb,但仍不能满足于较大的基因簇的研究。20世纪80年代起酵母人工染色体YAC作为最早发展的真正意义上的人工染色体应运而生[4]。YAC能够构建完整基因组文库,但其稳定性较差、转化率低、基因分离难度大。随后以大肠杆菌F因子为基础的BAC载体系统迅速发展并被广泛应用[5]。BAC载体的插入片段最高可达300kb,因以大肠杆菌为寄主故转化率高,较YAC文库更容易构建,且复制子来源于F因子,无嵌合现象可稳定遗传[6]。这些优点使得BAC载体成为基因组文库构建和较大基因簇研究的主要工具。
BAC载体经研发应用后也不断被改造优化以更方便基因组克隆。pBeloBAC11载体是第2代BAC载体的代表,其在第1代载体pBAC108L的克隆位点中引入了lacZα基因可通过蓝白斑筛选作为重组子选择标记。但是pBeloBAC11载体是单拷贝复制,且提取质粒DNA时还需进行CsCl-EB密度梯度离心纯化[7]。因此很难得到大量高纯度的质粒DNA。高拷贝复合载体pCUGIBAC1的出现很好地解决了这一问题[8]。该载体由高拷贝克隆用载体pGEM-4Z与BAC载体plndigoBac536融合连接组成,既保留了BAC载体容纳大片段的特性,又显著提高了质粒拷贝数,进而降低了质粒纯化及后续分子克隆操作的难度。
本研究在此原理上将pBeloBAC11与pGEM-3Z两载体进行改进融合改造,同时增加多克隆酶切位点数目,以方便后期外源基因的接入,最终得到高拷贝复合BAC载体pBAC-BJH。利用该载体本研究将CYP2A6基因大片段DNA导入双酶切后的线性BAC载体并成功用于单倍型分析。
材料与方法
1.试剂与材料:大肠杆菌(E.coli)菌株DH10B购自北京博迈德基因技术有限公司;质粒pGEM-3Z购自美国Promega公司;质粒pBeloBAC11购自北京诺鑫盛源科技有限公司;NEB bufferr2.1购自美国NEB公司;DNA Ligation Kit购自日本TaKaRa公司;HindⅢ、BamHⅠ内切酶购自北京兰博利德商贸有限公司;琼脂糖凝胶回收试剂盒购自北京天根生化科技有限公司;KOD One PCR Master Mix购自日本Toyobo公司。引物由北京擎科生物科技股份有限公司合成。
2.中间载体pGEM-3Z-BJH和pBAC-LOW的构建:合成表1中的退火上游和下游引物,分别稀释至100μmol/L,各取10μl与2.2μl 10×NEB buffer 2混合,运行如下程序退火:95℃保持3min,90℃保持1min,85℃保持1min,80℃保持1min,75℃保持1min,70℃保持1min,65℃保持1min,60℃保持1min,55℃保持1min,50℃保持1min,45℃保持1min,40℃保持1min,35℃保持1min,30℃保持1min,25℃保持1min,然后冷却至4℃。退火产物稀释100倍后取2μl与30~50ng BamHⅠ/HindⅢ双酶切的pGEM-3Z或pBeloBAC11质粒,TaKaRa连接kit 16℃连接30min后转化DH10B感受态细胞,并在含100μg/ml氨苄青霉素(pGEM-3Z)或12.5μg/ml氯霉素(pBeloBAC11)的LB固体培养基过夜培养,利用T7和SP6引物进行菌落聚合酶链反应(polymerase chain reaction,PCR)筛选阳性克隆。原载体为阴性对照,2%琼脂糖凝胶电泳挑选条带增加127bp的菌落并提取质粒,获得重组中间载体pGEM-3Z-BJH及pBAC-LOW并利用T7进行测序以验证序列是否正确。

表1 所用引物及序列信息表
3.目的载体高拷贝质粒pBAC-BJH的构建:HindⅢ单酶切pGEM-3Z-BJH及pBAC-LOW 37℃ 2h,酶切产物回收后取60ng pGEM-3Z-BJH与30ng的pBAC-LOW进行连接,连接产物转化DH10B感受态细胞后均匀涂布于含100μg/ml氨苄青霉素及12.5μg/ml氯霉素抗性的平板并进行蓝白斑筛选。挑取蓝色菌斑,使用通用引物M13上游引物和M13下游引物进行菌落PCR。由于目标载体内应会含有2段lacZα,阳性克隆扩增后会分别得到一条2909bp和一条166bp大小的条带。测序验证后提取目的质粒命名为pBAC-BJH。
4.重组载体pBAC-BJH应用于CYP2A6基因组大片段克隆:使用NCBI网站的Primer-BLAST在线工具设计CYP2A6扩增上游引物(含BstBⅠ位点)及下游引物(含MluⅠ位点),参照STI PCR文献[9],利用在线工具calGC确认扩增条件为ProgamⅠ,n=10。参照使用说明,利用KOD One PCR Master Mix扩增CYP2A6的启动子区及全部外显子区(9576bp),产物经1%琼脂糖凝胶电泳后,切胶回收目的条带并使用BstBⅠ与MluⅠ37℃双酶切2h,酶切产物纯化后备用。使用BstBⅠ与MluⅠ双酶切2μg新构建的pBAC-BJH载体,1%琼脂糖凝胶电泳后切胶回收7.5kb的BAC载体,并与同样酶切纯化后的CYP2A6 PCR产物连接,热激转化DH10B感受态细胞后进行蓝白斑筛选实验,次日挑取白色菌斑,使用克隆筛选引物进行菌落PCR。提取阳性克隆质粒,并使用外显子1测序引物及外显子3测序引物对不同克隆中包含的2A6外显子1和外显子3进行测序分析,以鉴定CYP2A6样本包含的不同SNP是否位于同一条DNA链上。
结 果
1.中间质粒载体的构建:本研究对比分析了两种市售常用T载体pGEM-3Z和pMD19-T中lacZα基因的蛋白序列,发现氨基酸存在差异的部分集中在N端,据此推测,N端的编码基因改变可能不会影响lacZα基因功能的正常行使。为此,本研究在克隆载体pGEM-3Z及BAC载体pBeloBAC11的BamHⅠ酶切位点之间加入了SphⅠ、PmeⅠ、SacⅡ、PacⅠ、NheⅠ、MluⅠ、BstBⅠ等7个酶切位点,获得两个中间载体pGEM-3Z-BJH及pBAC-LOW,在保证lacZα维持正常功能的同时,增加后续基因操作时的便捷性(图1)。蓝白斑筛选实验证实,新加入的酶切位点确实未影响lacZα基因的正常功能。

图1 lacZα编码基因的改造
2.目的载体高拷贝质粒pBAC-BJH的构建路径:使用HindⅢ单酶切中间载体pGEM-3Z-BJH及pBAC-LOW并连接,由于两个中间载体的lacZα基因完全相同,两者连接可得到lacZα尾尾相连或头尾串联两种类型的重组质粒,但只有lacZα头尾串联重组的菌株保持两个完整的lacZα基因,从而在蓝白斑筛选中呈现蓝斑。挑取蓝斑测序验证最终得到同时具有高拷贝特性及扩增大片段能力的载体pBAC-BJH(图2)。
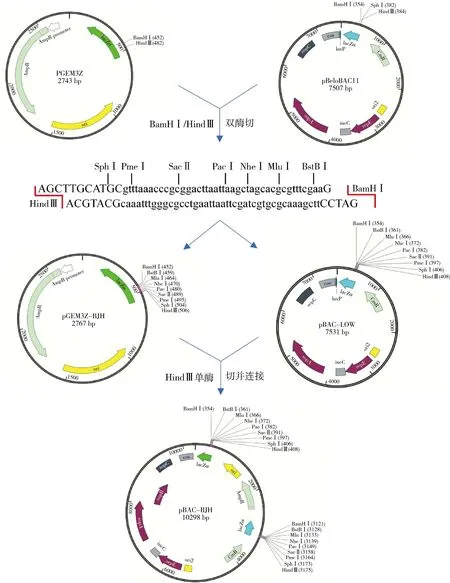
图2 pBAC-BJH载体构建流程图
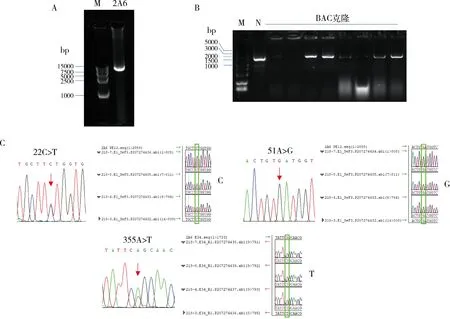
图3 利用构建的BAC载体对CYP2A6新突变355A>T开展单倍型分析
3.pBAC-BJH可用于大片段DNA的克隆及分型鉴定:为验证新构建BAC载体的有效性,本研究利用STI PCR方法成功扩增了CYP2A6的启动子区及全部外显子区,产物长度为9576bp(图3A),利用传统的限制性内切酶酶切与连接的方式,将扩增产物与同样双酶切的pBAC-BJH载体连接并化学转化大肠杆菌(图3B),通过对获得的不同BAC克隆进行测序分析,对CYP2A6的不同单倍型进行基因分型解析。前期研究中笔者团队在1例汉族志愿者中检测到了一种新的SNP突变355A>T,该SNP位于CYP2A6基因的外显子3,可引起第119位的氨基酸由丝氨酸突变为半胱氨酸(即S119C),同时PCR产物测序发现,该突变携带者在外显子1还存在另外两个SNP位点,分别是22C>T及51A>G(图3C)。随机挑选4个BAC克隆并进行测序分析,发现全部克隆均携带新突变355A>T及51A>G,但并不携带22C>T。据此,本研究认为,携带者的22C>T、51A>G、355A>T 3个SNP单倍型分析结果为CGT。
讨 论
BAC载体在基因组文库构建、物理图谱制作、基因组测序等研究中有着不可取代的位置[10~12]。BAC载体相较λ噬菌体、Cosmid黏粒以及YAC载体,同时兼备插入片段大、无嵌合现象、转化率高等优点。但其低拷贝的特性导致BAC质粒提取时需大量培养菌体,且纯化过程复杂,制备成本较高[7, 13]。为解决这一问题,Luo等[8]将高拷贝的pGEM-4Z克隆载体与低拷贝的BAC载体pLindigoBac536偶联,得到高拷贝复合载体pCUGIBAC1。使用时该载体利用EcoRⅠ或HindⅢ单酶切的方式,可将连入的pGEM-4Z部分去除,获得与低拷贝BAC载体同样特性的接收载体,用于外源大片段DNA的插入。随后该载体成功应用于鲨鱼、对虾等物种的基因组测序分析[14, 15]。但另一方面,随着测序技术的更迭及大规模基因组计划的完成,人们已不再需要将数百kb的大片段基因组DNA克隆入BAC载体进行测序分析,反而需要对仅数kb的片段进行亚克隆,并对其包含的众多SNP进行单倍型分析。传统BAC载体通常仅使用EcoRⅠ或HindⅢ等少数几种内切酶单酶切以用于外源DNA片段的插入,这种方式一方面容易造成载体自连,另一方面可用内切酶的数量稀少,大大限制了不同基因克隆时的应用范围。为此,本研究对两个入门的载体pGEM-3Z及pBeloBAC11进行了遗传改造,在BamHⅠ和HindⅢ之间加入了BstBⅠ等7种酶切位点,大幅提升了BAC载体在大片段基因克隆时的适用性,同时又保证lacZα正常功能的行使,方便利用蓝白斑筛选来鉴定载体中是否有外源DNA片段的插入(图1、图2)。双酶切方式的引入,一方面降低了载体自连的概率,同时又提高了外源基因的插入效率,即便使用热激转化的低效质粒转化方式仍然可以获得较高的阳性克隆效率(图3)。
细胞色素p450(简称CYP或p450)酶系是一类最重要的药物代谢酶,参与超过80%的临床药物的体内代谢,其编码基因呈现高度遗传多态性,且在不同种族、不同地域间存在显著差异,是造成个体间药物代谢能力差异的最重要原因之一[16]。根据药物基因变异联盟PharmVar(Pharmagene Variation Consortium)网站的信息,多数CYP等位基因同时包含多个SNP位点,且新等位基因申请时必须提供携带者包含的各SNP的单倍型信息[17]。CYP2A6是CYP2家族中的重要成员,该酶参与约3%临床常用药物的体内代谢或活化[16]。与其他CYP基因类似,CYP2A6基因也呈现高度的遗传多态性,并进一步影响各变异体的药物代谢活性[18]。
本研究利用新构建的高拷贝复合载体pBAC-BJH,成功对新发现的CYP2A6突变355A>T(非同义突变,可导致S119C变异)的携带者进行了单倍型分析,结果表明,该载体及基因克隆和分型策略完全可应用于其他CYP基因的遗传分型分析。配合其他基因表达载体,该载体未来也可应用于较大基因的克隆和表达分析[19]。需要指出的是,本研究由于采用了热激转化的方式将连接产物导入大肠杆菌,虽然降低了使用门槛,无需购置价格高昂的电转化仪,但获得的阳性克隆数较少,且存在短片段插入干扰的问题。后期采用电转化的方式有望进一步提高转化效率和分型效率。
利益冲突声明:所有作者均声明不存在利益冲突。

