血清生长相关蛋白-43、α-突触核蛋白对小儿癫痫诊断价值研究
贾小慧,秦雪莲,刘青,刘亚楠,廉喆
癫痫是儿童期最常见的慢性神经系统疾病,约占总人群发病率的50/10万[1]。癫痫发作及合并症如注意缺陷、焦虑及抑郁等可导致患儿严重生活障碍[2]。生长相关蛋白-43(growth associated protein 43,GAP-43)是一种突触前神经末梢富集的胞膜磷蛋白,在神经纤维发育、轴突再生及突触功能维持等方面发挥重要的作用[3]。研究发现,GAP-43的降低能够促进颞叶神经细胞损失,促进癫痫持续状态的形成[4]。α-突触核蛋白(α-Synuclein,α-Syn)是脑神经元含量最丰富的蛋白质之一,参与调节神经递质释放、突触传递及神经元凋亡等过程,与阿尔茨海默病、多发性硬化等神经系统退行性疾病关系密切[5]。有学者在内侧颞叶癫痫患者中发现海马神经元中α-Syn沉积,其促进神经系统慢性炎性反应及癫痫发作的发生[6-7]。目前癫痫患儿血清GAP-43、α-Syn表达及临床意义尚不清楚。本研究检测癫痫患儿血清GAP-43、α-Syn水平,探讨两者对癫痫的诊断价值,报道如下。
1 资料与方法
1.1 临床资料 选取2019年4月—2022年4月临汾市人民医院儿科诊治小儿癫痫患者80例为癫痫组:男46例,女34例,年龄3~14(6.21±0.76)岁;病程2~37(7.34±2.15)个月;均无明显诱因及癫痫家族史;癫痫类型:全身强直阵挛发作45例,局灶性发作35例;根据第4版韦氏儿童智力量表评分[8]分为认知功能障碍27例(评分≤69分),无认知功能障碍53例(评分>69分)。选取同期医院神经内科诊治的晕厥患儿50例为晕厥组:既往均无神经内科疾病且经头颅影像学检查排除器质性病变,男27例,女23例,年龄4~12(6.17±0.69)岁。选取同期外科择期手术的腹股沟斜疝患儿50例为对照组,均无神经内科疾病且经头颅影像学检查排除器质性病变,男27例,女23例;年龄3~14(6.09±0.71)岁。3组患儿性别、年龄之间比较,差异无明显统计学意义(P>0.05)。本研究经医院伦理委员会批准通过(T20190313001),患儿家属知情同意并签署知情同意书。
1.2 癫痫组病例选择标准 (1)纳入标准:① 原发性癫痫诊断符合国际抗癫痫联盟的诊断及分类标准[9],且距离最近一次发作时间<1周;②首次发病,年龄≤14岁;③临床资料完整。(2)排除标准:①经头部计算机断层扫描及磁共振成像等证实存在器质性病变,包括脑外伤、脑发育畸形、颅内占位及脑梗死等;②有癫痫家族史;③有神经系统其他疾病;④合并肝肾等脏器功能障碍;⑤既往有抗癫痫治疗或免疫抑制剂用药史。
1.3 观测指标与方法
1.3.1 血清GAP-43、α-Syn水平检测:采集研究对象清晨空腹静脉血5 ml,室温静置1 h后离心留取上层血清,-20℃冰箱保存待测。以Multiskan FC酶标仪(购自美国赛默飞公司)采用酶联免疫吸附试验检测血清GAP-43、α-Syn水平。GAP-43 ELISA试剂盒购自上海臻科生物公司,货号ZK-3466。α-Syn ELISA试剂盒购自深圳子科生物公司,货号ZK-H1620。试验步骤按照试剂盒操作说明进行。
1.3.2 脑电监测及颅脑MR检查:(1)常规脑电图检查。患儿入院72 h内使用脑电采集监测系统(美国Nicolet one EEG v32)完成常规脑电图检查,出现异常脑电图及不同频段脑功能区功率升高为阳性。异常脑电图包括广泛性或爆发性棘波、尖波、尖—慢综合波、棘—慢综合波、较多散在3 Hz左右δ波、背景以θ节律/δ波为主等;脑功能区功率升高频段包括δ频段、α频段、θ频段、δ+θ频段。(2)颅脑多序列检查。入院72 h内,采用德国西门子公司生产的1.5T超导MR成像系统进行颅脑多序列检查,提示颅内非特异病变为阳性,表现为脑积水、脑萎缩、脑内囊肿、脑室扩张、巨脑回形成、丘脑白质体积减少、皮质发育异常、脱髓鞘病变等。
1.3.3 癫痫严重程度评估:参考国立医院癫痫发作严重程度量表(National Hospital Seizure Severity Scale,NHS3)评分[10],评估癫痫患儿癫痫发作的严重程度。评分范围1~27分,分值越高,癫痫发作越严重。

2 结 果
2.1 3组血清GAP-43、α-Syn比较 血清GAP-43水平癫痫组<晕厥组<对照组,差异均有统计学意义(P均<0.05);血清α-Syn水平癫痫组>晕厥组>对照组,差异均有统计学意义(P均<0.05),见表1。

表1 3组血清GAP-43、α-Syn水平比较Tab.1 Comparison of serum GAP-43,α-Syn levels in three groups
2.2 血清GAP-43、α-Syn在癫痫患儿不同临床特征中比较 患儿血清GAP-43在癫痫局灶性发作、无认知功能损害者中升高,α-Syn水平在癫痫局灶性发作、无认知功能损害者中降低,差异均具有统计学意义(P均<0.05),二者在患儿性别、年龄、脑电图异常、头颅MR异常者中比较,差异无统计学意义(P均>0.05),见表2。

表2 血清GAP-43、α-Syn在癫痫患儿不同临床特征中比较Tab.2 Comparison of serum GAP-43,α-Syn in different clinical characteristics of children with epilepsy
2.3 血清GAP-43、α-Syn与癫痫严重程度的相关性 癫痫组患儿NHS3评分3~25 (14.57±3.22)分。Pearson相关性分析显示,血清GAP-43水平与NHS3评分呈负相关(r=-0.645,P<0.001),血清α-Syn水平与NHS3评分呈正相关(r=0.702,P<0.001)。
2.4 血清GAP-43、α-Syn及联合检测对小儿癫痫的诊断价值 绘制血清GAP-43、α-Syn及两项联合预测小儿癫痫的诊断价值ROC曲线,并计算曲线下面积(AUC),结果显示:血清GAP-43、α-Syn及两项联合预测小儿癫痫的AUC分别为0.740、0.738、0.835,二项联合预测的AUC高于单项预测,差异具有统计学意义(Z=4.482、4.391,P均<0.001),见表3、图1。
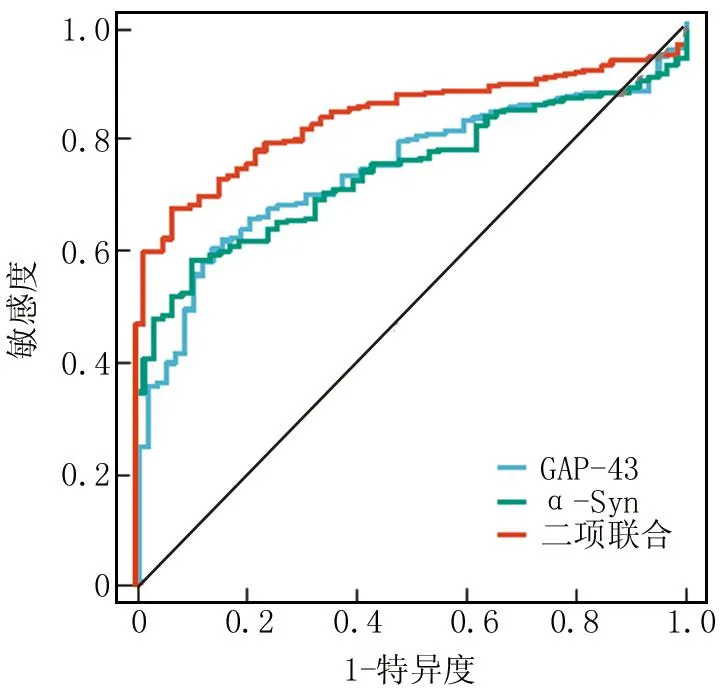
图1 血清GAP-43、α-Syn及联合检测对小儿癫痫的诊断价值ROC曲线Fig.1 ROC curve of diagnostic value of serum GAP-43,α-Syn and combined detection for pediatric epilepsy

表3 血清GAP-43、α-Syn及两项联合预测小儿癫痫的诊断价值分析Tab.3 Analysis of diagnostic value of serum GAP-43,α-Syn and two joint predictions for pediatric epilepsy
3 讨 论
癫痫是婴幼儿及儿童最常见也是最具有破坏性的神经系统疾病。全球范围内,癫痫患病例数达5 000万例,每年死亡例数达12.5万例[11]。目前小儿癫痫的诊断主要根据间隔24 h的2次或2次以上无源性发作病史进行判断。虽然脑电图、脑成像及基因检测为癫痫的诊断提供了重要支持,但仍有一定的误诊率[12]。深入研究小儿癫痫的疾病机制,寻找能够早期辅助诊断癫痫的血清生物标志物,具有重要意义。
GAP-43是一种神经细胞膜上的磷蛋白,在生长锥及突触前末梢中表达较为丰富,是轴突生长的关键因子。GAP-43主要表达于嗅球、海马及皮质联合区等可塑性区域中,神经元和神经胶质细胞在脑损伤时能释放GAP-43等神经营养因子,促进神经修复和再生[13]。本研究中,癫痫患儿血清GAP-43水平降低,提示GAP-43可能参与癫痫的发生。有学者在幼年大鼠脑可塑性模型中证实,在戊四唑诱导的癫痫发作持续10 h~3 d后,CA3、CA1等区域的GAP-43 mRNA水平下降,导致大脑内神经元形成异常的突触联系及病理性神经环路,促进癫痫的发生[14]。此外,癫痫患儿血清GAP-43水平与癫痫严重程度有关,提示GAP-43的降低促进癫痫的疾病进展。有学者报道,癫痫患儿血清GAP-43水平与血锌水平呈正相关,GAP-43表达水平的降低导致神经元损伤修复能力减弱,神经元过度兴奋及癫痫发作导致大量活性氧等氧自由基的产生,消耗机体抗氧化剂锌等微量元素,造成氧化与抗氧化系统平衡失调,加重神经元损伤及癫痫发作严重程度[15]。另外,Royero等[4]发现,GAP-43的水平降低能够激活赖氨酸受体,参与癫痫持续状态后海马中发生的神经元丢失和皮质神经元的功能重组,促进神经元内钙离子内流,激活钙离子依赖性蛋白激酶,促进神经元信号传导的长时程增强[4]。本研究中,血清GAP-43水平在全身强直痉挛发作、伴有认知功能损害的癫痫患儿中降低更为明显。笔者分析,一方面是GAP-43水平降低能够降低血锌水平,阻断抑制性神经递质γ氨基丁酸,导致超氧化物歧化酶和谷胱甘肽过氧化物酶合成不足,促进全身强直痉挛发作[16]。另一方面,GAP-43水平降低导致其神经修复能力减弱,过度氧化应激加重小胶质细胞中白介素1β等促炎性因子的表达,诱导神经元凋亡,造成患儿认知功能损害[17]。因此,GAP-43的水平降低参与小儿癫痫的发生发展,是新的小儿癫痫血清标志物。
α-Syn在中枢神经系统突触前末梢及神经元核内广泛表达,是由140个氨基酸组成的可溶性小分子蛋白质。α-Syn可以聚集形成不溶性的寡聚体,影响突触小泡运输、减少神经递质释放及引起线粒体和突触功能障碍,在神经退行性疾病中发挥重要作用[18]。近年来发现,成年顽固性癫痫患者的脑脊液和血清中α-Syn水平均明显升高,有助于顽固性癫痫的鉴别诊断及预后评估[19]。本研究中,癫痫患儿血清α-Syn水平升高,提示α-Syn可能参与促进小儿癫痫的发生。既往学者在毛果芸香碱诱导癫痫动物模型中也证实,海马齿状回和近中颞叶组织中α-Syn表达增加,而α-Syn的大量沉积能够诱导神经元局部炎性反应的发生,损伤神经细胞,诱导反应性胶质增生,促进顽固性癫痫的发生[20]。本研究中血清α-Syn水平与癫痫严重程度呈正相关,表明血清α-Syn升高参与促进癫痫疾病进展。分析其原因,α-Syn的表达升高能够诱导星形胶质细胞分泌产生白介素1β及白介素6等促炎细胞因子,促进炎细胞浸润、破坏血脑屏障并活化小胶质细胞,加重癫痫发作严重程度[21]。本研究中,伴有认知功能损害的癫痫患儿血清α-Syn水平明显升高,表明α-Syn有助于反映癫痫患儿认知功能损害情况。分析其原因,α-Syn水平升高能够诱导神经系统慢性炎性反应状态的形成。有学者在内侧颞叶癫痫动物模型中,发现海马组织中α-Syn的蓄积能够诱导神经系统炎性反应及胶质细胞的过度增殖,造成海马硬化及长时程增强改变损伤动物的空间学习记忆功能,导致认知功能障碍的发生[6,22]。本研究通过ROC曲线分析发现,血清GAP-43、α-Syn联合对癫痫诊断的曲线下面积为0.835,诊断的敏感度和特异度分别为0.776、0.804,表明两项联合对于小儿癫痫具有较高的诊断价值,有望成为小儿癫痫早期诊断的生物标志物。
综上所述,小儿癫痫血清GAP-43降低,α-Syn表达升高,两者与癫痫严重程度、发作类型及认知功能损害有关,均参与小儿癫痫的发生发展过程。血清GAP-43、α-Syn联合对小儿癫痫具有较高的诊断效能,有利于辅助临床医生早期诊断小儿癫痫。本研究也存在局限性,如样本量有限,纳入研究对象可能存在一定的偏倚。另外,本研究未对脑脊液中GAP-43、α-Syn水平进行检测,有待日后扩大样本量,设计严格病例对照研究,深入探索两者的临床价值。
利益冲突:所有作者声明无利益冲突
作者贡献声明
贾小慧、秦雪莲:设计研究方案,实施研究过程,论文撰写 资料搜集整理,论文修改;刘青、刘亚楠、廉喆:实施研究过程,数据收集,分析整理,进行统计学分析

