老年乳腺癌组织中PTBP3、USP28表达与术后复发转移的关系
张小雪,刘晓婷,李阳,于韬,邬晓明,高岿然
乳腺癌是女性最常见的恶性肿瘤,我国乳腺癌发病率52.81/10万,死亡率约13.40/10万[1]。近年来随着人口老龄化,60岁以上老年乳腺癌患者患病例数逐渐增多[2]。多聚嘧啶结合蛋白3(polypyrimidine tract binding protein 3,PTBP3)是一种RNA结合蛋白,通过RNA识别基序与RNA相互作用,在RNA剪接、成熟、定位和翻译中发挥关键作用[3]。研究表明,PTBP3的表达失调与肿瘤发生和进展有关,如乳腺癌中PTBP3的高表达能阻止ZEB1 mRNA降解来促进上皮间质转化和肿瘤进展[4]。泛素特异性蛋白酶28(ubiquitin specific peptidase 28,USP28)是去泛素化蛋白水解酶家族成员,主要表达于心脏和肌肉中,参与DNA损伤、细胞凋亡等过程的调控[5]。研究表明,USP28能够稳定促癌蛋白赖氨酸特异性组蛋白去甲基化酶1,促进乳腺癌细胞的肝细胞样特征和肿瘤恶性进展[6]。目前PTBP3、USP28在老年乳腺癌患者中的表达及临床意义尚不明确。本研究利用免疫组织化学法检测乳腺癌组织中PTBP3、USP28表达,分析两者与临床病理特征的关系及在术后复发转移中的评估价值,报道如下。
1 资料与方法
1.1 临床资料 2017年2月—2020年2月辽宁省肿瘤医院乳腺外科诊治老年乳腺癌患者178例,均为女性,年龄60~81(68.41±7.63)岁;病程6~58(12.14±6.89)d;合并高血压42例、糖尿病21例;有乳腺癌家族史4例;病理类型:浸润性癌88例,非浸润性癌90例;肿瘤分化程度:高分化40例,中分化68例,低分化70例;肿瘤TNM分期:Ⅱ期92例,Ⅲ期86例;根据病理检查中雌激素受体、孕激素受体及表皮生长因子受体2的表达情况,分为Luminal A型53例,Luminal B型50例,HER2型36例,三阴性型39例。本研究已经获得医院伦理委员会批准(201705K1),患者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①均接受乳腺癌改良根治术治疗,经术后病理组织检查明确诊断为乳腺癌;②首次诊治,术后结合放疗及化疗;③临床和病理资料完整;④年龄≥60岁。(2)排除标准:①男性患者;②合并急慢性炎性疾病或自身免疫性疾病;③合并其他恶性肿瘤;④双侧乳腺癌或肿瘤已出现远处转移。
1.3 观测指标与方法
1.3.1 组织中PTBP3、USP28表达检测:采用免疫组织化学法,试剂盒购自北京中杉金桥公司,货号 PV-9004。留取术中获取的癌和癌旁组织,分别约100 mg,以10%中性甲醛固定,石蜡包埋切片,65℃烤片2 h,二甲苯脱蜡,梯度乙醇水化,柠檬酸盐溶液中微波炉中抗原热修复10 min,3%双氧水消除内源性过氧化物酶,3%羊血清封闭2 h,加入兔抗人PTBP3单克隆抗体(稀释比为1∶200,购自赛默飞公司,货号PA5-30344),USP28单克隆抗体(稀释比为1∶100,购自Abcam公司,货号ab70893),4 ℃孵育16 h,二抗室温孵育2 h,DAB显色10 min,苏木素复染,盐酸酒精分化,自来水中返蓝。在光学显微镜(日本奥林巴斯公司,型号BX43)下观察进行半定量染色评分,染色强度(0分:无染色,1分:浅黄色,2分:棕褐色),染色面积(0分:≤25%,1分:>25%~50%,2分:>50%)。两项乘积为最终免疫组化评分,<2分判定为阴性,≥2分判定为阳性。
1.3.2 随访:所有患者以门诊复诊及电话回访方式进行随诊,随访3年,第1年每3个月随访1次,第2~3年每6个月随访1次。随访截止至2023年3月1日。记录末次随访时间,患者出现复发、转移或死亡的时间。随访终点为患者出现肿瘤复发转移或随访时间结束。
1.4 统计学方法 采用SPSS 23.0统计软件进行数据统计分析。计数资料以频数或率(%)表示,2组样本率(%)比较采用卡方检验。采用Kaplan-Meier法分析PTBP3、USP28表达对老年乳腺癌患者术后复发转移的影响;单因素及多因素Cox回归分析影响老年乳腺癌患者术后复发转移的因素。P<0.05为差异有统计学意义。
2 结 果
2.1 乳腺癌组织中PTBP3、USP28表达 乳腺癌组织中PTBP3棕褐色阳性染色主要位于细胞核;USP28棕褐色阳性染色主要位于细胞质。乳腺癌组织中PTBP3、USP28阳性率分别为65.17%(116/178)、67.42%(120/178),显著高于癌旁组织12.92%(23/178)、11.24%(20/178),差异有统计学意义(χ2/P=102.080/<0.001、117.725/<0.001)。
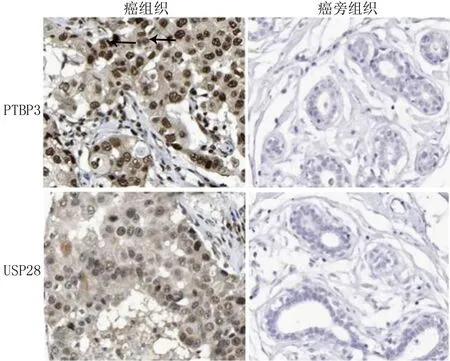
图1 乳腺癌和癌旁组织中PTBP3、USP28表达(免疫组化染色,×200)Fig.1 Expression of PTBP3 and USP28 in breast cancer and adjacent tissues (immunohistochemical staining, × 200)
2.2 乳腺癌中PTBP3、USP28表达在不同临床病理参数中的差异 乳腺癌组织中PTBP3、USP28阳性率在 TNM分期Ⅲ期、中低分化程度高于TNM分期Ⅱ期、高分化程度,差异有统计学意义(P均<0.01),见表1。
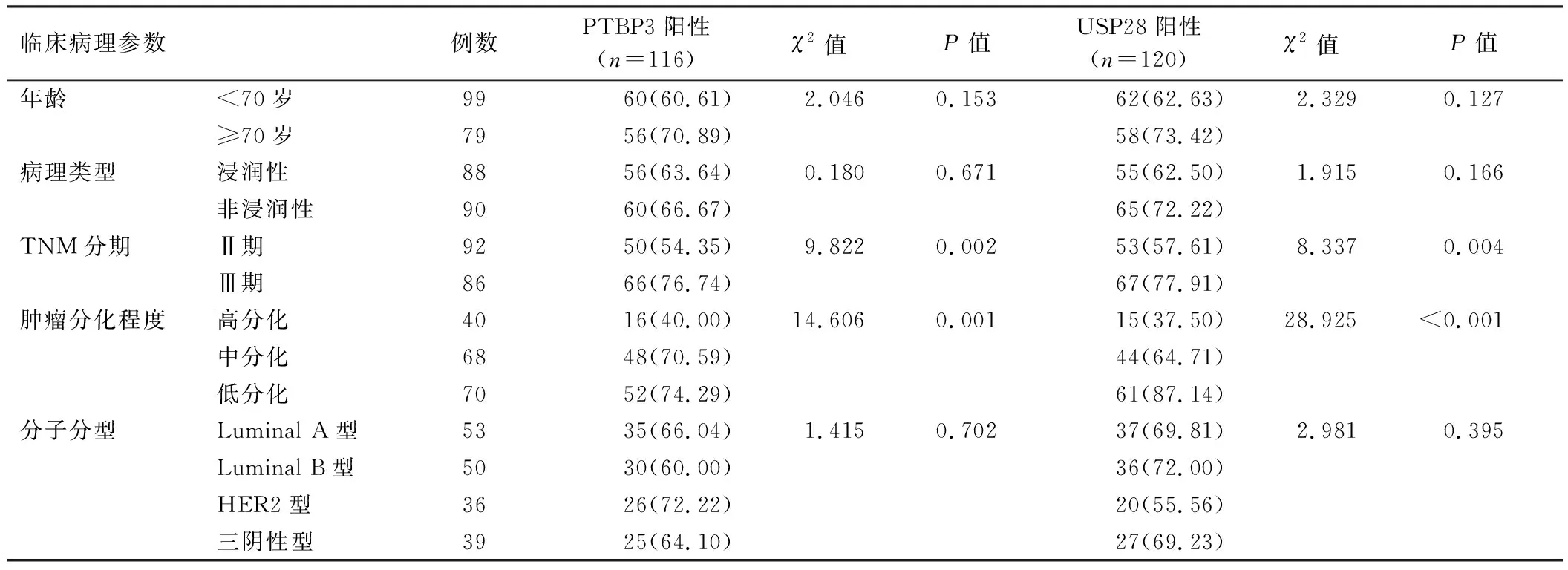
表1 乳腺癌中PTBP3、USP28表达在不同临床病理参数中的差异比较 [例(%)]Tab.1 Comparison of PTBP3 and USP28 expressions in different clinicopathological parameters in breast cancer
2.3 PTBP3、USP28表达对老年乳腺癌患者术后复发转移的影响 178例患者随访3年,失访1例,复发转移38例。3年无复发转移率为78.53%(139/177)。3年无复发转移率PTBP3阳性组为70.43%(81/115),低于阴性组的93.55%(58/62)(Log Rankχ2=12.521,P<0.001);3年无复发转移率USP28阳性组为72.27%(86/119),低于阴性组的91.38%(53/58)(Log Rankχ2=8.511,P=0.003),见图2。

图2 PTBP3、USP28表达对老年乳腺癌患者术后复发转移的影响Fig.2 Effect of PTBP3 and USP28 expression on postoperative recurrence and metastasis of elderly breast cancer patients
2.4 多因素Cox回归分析影响老年乳腺癌患者术后复发转移的因素 以老年乳腺癌患者是否发生复发转移为因变量(1=是,0=否),以上述结果中P<0.05项目为自变量进行多因素Cox回归分析,结果显示: PTBP3阳性、USP28阳性、肿瘤分期Ⅲ期、中低分化程度是影响老年乳腺癌患者术后复发转移的独立危险因素,见表2。

表2 多因素Cox回归分析影响老年乳腺癌患者术后复发转移的因素Tab.2 Multifactor Cox regression analysis of factors affecting postoperative recurrence and metastasis of elderly breast cancer patients
3 讨 论
乳腺癌是女性常见的恶性肿瘤,是全球范围内女性癌症相关死亡的首要原因[7]。手术联合辅助化疗和放疗能够有效提高乳腺癌患者生存率,但老年乳腺癌患者具有重要器官功能衰退、合并基础疾病增多及手术耐受力变差等特点,容易发生术后肿瘤复发和转移[8]。因此,寻找能够准确预测老年乳腺癌预后的指标,对于选择个体化的治疗方案,减少术后肿瘤复发转移的发生,具有重要意义。
PTBP3属于多嘧啶序列结合蛋白家族成员,其作为RNA 结合蛋白,在转录和转录后调控中发挥重要的调节作用。近年来发现,PTBP3在胃癌、胶质瘤等多种恶性肿瘤中异常表达升高[9-10],其能上调TWIST等基因的表达,促进肿瘤增殖和转移。本研究中,乳腺癌组织中PTBP3阳性表达率更高,提示PTBP3参与乳腺癌的肿瘤发生。乳腺癌中PTBP3的表达受缺氧微环境的调节。有学者报道,乳腺癌中缺氧微环境能够促进长链非编码RNA BCRT1的过度表达,其竞争性结合微小RNA-1303,阻止PTBP3 mRNA的降解,导致乳腺癌中PTBP3蛋白表达升高,PTBP3一方面促进乳腺癌肿瘤细胞的恶性增殖和侵袭,还能够通过外泌体途径,介导巨噬细胞向M2型极化,降低机体抗肿瘤的免疫杀伤作用,促进乳腺癌肿瘤细胞的免疫逃逸,导致肿瘤过度增殖[11]。本研究中,PTBP3表达与乳腺癌不良临床病理特征有关,提示PTBP3的表达参与促进乳腺癌的肿瘤进展。有研究报道,PTBP3能够通过结合ZEB1 mRNA的3’非编码区,阻止其降解,ZEB1作为转录因子,能够上调间质性标志物N-钙黏素及波形蛋白等的表达,诱导乳腺肿瘤细胞的上皮—间质转化,促进肿瘤细胞迁移、侵袭和干细胞特性形成,增强乳腺癌的增殖和转移能力,导致肿瘤TNM分期增高,降低肿瘤细胞的分化程度[12]。本研究中,PTBP3阳性老年乳腺癌患者术后复发转移率较高,表明PTBP3表达有助于评估老年乳腺癌患者预后。分析其原因,一方面是PTBP3阳性表达的肿瘤细胞侵袭和转移能力较强,肉眼难以分辨的微小转移病灶术中难以彻底切除,造成术后肿瘤复发转移,导致患者不良预后[13]。另一方面可能是PTBP3阳性表达的乳腺癌肿瘤细胞呈现干细胞特征,对紫杉醇等化疗药物的耐药性增强,老年乳腺癌患者术后辅助化疗治疗的敏感性降低。研究发现,PTBP3能够与自噬相关蛋白-12 mRNA的3’-非编码区中的多个位点结合,导致自噬相关蛋白-12的过度表达,促进细胞自噬,增加肿瘤细胞对吉西他滨等化疗药耐药性的形成[14]。因此,PTBP3可能是新的评估老年乳腺癌预后的肿瘤标志物。
USP28基因位于人类11号染色体,具有N端泛素结合结构域,能够辅助识别和招募泛素链底物,发挥去泛素水解酶的活性。研究表明,USP28在肺鳞癌、结直肠癌等恶性肿瘤中过度表达,其能够增强叉头盒C1等癌基因的蛋白稳定性,促进肿瘤有氧糖酵解,促进肿瘤增殖和转移[15-16]。本研究中,乳腺癌组织中USP28阳性表达率较癌旁组织更高,与肿瘤TNM分期、肿瘤分化程度有关,表明USP28参与乳腺癌肿瘤发生发展。乳腺癌中USP28的表达受缺氧诱导因子1α的调节。研究发现,乳腺癌缺氧环境会上调肿瘤细胞中缺氧诱导因子1α的表达,缺氧诱导因子1α能够通过激活SUMO特异性蛋白酶1,在转录水平上调USP28的表达[17]。另外,USP28作为具有肿瘤促进作用的去泛素化酶,进一步促进缺氧诱导因子-1α的去泛素化修饰,增加缺氧诱导因子-1α的稳定性,激活下游血管内皮生长因子等促癌基因表达,导致肿瘤血管新生及肿瘤转移[17]。Chen等[18]发现,肿瘤相关成纤维细胞衍生的外泌体显著促进了乳腺癌MDA-MB-231和MCF7细胞中miR-500a-5p的表达,miR-500a-5p与USP28结合协同促进肿瘤增殖。本研究中,USP28阳性老年乳腺癌患者术后复发转移风险明显增加,提示USP28是新的评估老年乳腺癌术后复发转移预后肿瘤标志物。研究表明,USP28的表达升高能够募集到DNA损伤位点,增强DNA 重组修复基因Np63的表达,降低对顺铂等化疗治疗的敏感性[19]。尚有研究证实,应用USP28特异性抑制剂能够增强p53蛋白稳定性,促进DNA损伤中p53依赖的G2/M期阻滞,增加放化疗治疗的敏感性[20]。因此,乳腺癌中USP28的表达促进肿瘤恶性进展,可能是评估老年乳腺癌患者预后的肿瘤标志物。
综上所述,老年乳腺癌组织中PTBP3、USP28表达升高,与肿瘤TNM分期、肿瘤分化程度有关,均参与老年乳腺癌的肿瘤进展。PTBP3阳性、USP28阳性是影响老年乳腺癌患者术后复发转移的独立危险因素,是新的评估老年乳腺癌患者术后复发转移的肿瘤标志物。本研究也存在局限,样本量有限,未能对不同临床特征的患者进行分层研究,有待今后设计大样本前瞻性多中心临床研究,进一步研究两者的临床价值。
利益冲突:所有作者声明无利益冲突
作者贡献声明
张小雪:设计研究方案,实施研究过程,论文撰写;刘晓婷:实施研究过程,数据收集,分析整理;李阳:课题设计,收集病例,资料整理收集,分析试验数据;于韬:论文审核,论文修改;邬晓明:进行统计学分析,资料整理收集;高岿然:提出研究思路,课题设计,论文修改

