n-3 多不饱和脂肪酸加重FFAR4 基因缺失小鼠结肠炎进程
张靖伟, 姜 旋, 朱升龙, 陈永泉*,
(1. 江南大学食品学院,江苏 无锡 214122;2. 江南大学无锡医学院,江苏 无锡 214122)
炎症性肠病(IBD)是一种慢性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)[1]。 目前除通过全结直肠切除术外,IBD还无法被治愈[2]。 IBD 的显著特征是病情反复,经治疗缓解后,仍需进行长期维持治疗[3]。 在这期间,除了利用常规药物进行缓解外,额外营养支持有利于改善患者营养状况,提高患者治疗效果[4]。
研究表明, 一些营养素如可溶性膳食纤维、维生素D、锌,可以有效缓解结肠炎的症状,并且显著降低疾病复发的风险[5]。 然而,另外一些营养素如脂肪酸,特别是n-3 多不饱和脂肪酸对IBD 的作用尚不明确[6]。 在一项为期两年的前瞻性研究中,接受了n-3 多不饱和脂肪酸补充的IBD 患者在研究起始的2~3 个月内出现了疾病的缓解, 但随后的观察结果表明n-3 多不饱和脂肪酸的补充并没有持续性地发挥缓解疾病的作用[7]。 在另一项人群研究中,IBD患者接受由3 种n-3 多不饱和脂肪酸混合的补充剂,之后的研究结果却显示接受混合补充剂的患者疾病复发率显著高于对照组患者[8]。 此外,欧洲ESPEN 炎症性肠病临床营养指南中也指出,不推荐处在疾病缓解期的IBD 患者额外补充n-3 多不饱和脂肪酸[9]。
n-3 多不饱和脂肪酸可以通过结合细胞膜表面受体来充当信号分子在体内发挥调控生理功能的作用[10]。 游离脂肪酸受体4(free fatty acid receptor 4,FFAR4)是一种n-3 多不饱和脂肪酸受体,它高表达于肠道,参与体内多种生理功能的调控,如促进胰岛素分泌、降血糖、促进肠道激素分泌和脂肪细胞分化、调节食欲和调节炎症等[11]。大量研究表明FFAR4 介导了n-3 多不饱和脂肪酸的炎症调控作用[12]。 然而人类遗传学分析发现,部分人群携带FFAR4基因R270H 突变,这种突变使FFAR4 对n-3多不饱和脂肪酸的响应出现显著下降[13]。 这些研究表明n-3 多不饱和脂肪酸对IBD 作用的不确定性,可能是部分患者携带FFAR4基因的失活突变所致。
因此,为了探明n-3 多不饱和脂肪酸在IBD 治疗中不确定结果是否与FFAR4基因的缺失有关,分别对野生型 (WT) 小鼠和FFAR4基因缺失(FFAR4KO) 小鼠进行8 周的富含n-3 多不饱和脂肪酸的鱼油灌胃,然后再进行结肠炎造模。 实验结果表明, 在同时补充n-3 多不饱和脂肪酸的情况下,相较于WT 小鼠,FFAR4KO 小鼠的结肠炎更加严重。
1 材料与方法
1.1 材料与试剂
鱼油 (含质量分数70% EPA、 质量分数10%DHA):四川德阳华太生物医药有限责任公司;肠炎级葡聚糖硫酸钠(DSS):MP Biomedicals 公司;粪便隐血试剂盒、MPO 活性检测试剂盒: 南京建成生物工程研究所有限公司;苏木精-伊红染色液:南昌雨露实验器材有限公司;阿利新蓝-核固红染色液:生工生物工程(上海) 股份有限公司;RNA 提取试剂盒、SYBR Green mix:翌圣生物科技(上海)股份有限公司;反转录试剂盒:南京诺唯赞生物科技股份有限公司。
WT 与FFAR4KO 健康雄性SPF 级别C57BL/6J小鼠在江南大学无锡医学院实验动物中心进行繁育 ( 动物实验伦理审查编号为 JN No.20171030c0110506)。 饲养温度20~26 ℃,相对湿度40%~70%;光照早上8 点开启,晚上8 点关闭;常规分笼饲养,自由饮水进食。
1.2 实验设备
徕卡病理切片机:徕卡显微系统(上海)贸易有限公司;赛默飞Multiskan Go 酶标仪:赛默飞世尔科技(中国)有限公司;eppendorf 低温高速离心机:艾本德(上海)国际贸易有限公司;PCR 仪:伯乐生命医学产品(上海)有限公司;实时定量PCR(qPCR)仪:罗氏诊断产品(上海)有限公司。
1.3 实验方法
1.3.1 动物分组及造模实验采用10 周龄小鼠,分别将8 只WT 小鼠和FFAR4KO 小鼠分笼, 每4只一笼。对每只小鼠进行每2 d 一次的鱼油灌胃,每只灌胃量为200 μL,持续8 周。待灌胃结束,用小鼠饮用水将DSS 配制成质量浓度为2.5 g/dL 的溶液,让小鼠自由饮用。 造模第1 天,记录小鼠各项数据,并进行DSS 造模,每2 d 进行DSS 溶液更换,持续造模至第7 天,第8 天进行小鼠各项数据记录。 同时在DSS 造模期间,继续对小鼠进行鱼油灌胃。
1.3.2 数据记录和组织样本制备在DSS 造模期间,每日记录小鼠体质量、小鼠便血情况和粪便性状。 用疾病活动指数(DAI)对小鼠结肠炎疾病程度进行评分, 评分参照Murthy 等的评分系统[14],DAI为小鼠体质量变化分数、便血分数和大便性状分数之和。 待造模结束,乙醚麻醉小鼠后用断颈法处死小鼠,取出小鼠结肠和脾脏,量取结肠长度,称取脾脏质量。 将远端结肠分为3 份,分别用于检测MPO活性、炎症因子mRNA 水平和病理切片。
1.3.3 结肠MPO 活性检测结肠MPO 活性检测按照试剂盒说明书进行操作。
1.3.4 炎症因子mRNA 的检测按照RNA 提取试剂盒说明书进行小鼠结肠RNA 提取, 再根据反转录试剂盒说明书进行mRNA 反转录获得cDNA。 采用实时定量PCR (qPCR) 检测小鼠结肠炎症因子mRNA 水平,PCR 程序如下:95 ℃变性5 min,95 ℃变性30 s,59 ℃退火30 s,30 s 的变性和退火进行40 个循环。 引物序列如表1 所示。

表1 引物序列Table 1 Sequence of primers
1.3.5 结肠组织病理切片观察和HE 染色将小鼠结肠浸入质量分数4%多聚甲醛溶液中36~48 h 进行固定。 然后, 将结肠组织依次经体积分数70%、80%、90%乙醇溶液脱水(各30 min),再依次放入体积分数95%、100%乙醇溶液中脱水2 次,每次20 min。脱水结束后,将结肠组织浸入二甲苯中2 次,每次15 min。 透明结束后,将结肠组织浸入60 ℃石蜡中2 次,每次60 min。 浸蜡结束后,用徕卡病理切片机进行组织切片。 HE 染色前,将切片于60 ℃烘烤30 min。 待烤片结束,切片经2 次二甲苯脱蜡(各5 min), 然后依次放入体积分数100%、95%、90%、80%、70%乙醇溶液中(各3~5 min),再放入水中3 min。 切片脱蜡复水结束,将切片放入苏木精染色液中20 s,后放入自来水中返蓝30 min。 待返蓝结束,将切片放入体积分数1%盐酸乙醇溶液中分化5 s,洗去过多的颜色,将切片用自来水返蓝30 min,然后将切片依次快速浸入伊红染色液、 体积分数95%乙醇Ⅰ和Ⅱ、 体积分数70%乙醇中, 并快速拿出,然后浸入体积分数80%乙醇中50 s、无水乙醇中2 min。 最后将切片浸入二甲苯中2 次(各3 min),进行封片。 阿利新蓝染色步骤根据试剂说明书进行操作。 将HE 染色切片放于显微镜下进行观察组织损伤程度,采用Dieleman 等的评分系统[15]对结肠组织切片进行组织损伤评分。
1.3.6 统计分析数据采用SPSS 22.0 统计软件处理,结果采用平均值±标准方差表示,组间比较采用LSD 法T检验(*为P<0.05,** 为P<0.01,*** 为P<0.001)。
2 结果与分析
2.1 n-3 多不饱和脂肪酸对FFAR4KO 小鼠体质量的影响
由于肠道存在炎症等情况,活动期结肠炎小鼠的体质量会逐步减轻。 小鼠接受DSS 饮水后,膳食中添加n-3 多不饱和脂肪酸并每日对小鼠体质量进行记录。如图1 所示,观察到造模的前7 d 中,WT小鼠和FFAR4KO 小鼠的体质量之间并未出现显著差异,但该段时间内,相比WT 小鼠,FFAR4KO 小鼠的平均丢失体质量更大。 在造模的第7 天,FFAR4KO 小鼠体质量相较于造模第1 天, 出现了明显下降。 在造模的第8 天,两组小鼠体质量间出现了显著的差异,FFAR4KO 小鼠体质量显著低于WT 小鼠。
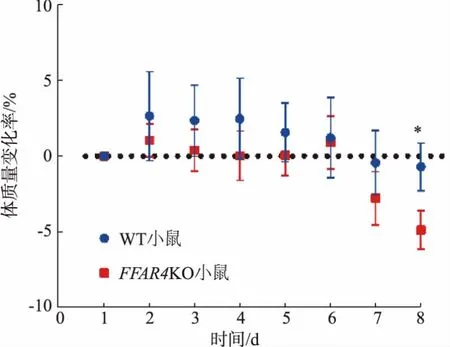
图1 膳食中n-3 多不饱和脂肪酸对FFAR4KO 小鼠体质量变化的影响Fig. 1 Effects of dietary n-3 polyunsaturated fatty acids on body weight of FFAR4KO mice
2.2 n-3 多不饱和脂肪酸对FFAR4KO 小鼠DAI的影响
在活动期结肠炎期间, 小鼠出现体质量减轻、便稀、便血等表现,通过DAI 综合上述指标,评估小鼠在结肠炎造模期间疾病程度,DAI 越大,小鼠疾病程度越厉害。 观察到在造模的第5 天,FFAR4KO 小鼠普遍出现了肉眼可见血便, 并在随后的几天内,迅速出现稀便。 而同时间的WT 小鼠在第5 天偶有肉眼可见血便, 且在随后的几天内病情发展缓慢。如图2 所示,造模的第6 天,两组小鼠DAI 出现了显著的差异,FFAR4KO 小鼠的DAI 开始迅速上升。此结果从疾病症状方面表明,在同时补充n-3 多不饱和脂肪酸的情况下,相较WT 小鼠,FFAR4KO 小鼠在结肠炎期间表现为更严重的疾病程度。
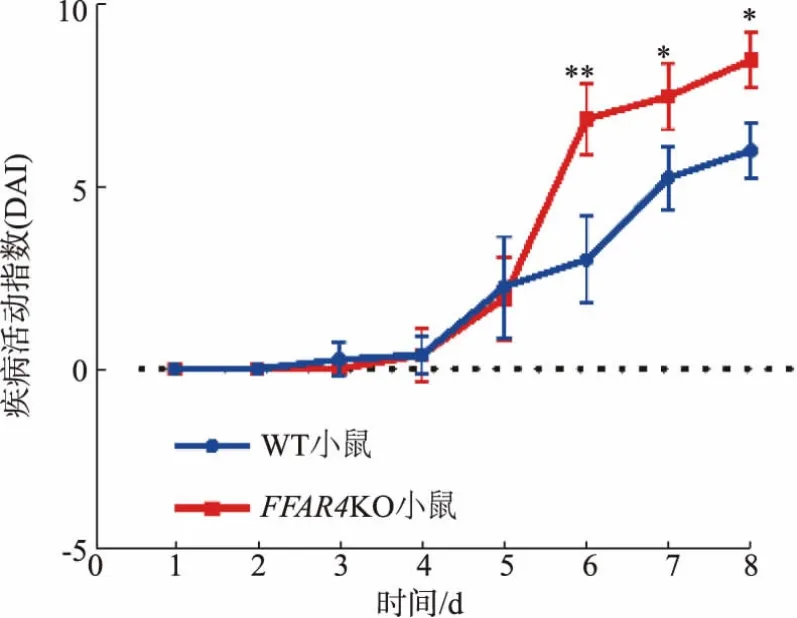
图2 膳食中n-3 多不饱和脂肪酸对FFAR4KO 小鼠DAI的影响Fig. 2 Effects of dietary n-3 polyunsaturated fatty acids on DAI of FFAR4KO mice
2.3 n-3 多不饱和脂肪酸对FFAR4KO 小鼠结肠长度的影响
小鼠肠道经DSS 造模以后会出现溃疡等肠道损伤现象, 严重时会造成小鼠结肠长度的缩短。FFAR4KO 小鼠在同时接受DSS 刺激和n-3 多不饱和脂肪酸灌胃后, 其肠道长度在5.0~6.3 cm, 相较WT 小鼠,出现了结肠长度显著的缩短(见图3)。 此结果表明,在同时补充n-3 多不饱和脂肪酸的情况下,相较WT 小鼠,FFAR4KO 小鼠在结肠炎期间肠道存在更严重的损伤。
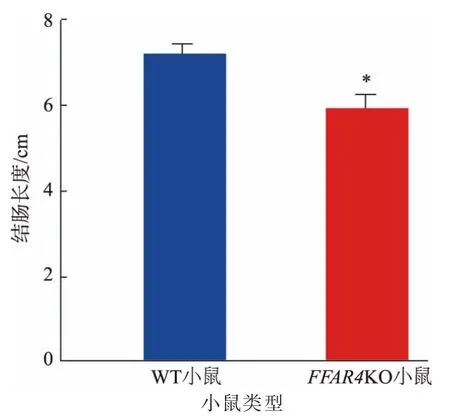
图3 膳食中n-3 多不饱和脂肪酸对FFAR4KO 小鼠结肠长度的影响Fig. 3 Effects of dietary n-3 polyunsaturated fatty acids on colon length of FFAR4KO mice
2.4 n-3 多不饱和脂肪酸对FFAR4KO 小鼠脾脏质量的影响
结肠炎诱发体内免疫反应,由此造成的一种肠外表现为脾脏质量增大。FFAR4KO 小鼠在同时接受DSS 刺激和n-3 多不饱和脂肪酸灌胃后,其脾脏质量在0.19~0.25 g,与WT 小鼠相比,质量显著增加(见图4)。此结果表明,在同时补充n-3 多不饱和脂肪酸的情况下,相较WT 小鼠,FFAR4KO 小鼠在结肠炎期间,体内存在更严重的免疫反应。
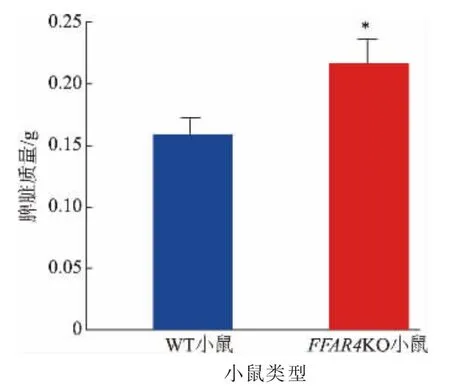
图4 膳食中n-3 多不饱和脂肪酸对FFAR4KO 小鼠脾脏质量的影响Fig. 4 Effects of dietary n-3 polyunsaturated fatty acids on spleen weight of FFAR4KO mice
2.5 n-3 多不饱和脂肪酸对FFAR4KO 小鼠结肠MPO 活性的影响
MPO 富含于中性粒细胞中,炎症过程中,粒细胞进入炎症部位并且聚集。 肠道MPO 活性可以表征炎症的疾病程度。 如图5 所示,FFAR4KO 小鼠结肠MPO 活性出现了显著上升。 此结果表明,在同时补充n-3 多不饱和脂肪酸的情况下, 相较WT 小鼠,FFAR4KO 小鼠在结肠炎期间,其肠道内存在更严重的免疫反应。
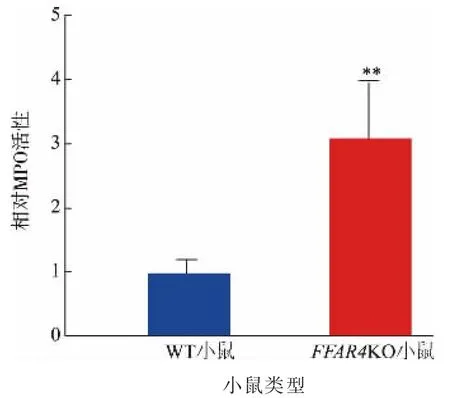
图5 膳食中n-3 多不饱和脂肪酸对FFAR4KO 小鼠结肠MPO 活性的影响Fig. 5 Effects of dietary n-3 polyunsaturated fatty acidson the colonic MPO activity of FFAR4KO mice
2.6 n-3 多不饱和脂肪酸对FFAR4KO 小鼠结肠炎症因子mRNA 水平的影响
结肠炎病程中产生的许多细胞因子可以作为炎症程度的评判指标。 如图6 所示,经qPCR 检测,FFAR4KO 小鼠结肠中炎症因子IL-1β、IL-6、TNF-α和ICAM-1 的基因表达水平出现了显著上升,而两组间IL-10 的基因表达水平并未有显著差异。 此结果从分子水平上表明,在同时补充n-3 多不饱和脂肪酸的情况下, 相较WT 小鼠,FFAR4KO 小鼠在结肠炎期间,其肠道内存在更严重的免疫反应。
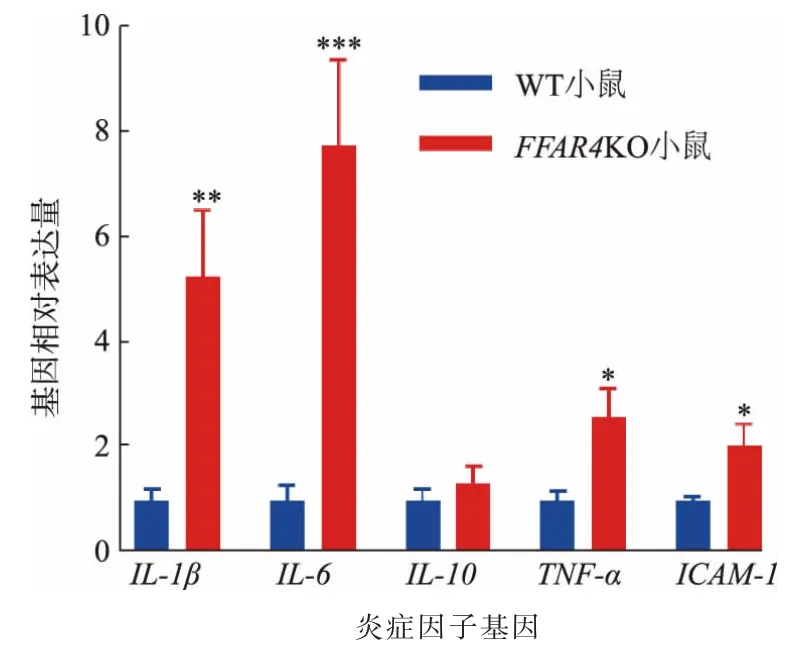
图6 膳食中n-3 多不饱和脂肪酸对FFAR4KO 小鼠结肠炎症因子mRNA 水平的影响Fig. 6 Effects of dietary n-3 polyunsaturated fatty acids on mRNA levels of colonic inflammatory factors of FFAR4KO mice
2.7 小鼠肠道病理切片观察及评分
如图7 所示,HE 染色切片可以看出,WT 小鼠结肠黏膜层出现了部分炎症细胞浸润的情况,隐窝和腺体结构的完整性和排列较为正常。 而FFAR4KO 小鼠的肠道黏膜层破坏较为严重, 具体表现为隐窝和腺体结构破坏严重,取而代替的是大量炎症细胞浸润。 AB 染色(阿利新蓝-核固红染色)可以将肠道腺体细胞中的黏液染成蓝色,其余细胞和细胞质染成红色。 在AB 染色下可以更清楚地观察到,相较WT 小鼠,FFAR4KO 小鼠的肠道腺体结构破坏更严重。对HE 染色切片进行评分,根据结果可以看出FFAR4KO 小鼠的结肠切片评分更高。 此结果表明,在同时补充n-3 多不饱和脂肪酸的情况下, 相较WT 小鼠,FFAR4KO 小鼠在结肠炎期间,其肠道内存在更严重的黏膜损伤和炎症细胞浸润现象。
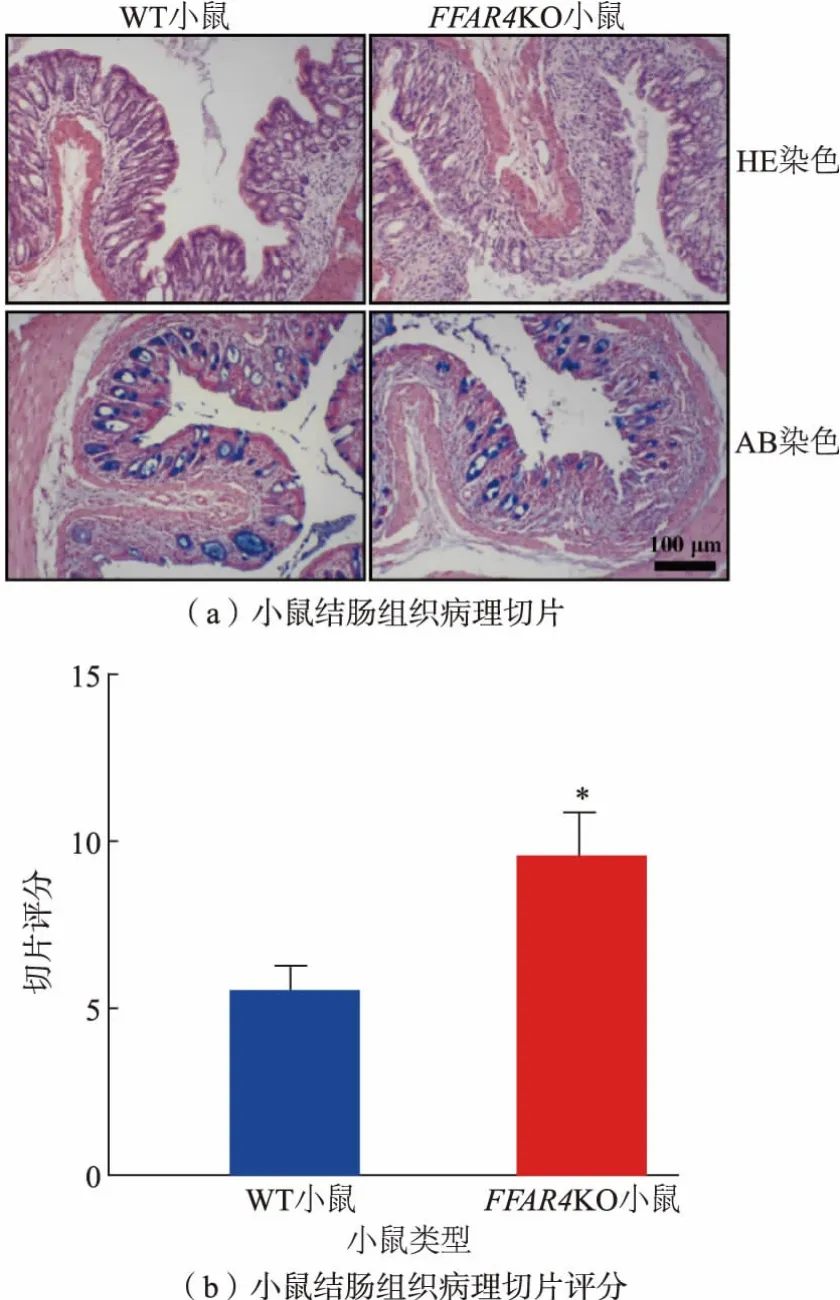
图7 小鼠结肠组织病理切片和评分Fig. 7 Histopathological sections and scores of mice colon
3 结 语
大量临床研究表明,n-3 多不饱和脂肪酸具有出色的抗炎作用,在代谢性疾病、心血管类疾病的辅助治疗中得到了合理的应用[16]。 营养干预是IBD治疗过程中的一个重要环节, 但目前在临床中,并不推荐IBD 患者额外补充n-3 多不饱和脂肪酸[9],其原因并未见报道。 本文中,作者利用WT 小鼠和FFAR4KO 小鼠初步研究了在FFAR4基因存在与否的情况下n-3 多不饱和脂肪酸补充对结肠炎进程的影响。 实验结果表明,相较于WT 小鼠,在结肠炎造模的同时,应用富含n-3 多不饱和脂肪酸的鱼油灌胃FFAR4KO 小鼠,会造成更为严重的结肠炎。经过n-3 多不饱和脂肪酸干预的FFAR4KO 小鼠表现出更早的体质量丢失, 更高的DAI。 此外FFAR4KO 小鼠的结肠长度显著小于WT 小鼠,脾脏质量显著大于WT 小鼠。 小鼠结肠生化指标和分子指标检测结果也表明FFAR4KO 小鼠结肠表现出更为严重的炎症。 观察小鼠结肠组织病理切片可以发现,FFAR4KO 小鼠结肠黏膜中出现更多的炎症细胞浸润,隐窝和腺体结构完整更差,破坏更为严重,具有更高的切片评分。
FFAR4 是一种长链多不饱和脂肪酸受体,属于G 蛋白偶联受体家族成员,它在肠道高表达[17]。大量的研究表明,FFAR4 在体内具有维持代谢稳态和抑制炎症的作用[18]。 Oh 等首先发现FFAR4 可以作为一种n-3 多不饱和脂肪酸受体来调控体内代谢稳态和炎症[4]。 当用n-3 多不饱和脂肪酸或者FFAR4的合成激动剂刺激小鼠巨噬细胞RAW264.7 后,细胞会表现出抗炎的M2 表型,但将FFAR4基因沉默后,n-3 多不饱和脂肪酸或FFAR4 的激动剂就不能表现出抗炎的表型。Ichimura 等进一步发现,相较于WT 小鼠,FFAR4KO 小鼠更容易表现出肥胖和高血糖的表型,当用高脂饮食饲喂小鼠时,这种差异更加明显,FFAR4KO 小鼠极易发展出肥胖和Ⅰ型糖尿病的表型[13]。更重要的是,研究者还发现在肥胖人群中存在着FFAR4基因的R270H 突变, 此突变大大增加了这类人群的肥胖发生风险。 鉴于此,作者猜测部分IBD 患者人群中可能同样存在FFAR4的突变,补充n-3 多不饱和脂肪酸无益于这类患者的疾病缓解。 在此实验中,作者证明了相较于WT 小鼠, 额外补充n-3 多不饱和脂肪酸的FFAR4KO 小鼠会发展成为更严重的结肠炎。 同时此结果也表明,n-3 多不饱和脂肪酸可以通过FFAR4 起到缓解结肠炎的作用。 然而,n-3 多不饱和脂肪酸介入FFAR4KO 小鼠结肠炎的具体机制仍需进一步探究。
综上所述,相较WT 小鼠,额外补充n-3 多不饱和脂肪酸会加重FFAR4KO 小鼠结肠炎。 此结果对n-3 多不饱和脂肪酸施用在临床试验当中的结果给出了一种可能的解释, 并且此结果对未来IBD精细化营养干预提供了一定的参考依据。

