表面偶极离子亲水磁珠固定化异柠檬酸裂解酶及其表征
段昌园, 姜 雪, 曾宏威, 杨晓兰
(重庆医科大学检验医学院,重庆 400016)
目前,结核病的发病率虽已下降,但日益增加的耐药菌,尤其是多药耐药(MDR)和超级耐药(XDR)结核分枝杆菌,给结核病治疗带来了巨大的挑战[1]。 另外,结核分枝杆菌被巨噬细胞吞噬后,可在巨噬细胞内乏氧和碳源缺乏下进入生长静止的休眠状态,在宿主免疫力低下时大量生长,成为继发性结核的潜在来源。 而现有抗结核药物对休眠期结核分枝杆菌无作用。
异柠檬酸裂解酶(isocitrate lyase,ICL)是乙醛酸循环的关键限速酶[2],也参与了甲基柠檬酸循环。 乙醛酸循环和甲基柠檬酸循环对以脂肪酸或胆固醇为首选碳源的休眠期结核分枝杆菌的存活至关重要[3-4],而ICL 催化的乙醛酸循环在宿主细胞中并不存在[5-6]。 有研究表明,MtICL 在乏氧环境的结核分枝杆菌中高表达[7];敲除MtICL 基因的结核分枝杆菌持留性和毒力降低[8]。 因此,MtICL 是清除休眠期结核分枝杆菌的理想药物靶点[3]。 早期的ICL 抑制剂结构类似于底物异柠檬酸或产物琥珀酸和乙醛酸,包括衣康酸(itaconic acid,IA)[9]、3-溴丙酮酸(3-bromopyruvic acid,3-BP)[10]、3-硝基丙酸(3-nitropropionic acid,3-NP)[11]。 目前仍未有针对ICL抑制剂类药物进入临床[12]。 以MtICL 为靶点的化合物库[13-14]和天然产物库[15]通过高通量筛选获得潜在抑制剂,但抑菌作用不理想;对465 种中药提取物筛选获得针对MtICL 的IC50低于0.05 mg/mL 的两种提取物,但其实际活性成分未知。 故针对天然产物中MtICL 抑制剂结构的发现具有重要意义,但急需有效可靠的方法。
天然产物中活性成分往往含量很低,现有混合物筛选方法包括亲和层析、配体捕获、亲和电泳、磁分离筛选,以及荧光偏振和表面等离子共振等[16-18],但对于筛选天然产物中微量活性成分的作用有限[19]。固定化酶具有稳定性强、重复性好、易于分离等特点,已广泛应用于天然产物的抑制剂筛选[20-22]。 作者所在课题组前期建立的基于磁珠固定靶蛋白亲和迭代筛选方法[23-24],可望发现复杂混合物中极低含量的有效成分,已初步成功应用于组合合成小库的高亲和力配体发现。 为探索适用于亲和富集筛选的磁珠固定化MtICL 靶酶,本研究中选用的两种亲水磁珠MSP-NTA(Ni2+-NTA 磁珠)和MSP-COOH-F1(羧基磁珠),其表面含大量两性基团,具有亲水性,对疏水小分子和蛋白质的非特异结合均较低(见图1)[25],比较两种磁珠固定化MtICL 并优化,以期获得迭代筛选所需固定化MtICL, 为最终实现天然产物中MtICL 抑制剂的发现打下基础。

图1 磁珠固载蛋白质示意图Fig. 1 Diagram of immobilization of protein on magnetic beads
1 材料与方法
1.1 材料与试剂
重组质粒6×His-pET28a-ICL委托中美泰和生物技术有限公司构建;大肠杆菌E.coliBL21(DE3)、硫酸卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)、咪唑、2-吗啉乙磺酸(MES)、三羟甲基氨基甲烷(Tris):北京鼎国昌盛生物技术有限公司;磷酸二氢钠、磷酸氢二钠:重庆泽恒生物科技有限公司;镍离子琼脂糖凝胶层析介质:GE Healthcare 公司;NADH:北京索莱宝科技有限公司;异柠檬酸:Acros公司;LDH:Sigma 公司;3-吗啉丙磺酸(MOPS)、IA:Adamas-beta 公司;羧基磁珠(MSP-COOH-F1)、Ni2+-NTA 磁珠(MSP-NTA):重庆博蓝鹰生物技术有限公司;N-羟基琥珀酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC):上海麦克林生化科技有限公司。
1.2 实验方法
1.2.1 重组蛋白质的表达纯化将携带目的基因的重组质粒6×His-pET28a-ICL转入至感受态细胞E.coliBL21(DE3)中培养,单克隆测序鉴定。 蛋白质表达纯化方案参考文献[26]。 镍离子琼脂糖凝胶层析柱纯化重组蛋白质。 洗杂液为含有10、40 mmol/L的咪唑缓冲液,洗脱液为含500 mmol/L 的咪唑缓冲液。 用1 mol/L Tris-HCl 缓冲液(pH 7.4),通过Millipore氮气正压(0.15~0.20 MPa) 超滤浓缩洗脱3 次至5 mL 左右。 纯化产物用Bradford 法测定蛋白质质量浓度,120 g/L SDS-PAGE 分析蛋白质纯度。
1.2.2 重组蛋白质的酶学性质表征
1)酶活力测定 参考文献[26]并适当修改。300 μL 的反应体系中含有50 mmol/L 的MOPS 缓冲液 (含5 mmol/L MgCl2、5 mmol/LL-半胱氨酸、1 mmol/L EDTA,pH 6.8)、2 mmol/L 的异柠檬酸和一定量的纯化重组蛋白质, 混匀后于37 ℃孵育20 min,添加2 U LDH 和0.2 mmol/L 的NADH,混匀后在室温于340 nm 波长下间隔10 s 监测3 min 内的吸光度减少值。 底物NADH 的消光系数为6.22 L/(mmol·cm),按照以下公式计算酶活力[2]。
式中:Ea为酶活力,U/mL;△A为吸光度的减少值;t为反应时间,min;ε 为NADH 的消光系数,L/(mmol·cm);L为比色皿光径, 本文中为1 cm;VT为反应总体积,mL;V为测定时样品所用体积,mL;D为样品稀释倍数。
2)最适pH 测定 配制pH 4.0~10.0 的MOPS缓冲液,测定酶活力,并以吸光度的改变速率v表征酶活力。 以pH 和改变速率v作图,得出最适pH,为后续的磁珠固定和混合物筛选提供最适反应pH。
式中:v为吸光度改变速率,min-1;△A为吸光度减少值;t为反应时间,min。
3)重组蛋白质质量浓度与活性关系 于300 μL的酶反应体系中加入不同终质量浓度的重组蛋白质(0.004~0.040 g/L),以改变速率v和重组蛋白质质量浓度作图,获得线性范围。
4)米氏常数测定 改变底物异柠檬酸终浓度(0.1~1.0 mmol/L),分别测定MtICL 酶活力。 以改变速率v的倒数1/v和底物浓度S的倒数1/S作图,确定MtICL 对底物异柠檬酸的表观Km。
5)游离酶对抑制剂3-BP 的响应 配制0~20 mmol/L 的3-BP 母液。 在300 μL 的反应体系中,加入10 μL 的3-BP 和适量游离酶,37 ℃孵育10 min后加入底物再次孵育20 min, 后续步骤同1.2.2 中的酶活力测定。以3-BP 对MtICL 的抑制率和3-BP的终浓度对数值作图,用软件Origin 2018 拟合抑制率与3-BP 终浓度对数值响应曲线,并计算3-BP 对游离酶的IC50。
1.2.3 重组蛋白质MSP-NTA 固定及表征取MSP-NTA 悬液(100 g/L),磁力去上清液,用固定缓冲液 (20 mmol/L Tris-HCl,pH 7.4) 洗涤3 次后重悬至7 g/L。将不同质量重组蛋白质用固定缓冲液重悬至40 μL,缓慢滴入10 μL 的磁珠悬液,加完后立即温和混匀以免团聚; 于冰上以200 r/min 速率固定30 min,期间每隔8~10 min 颠倒混匀一次;磁分离保留上清液,磁珠用固定缓冲液洗涤3 次后再次重悬至7 g/L,冰上保存备用。 重组蛋白质加入质量与上清液中重组蛋白质质量相减可得磁珠固载量(n=3),并通过最高固载量求得磁珠表观固载量。
式中:C为MSP-NTA 的表观固载量;m1为最高固载量,mg;m0为磁珠加入量,g。
1)MSP-NTA 固定化酶酶活力表征 300 μL 反应体系中加入70 μg 磁珠固定化酶,与底物在37 ℃孵育20 min,磁分离取上清液测酶活力,根据实际固定化酶量求得磁珠固定化酶表观保留比活,同时与未加磁珠的等量游离酶比活相比求得磁珠固定化酶的相对表观保留比活。
2)金属离子对游离酶酶活力的影响 100 μL的酶反应缓冲液中加入不同终浓度的Ni2+、Fe3+(0~20 nmol/L)和一定量的MtICL,于冰水浴中混合振摇30 min 后,取1/10 加入300 μL 的酶反应体系中,后续步骤同1.2.2 中的酶活力测定。
1.2.4 重组蛋白质MSP-COOH-F1固定及表征取MSP-COOH-F1 悬液(20 g/L), 用pH 6.0 的20 mmol/L 的MES 缓冲液洗涤3 次,磁力去上清液,加入EDC、NHS(25 g/L,溶于pH 6.0 的20 mmol/L 的MES 缓冲液)各100 μL,室温持续混合振摇30 min。 磁力去上清液,加入预冷至0 ℃的pH 7.4、20 mmol/L 的MES 缓冲液重悬至6 g/L。重组蛋白质用pH 7.4、20 mmol/L 的MES 缓冲液重悬至100 μL,振荡的情况下将100 μL 磁珠悬液缓慢滴入重组蛋白质溶液中,冰上混合反应30 min。 磁分离保留上清液,磁珠用pH 7.4、20 mmol/L 的MES 缓冲液洗涤3 次并重悬至12 g/L,0 ℃保存备用。 固载量及表观保留比活测定同1.2.3,并与MSP-NTA 的固载量和表观保留比活比较。
重组蛋白质MSP-COOH-F1 固定化前后对抑制剂IA 的响应:300 μL 的反应体系中,加入不同终浓度的IA(10.0~170.0 μmol/L)和适量磁珠固定化酶或游离酶,37 ℃孵育10 min, 后续步骤包括数据处理同1.2.2 中的游离酶对3-BP 抑制剂的响应。
1.2.5 游离MtICL 和磁珠固定化MtICL 的稳定性将游离酶用MOPS 缓冲液稀释10 倍, 两种磁珠固定化酶分别于25 ℃室温和0 ℃冰水浴中静置保存,每隔一段时间测其吸光度改变速率v,以改变速率v和时间作图,考察游离酶和两种磁珠固定化酶在不同温度下的稳定性。
1.3 数据处理
每个实验重复3 次,使用软件Origin 2018 处理数据,结果以平均值±标准差表示。 统计学分析采用软件SPSS 25.0,固定化酶前后的IC50采用配对样本T检验分析,P<0.05 为具有统计学差异。
2 结果与分析
2.1 重组蛋白质的表达和纯化
重组质粒6×His-pET28a-ICL转化后单克隆菌经测序比对发现, 与GenBank 中结核分枝杆菌(H37Rv)碱基序列Rv0467 一致,对应氨基酸序列同源性达100%。MtICL 表达纯化后,在相对分子质量50 000 处有一条明显的目标蛋白质条带 (见图2),纯度较高,满足磁珠固定化要求。 纯化蛋白质总收率约为50 mg/L(以LB 培养基体积计)。
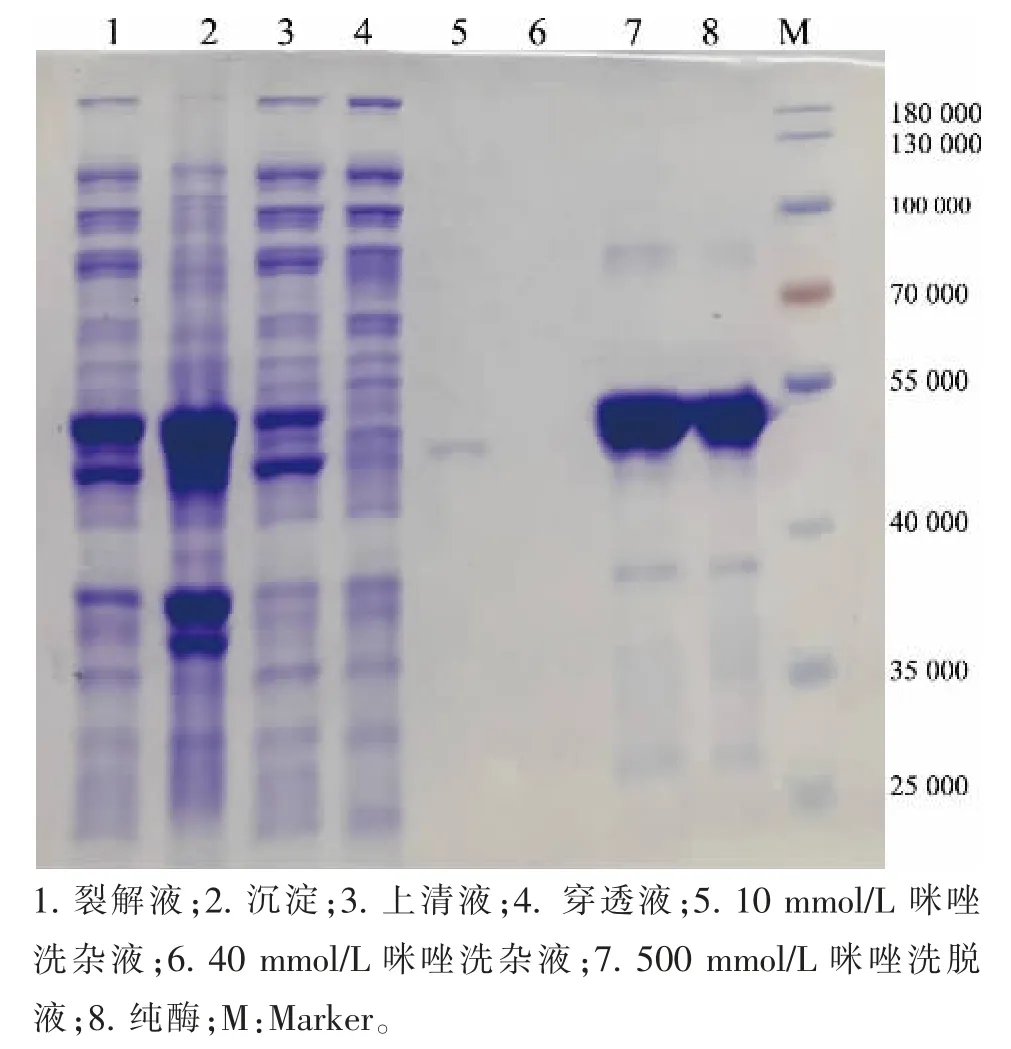
图2 MtICL 的表达Fig. 2 Expression of MtICL
2.2 重组蛋白质的酶学性质表征
异柠檬酸裂解酶可催化异柠檬酸生成琥珀酸和乙醛酸,而乙醛酸在LDH 和NADH 的作用下,还原生成甘醇酸酯, 通过实时监测NADH 在340 nm处吸光度(A)的减少,取线性范围内吸光度变化速率,按底物(NADH)消光系数确定酶活力。按照方法1.2.2 中测定MtICL 酶活力,并计算MtICL 的比活为(350.0±10.0) mmol/(min·g)。
MtICL 在pH 4.0~10.0 的MOPS 缓冲液中测定其最适pH(见图3),发现其在pH 7.4 时活性最高(以吸光度的改变速率v来间接表征酶活力的变化趋势)。 故后续磁珠固定和混合物筛选缓冲液采用pH 7.4。
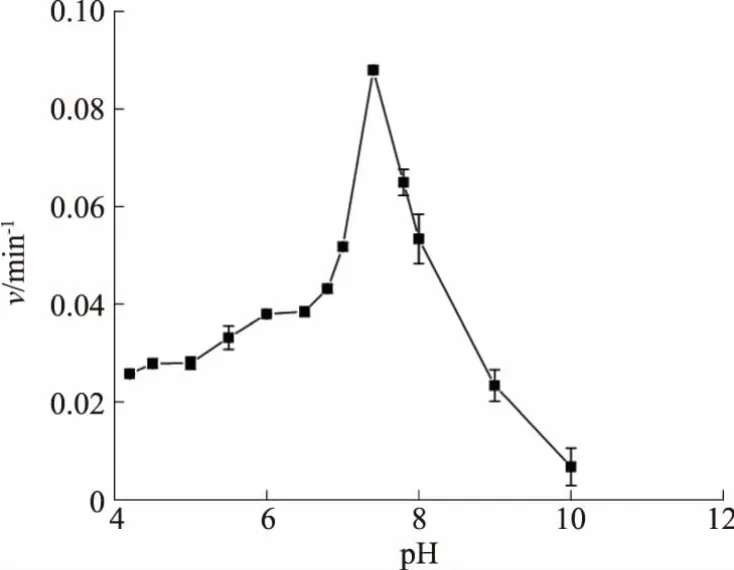
图3 MtICL 酶活力的pH 效应Fig. 3 Effect of pH on enzymatic activity of MtICL
在一定酶质量浓度范围内,测得的酶改变速率与加入的酶质量浓度成正比,在0.004~0.040 g/L 呈线性响应(见图4)。 根据双倒数作图法求得底物异柠檬酸的表观Km为(0.56±0.02) mmol/L(见图5)。
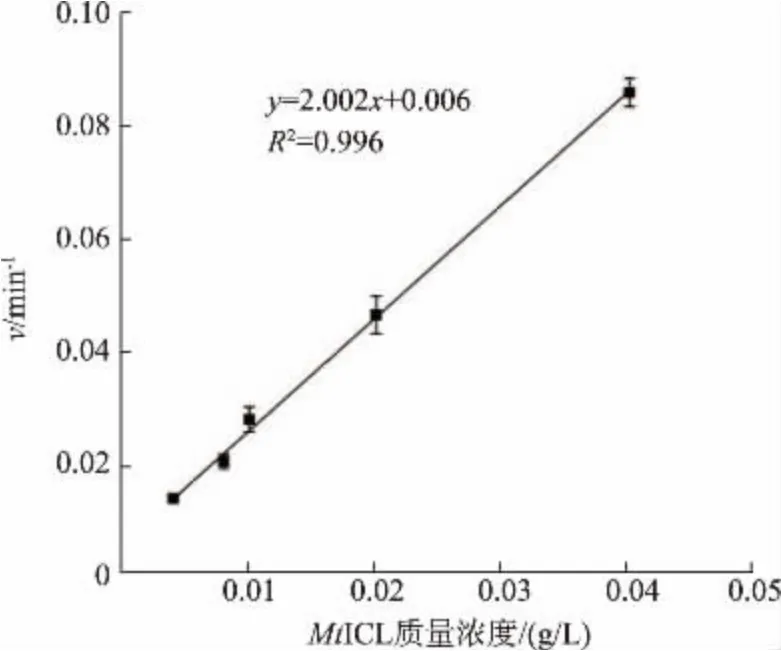
图4 MtICL 改变速率对酶质量浓度响应Fig. 4 Response of reaction rate to concentration of MtICL
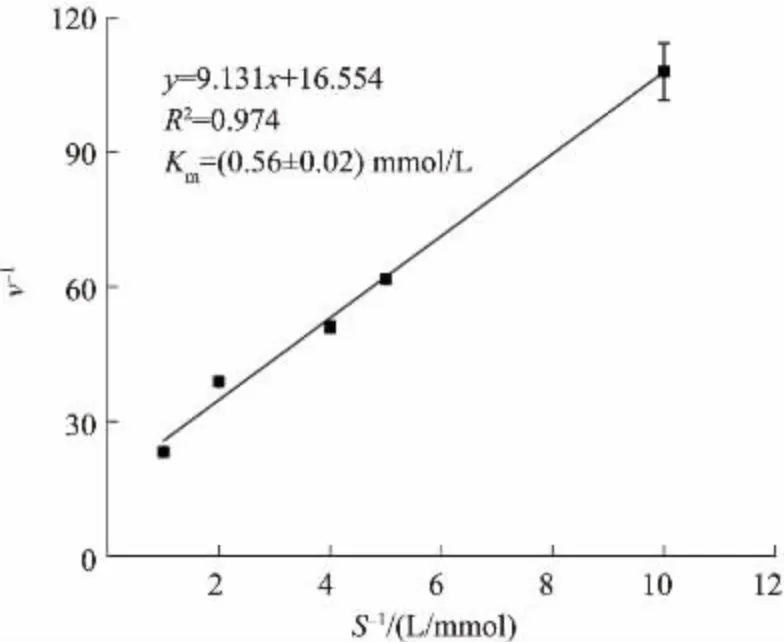
图5 MtICL 对异柠檬酸的表观KmFig. 5 Apparent Km of MtICL to isocitrate
2.3 MSP-NTA 固定MtICL 及表征
MSP-NTA 加入量为70 μg,当重组蛋白质加入量从5 μg 增加到35 μg 时,固载量逐步增加并达到平衡(见图6)。在重组蛋白质加入量为25 μg 时,固载量达到饱和,最高固载量约为9.3 μg,由此可得MSP-NTA 磁珠表观固载量为(132.8±3.9) mg/g(以磁珠质量计,n=3)。 固定化酶的相对表观保留比活在重组蛋白质加入量为5~20 μg 时仅约20%,当重组蛋白质加入量增加到25 μg 时, 酶活力显著下降。 在重组蛋白质加入量为10 μg 时达到最高表观保留比活,为游离酶的23%,此时的表观固载量为(40.4±1.7) mg/g(以磁珠质量计,n=3)。 可见,MSPNTA 的固载量较高,但是酶活力保留却很低,可能是磁珠悬液中游离的金属离子Ni2+、Fe3+对酶活力产生影响。
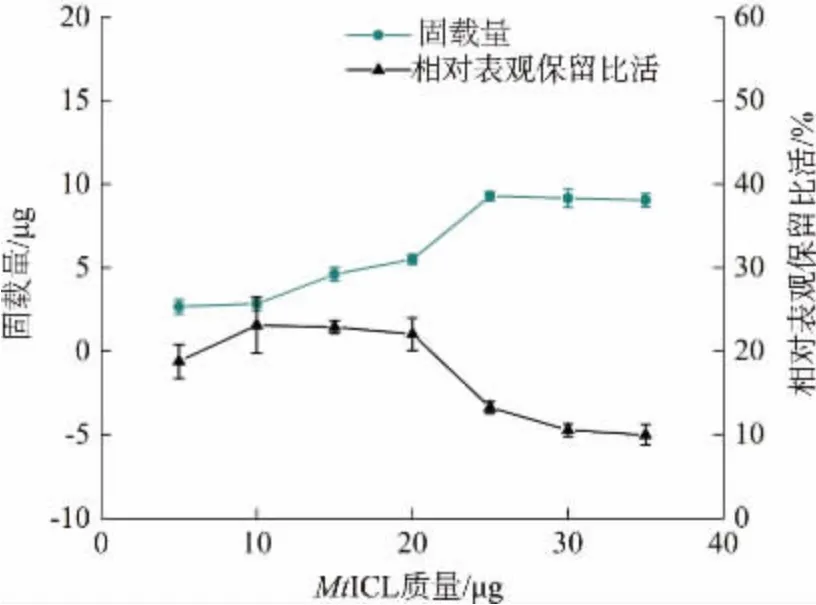
图6 MSP-NTA 固定MtICL 的固载量和相对表观保留比活Fig. 6 Immobilization quantity and relative apparent retention specific activity of MtICL on MSP-NTA
经实验发现 (见图7), 金属离子浓度在0~20 nmol/L 时,Fe3+对MtICL 酶活力基本无影响, 而Ni2+却明显抑制酶活力。 在Ni2+浓度为8 nmol/L 时,对MtICL 的酶活力抑制达45%。由此可知,导致固定化酶酶活力下降的主要原因可能是固定化体系中游离的二价镍离子[27]。

图7 Ni2+、Fe3+对MtICL 酶活力影响Fig. 7 Effects of Ni2+ and Fe3+ on enzymatic activity of MtICL
2.4 MSP-COOH-F1 固定MtICL 及表征
2.4.1 MSP-COOH-F1 固定MtICL 固载量及表观保留比活如图8 所示,活化MSP-COOH-F1 的加入量为600 μg,重组蛋白质加入量在0~200 μg 时,磁珠固载量逐渐增加。当重组蛋白质加入量为250 μg时,达到饱和固载,即600 μg 活化磁珠的最大固载量约为9.5 μg, 计算磁珠表观固载量约为 (15.8±1.0) mg/g(以磁珠质量计,n=3)。 随着重组蛋白质加入量的增加,表观保留比活逐渐降低。 在重组蛋白质加入量为10 μg 时,表观保留比活最高,约为游离酶的85%, 此时的表观固载量为(7.2±0.2) mg/g(以磁珠质量计,n=3)。MtICL 的活性位点结合口袋较小,底物小分子不易有效到达活性位点[28],当重组蛋白质加入量增多时,磁珠表面可能偶联了多个蛋白质,蛋白质大分子之间的空间位阻阻碍了底物进入蛋白质活性中心,使得酶活力下降。 与MSP-NTA相比,MSP-COOH-F1 的表观固载量较低,但固定化酶表观保留比活明显优于前者。 为了使固定化酶在后续的应用中有最大的保留酶活力, 采用MSPCOOH-F1 固载重组蛋白质, 且控制重组蛋白质与磁珠投料质量比为1∶60。
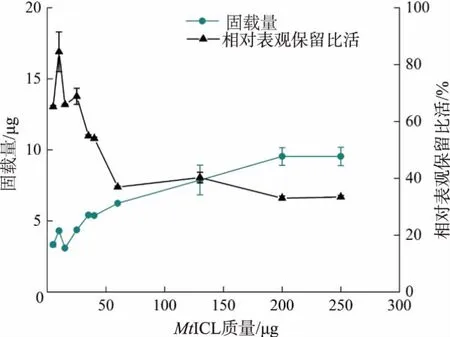
图8 MSP-COOH-F1 固定MtICL 的固载量和相对表观保留比活Fig. 8 Immobilization quantity and relative apparent retention specific activity of MtICL on MSP -COOH-F1
2.4.2 MtICL 固定化前后对抑制剂的响应游离酶对抑制剂3-BP 和IA 的IC50分别为 (63.6±2.8)、(38.6±0.8) μmol/L(n=3,见图9)。 MSP-COOH-F1固定化MtICL 对IA 的IC50为(42.5±1.4) μmol/L(n=3,见图9(b)),与游离酶相比无显著差异(P>0.05),且与文献报道相符[29]。

图9 MSP-COOH-F1 固定化酶和游离酶对抑制剂的响应曲线Fig. 9 Responsing curve of MSP-COOH-F1 immobilized enzyme and free enzyme to inhibitors
2.5 游离MtICL 和磁珠固载MtICL 的稳定性
混合物筛选中,为了实现基于亲和力的配体捕获,需要保证固定化酶的酶活力稳定。 作者所在课题组建立的迭代筛选方法中磁珠和重组蛋白质的固定化过程是30 min,前后处理过程约2 h。 因此,分别考察固定化酶和游离酶在不同温度下的稳定性。游离酶在0 ℃、4 h 活性下降5%,25 ℃活性显著下降(见图10(a))。 MSP-COOH-F1 固定化酶在0 ℃和25 ℃下18 h 内活性无显著变化 (见图10(b))。而MSP-NTA 固定化酶在0 ℃和25 ℃时2 h 内活性分别下降8%、44%(见图10 (c))。 故MSPCOOH-F1 固定化酶的稳定性明显优于MSP-NTA固定化酶和游离酶。
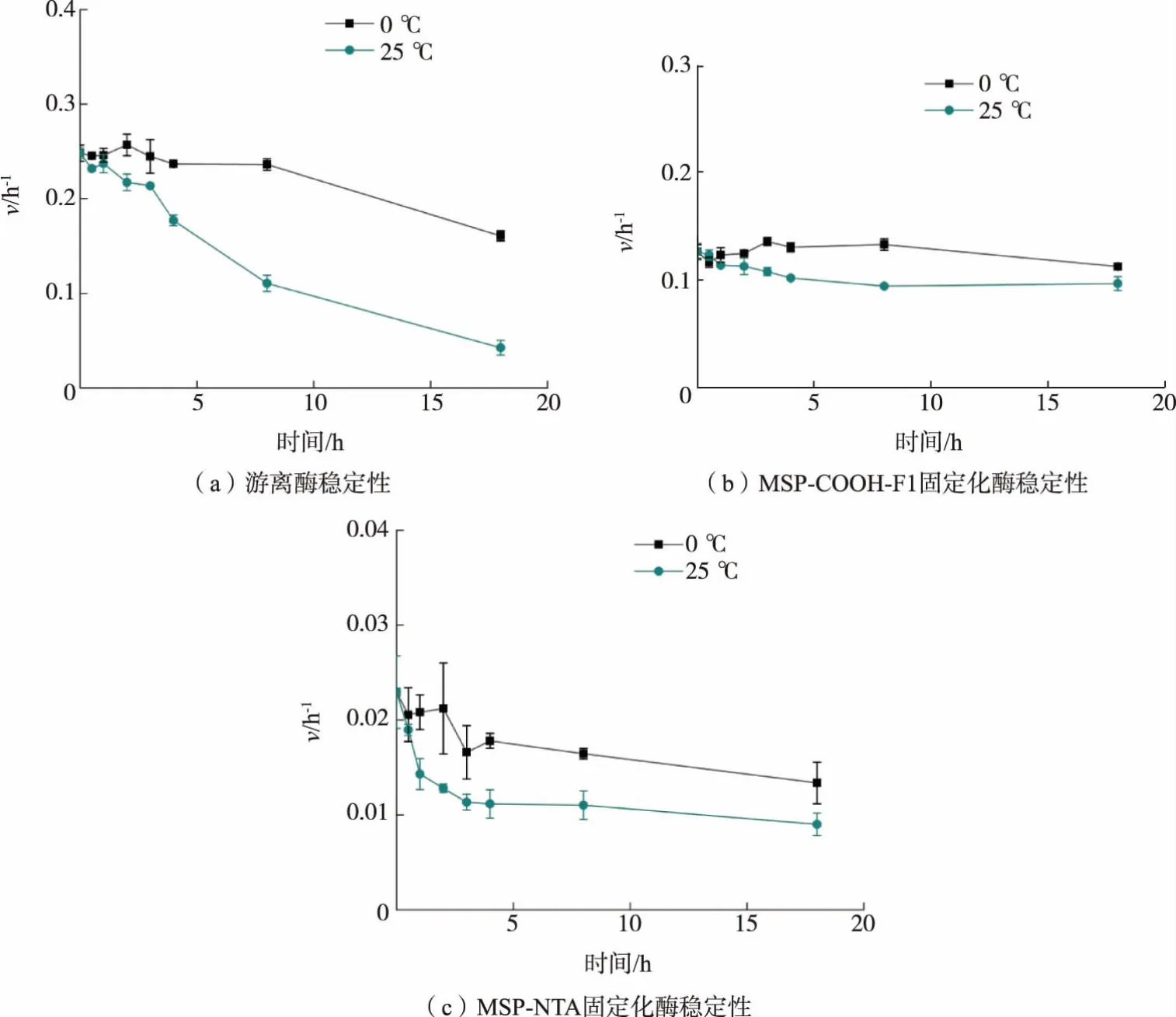
图10 游离酶和固定化酶稳定性Fig. 10 Stability of the free and immobilized enzymes
3 结 语
通过构建N 端带6×His 标签的MtICL 表达载体pET28a,在E.coliBL21(DE3)中表达并纯化,获得表达量、纯化率及酶比活均较高的MtICL,可望实现大量可溶表达,满足磁珠固定化并采用迭代筛选体系筛选天然产物对蛋白质质量的要求。 对比两种磁珠对MtICL 的固载量、表观保留比活及稳定性发现,MSP-NTA 表面修饰有Ni2+, 可通过MtICL 上的6×His 标签选择性地固定蛋白质(见图1(a)),表观固载量约是MSP-COOH-F1 的8 倍,而表现保留比活却显著下降, 在25 ℃放置2 h 酶活力下降44%。共价结合固定化酶是目前应用最广泛的固定化酶方法之一[30]。 MSP-COOH-F1 表面修饰的羧基官能团,经过EDC 和NHS 活化后,可与蛋白质表面的游离氨基形成酰胺键而共价固定化 (见图1(b))。MtICL 由4 个相同的亚基组成, 其晶体结构(PDB:1F8M) 显示,表面分布有28 个赖氨酸残基,活性位点内部无赖氨酸残基。 因此,理论上羧基磁珠固定化MtICL 不会影响MtICL 酶活力。 通过对MSPCOOH-F1 固定化体系的优化, 其表观固载量可达(15.8±1.0) mg/g(以磁珠质量计),相对表观保留比活最高为85%。 MSP-COOH-F1 固定化MtICL 在0 ℃和25 ℃下保存18 h,酶活力无显著改变,相对表观保留比活及稳定性均满足迭代筛选要求。 此外,MtICL 用MSP-COOH-F1 固定化前后对抑制剂IA 的IC50也无显著差异。
亲和迭代指数富集筛选方法的应用依赖于大量的固定化酶,而MSP-COOH-F1 固定化MtICL 达到最高表观保留比活时表观固载量仅有 (7.2±0.2)mg/g(以磁珠质量计),而基于6×His 标签的固定化可大大提高MtICL 的固载量,但因金属离子镍对保留酶活力的潜在影响,后续可考虑更换靶酶融合标签。作者所在课题组报道了GST 标签的亲和标记试剂[31],将其修饰于磁珠表面便可实现磁珠对GST 标签融合酶的固定化,此基于标签的磁珠固定化策略有望提高固载量的同时保留最高酶活力。
综上所述, 相比于MSP-NTA 通过金属螯合固定,MSP-COOH-F1 的共价修饰固定MtICL 的效果更优, 适用于天然产物中ICL 抑制剂的亲和富集筛选。

