骨形态发生蛋白10 及其突变体在CHO 细胞中的表达
段 珂, 段作营, 金 坚
(1. 江南大学生物工程学院,江苏 无锡 214122;2. 江南大学生命科学与健康工程学院,江苏 无锡 214122)
骨形态发生蛋白(bone morphogenetic proteins,BMPs)家族属于TGF-β 超家族,是一类调节细胞生长和分化的细胞外信号多肽,可诱导骨髓充质干细胞成骨分化[1]。 骨形态发生蛋白10 是BMPs 家族中的一员,其表达被限制在心肌细胞中,在胚胎心脏发育和心肌修复过程中发挥重要作用[2],在临床上具有治疗心力衰竭和降低肿瘤治疗药物造成的心脏毒性的潜力[3-4]。
天然BMP10 分子由424 个氨基酸残基组成,全长单体蛋白质由信号肽(signal peptide)、前导肽(propeptide)和成熟肽(mature chain)3 部分组成[5]。1~21 位氨基酸为信号肽,22~316 位氨基酸为前导肽,317~424 位氨基酸为成熟肽,在前导肽与成熟肽连接处313~316 位氨基酸处有一个Furin 特异性识别位点RIRR↓316,在67 位和131 位氨基酸处存在两个蛋白质糖基化位点[6]。
作者所在研究团队前期在CHO 细胞中随机整合并成功表达BMP10, 发现BMP10 前体蛋白proBMP10 (含前导肽和成熟肽) 而不是成熟肽rhBMP10 可能在药物应用方面更有优势[7]。 但由于Furin 的存在,造成表达产物不均一,给后续成药造成一定困难。 据文献报道,在Furin 的特异性识别位点(313~316 位氨基酸,RIRR↓316) 中,313 位与316位的精氨酸是发生切割的必要氨基酸[8]。 为了得到不被Furin 切割的单一形态的proBMP10,并在尽可能不改变蛋白质性质的情况下,考虑用同为碱性氨基酸的赖氨酸在这两个位点对proBMP10 进行突变,突变体1(proBMP10-1)将313 位的精氨酸突变为赖氨酸(R313K),突变体2(proBMP10-2)将316位的精氨酸突变为赖氨酸(R316K)。
由传统的随机整合方法所得到的重组CHO 细胞,由于基因组的固有不稳定性、整合位点的不稳定性及细胞凋亡等因素的影响会造成外源蛋白质表达的不稳定性[9-10]。因此,本研究中采用作者所在研究团队构建的抗凋亡IE3 细胞株(CHO-K1-BAK-/BAX-双敲除细胞), 并采用CRISPR/Cas9 技术[11-12],在作者所在研究团队筛选并已验证可稳定表达外源蛋白质的特定位点[13],定点整合proBMP10及其突变体proBMP10-1 和proBMP10-2 的基因,以期得到表达产物单一、 表达稳定、 有活性的proBMP10。
1 材料与方法
1.1 质粒与细胞
大肠杆菌DH5α 感受态细胞、EGFP 质粒、IE3细胞株(CHO-K1-BAK-/BAX-双敲除细胞)由作者所在研究团队构建并保存;pUC57/proBMP10、pUC57/proBMP10-1、pUC57/proBMP10-2 由南京金斯瑞公司合成;Psk-U6-gRNA 和Cas9-DTU 质粒由复旦大学卢大儒教授惠赠;proBMP10 活性测定细胞P19 由中国医学科学院阜外医院心血管疾病国家重点实验室惠赠。
1.2 主要试剂
限制性内切酶(KpnⅠ、SmaI)和T4 DNA 连接酶: 赛默飞公司;DMEM-F12 培养基和胎牛血清(FBS):美国Gibco 公司;质粒小量提取试剂盒、PCR产物纯化试剂盒: 上海生工生物工程有限公司;引物合成和测序由金唯智公司完成;anti-BMP10 propeptide 抗体、rhBMP10 标准品:R&D 公司; 其余试剂为国产或进口分析纯产品。
1.3 proBMP10 及其突变体重组IE3 细胞株的构建
1.3.1 设计思路重组IE3 细胞株采用定点整合的方法进行构建, 整合位点是CHO 细胞基因组中NW_003626341.1 内第1 689 碱基(上下游1 614~1 763 碱基内)处[13]。 位于同源臂内的EGFP 和Puro为正选标记,mCherry 为反选标记,发生定点整合的细胞株在含嘌呤霉素的压筛培养基中表现为只发绿光[13]。 供体片段定点整合方法如图1 所示。

图1 供体片段定点整合方法示意图Fig. 1 Illustration of donor fragment site-specific integration
1.3.2 引物设计及合成proBMP10 及其突变体PCR 引物序列见表1。 其中:FL-5′和FL-3′的下划波浪线部分为KpnⅠ和SmaⅠ的酶切位点;MID-5′和MID-3′为his-tag 和肠激酶识别位点引物, 下划线部分为his-tag 和肠激酶碱基序列。5′arm-F 和5′arm-R 用来验证5′arm 的定点整合,3′arm-F 和3′arm-R 引物用来验证3′arm 的定点整合。 引物均由金唯智公司合成。

表1 proBMP10 及其突变体PCR 引物Table 1 Primers for amplification of proBMP10 protein and its mutants by PCR
1.3.3 供体质粒的构建以pUC57/proBMP10、pUC57/proBMP10-1、pUC57/proBMP10-2 质粒为模板, 分别以FL-5′和MID-3′、FL-3′和MID-5′为引物,进行PCR 扩增[14]。 割胶回收后再以回收液为模板,FL-3′和FL-5′为引物,再次进行PCR 扩增[14]。回收液和EGFP 质粒分别用KpnⅠ和SmaⅠ进行酶切,割胶回收后加入T4 DNA 连接酶进行连接,然后转化至感受态E.coliDH5α,涂布于含100 μg/mL 氨苄青霉素的LB 固体培养平板上,37 ℃过夜培养,第2 天挑取单菌落,进行菌落PCR 鉴定,并送金唯智公司进行测序。
1.3.4 细胞转染将上述得到的3 个供体质粒分别与Psk-U6-gRNA 质粒及Cas9-DTU 质粒共转染IE3 细胞株 (供体质粒、Psk-U6-gRNA 质粒、Cas9-DTU 质粒的质量比为1.8∶1.8∶1.0)[13]。 转染之后的10 d 内,压筛扩培抗药细胞。
1.4 细胞克隆的筛选
待细胞池中细胞长到合适状态时,用流式细胞仪挑选只发绿光不发红光的单克隆细胞至96 孔板中, 用含体积分数10%胎牛血清的DMEM-F12 培养基培养10 d,扩培至24 孔板中,等到细胞汇合度达到80% 时更换无血清培养基培养48 h, 取上清液进行Dot blot 检测。 选取表达目的蛋白质的阳性孔提取基因组, 分别以5′arm-F 和5′arm-R、3′arm-F和3′arm-R 为引物,进行PCR 定点整合验证,并选取相对分子质量正确的条带测序验证[13]。 选取Dot blot 验证和PCR 验证都正确的单克隆,取上清液进行Western blot 检测。 具体方法为:经120 g/L SDSPAGE 分离蛋白质,转移至NC 膜上,以50 g/L 脱脂奶粉室温封闭2 h;TBST 漂洗3 次, 加入anti-BMP10 propeptide 抗体(1∶1 000 稀释),室温孵育4 h;TBST 漂洗3 次,加入山羊抗小鼠二抗(1∶2 000稀释),室温孵育2 h;ECL 显色成像[14]。
将筛选出的高表达克隆株扩培至6 孔板中,用含体积分数10%胎牛血清的DMEM-F12 培养基培养2 d 后,用PBS 清洗扩培至T25 培养瓶中,待到细胞汇合度达到90% 时扩培细胞至T75 培养瓶中,最后进行悬浮驯化,挑选表达量最高的细胞株,分别命名为IE3-proBMP10、IE3-proBMP10-1、IE3-proBMP10-2。
1.5 目的蛋白质的初步纯化与Furin 酶切验证
由于在构建proBMP10 及其突变体时, 在全长单体蛋白质的信号肽与前导肽之间, 即proBMP10分子的N 端,添加了his-tag 和肠激酶识别位点,因此,采用镍柱对目的蛋白质进行初步纯化。
高表达细胞株IE3-proBMP10、IE3-proBMP10-1、IE3-proBMP10-2 分别经3 L 摇瓶流加表达8 d,收集培养液。 经1 000g离心10 min 后保留上清液,上清液经8 000g离心40 min 后先经0.45 μm 滤膜再经0.22 μm 滤膜抽滤,过镍柱纯化。 以A 液(500 mmol/L Tris-HCl、300 mmol/L NaCl、25 mmol/L 咪唑,pH 8.0)平衡柱子,收集流穿液;用上一步抽滤液上样,最后直接以B 液(500 mmol/L Tris-HCl、300 mmol/L NaCl、200 mmol/L 咪唑,pH 8.0)洗脱,收集洗脱峰处洗脱液, 经SDS-PAGE 和Western blot 检测,取蛋白质液加入肠激酶,于37 ℃酶切12 h 后加入Furin 酶切1 h,进行Western blot 检测。
1.6 目的蛋白质的活性检测
BMP10 与受体结合后, 会使细胞内的Smad 6基因表达水平上升,因此采用qPCR 法检测Smad 6表达情况作为proBMP10-2 活性的指标[15]。 采用不添加任何因子的培养基作为阴性对照,rhBMP10 标准品为阳性对照, 考虑到rhBMP10 和proBMP10-2分子大小的差异 (后者相对分子质量5.8×104约为前者1.3×104的4.5 倍), 为保证反应体系中具有比较一致的物质的量浓度, 在测定时,rhBMP10 的质量浓度为100 μg/L,proBMP10-2 质量浓度为450 μg/L。
2 结果与分析
2.1 重组表达质粒的鉴定
在含100 μg/mL 氨苄青霉素的3 个LB 固体培养平板上各随机挑选10 个克隆,经菌落PCR 鉴定,EGFP -proBMP10 的7、8、10 号克隆,EGFP -proBMP10-1 的8、9、10 号克隆,EGFP-proBMP10-2的11、13、14、 15 号克隆在约1 300 bp 处可见阳性条带(见图2)。

图2 EGFP-proBMP10 及其突变体的菌落PCR 产物电泳图Fig. 2 Electrophoresis diagram of EGFP-proBMP10 and its mutant colony PCR
分别从EGFP-proBMP10 的7 号克隆、EGFPproBMP10-1 的9 号克隆、EGFP-proBMP10-2 的11号克隆提取质粒, 并进行酶切鉴定, 在约1 300 bp处均可见特异性条带(见图3)。 对这3 个质粒进一步测序验证, 结果与设计的基因序列比对结果一致,表明3 种重组表达质粒构建成功。

图3 质粒EGFP-proBMP10 及其突变体酶切鉴定电泳图Fig. 3 Electrophoresis diagram of plasmid EGFP -proBMP10 and its mutants by restriction digestion
2.2 细胞克隆的筛选
根据敲入整合策略,收集转染后的细胞用流式细胞仪分选只发绿光的细胞, 培养10 d 后转移至24 孔板, 取不含血清的细胞培养上清液经Dot blot筛选出proBMP10 及其突变体的表达株, 提取单克隆细胞基因组进行PCR 验证,结果如图4 所示。 结果显示,proBMP10 的1 号和3 号克隆、proBMP10-1的4 号和5 号克隆以及proBMP10-2 的10 号克隆的5′端PCR 产物和3′端PCR 产物都同时出现了大小符合预期 (5′端约2 800 bp;3′端约3 200 bp)的DNA 条带。通常当5′端和3′端引物同时扩增出大小符合预期的片段,就基本可以认为目的基因定点整合成功。对这5 株单克隆细胞株PCR 验证产物进行测序, 结果表明在NW_003626341.1 内第1 689 碱基处成功敲入了含proBMP10 及其突变体编码基因的DNA 片段,得到了定点整合的表达proBMP10 及其突变体的重组CHO-K1-IE3 工程细胞株。
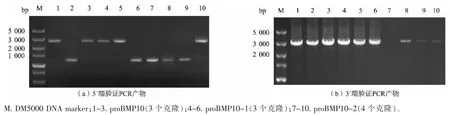
图4 proBMP10 及其突变体基因定点整合验证结果Fig. 4 Verification of site-specific integration of proBMP10 and its mutant genes
取这5 株重组细胞克隆株的无血清贴壁培养上清液进行Western blot 分析, 在相对分子质量约5.8×104处均可见明显条带(见图5),表明定点敲入的proBMP10 及其突变体基因成功表达。 目的蛋白质相对分子质量理论值为4.8×104,但电泳条带显示位置在相对分子质量5.8×104, 这与天然合成的proBMP10 电泳时呈现的分子大小是一致的[8]。 由于proBMP10 在67 位和131 位氨基酸处存在两个蛋白质糖基化位点, 推测它们在CHO 细胞中表达时可能发生了糖基化。 此外,从图5 中可以看出,在贴壁培养条件下, 无论proBMP10 还是其突变体,在Western blot 鉴定时都只在相对分子质量5.8×104处存在单一条带,未观察到Furin 酶切所形成的条带。

图5 重组CHO 单克隆细胞株贴壁培养上清液的Western blot 鉴定Fig. 5 Western blot identification of adherent culture supernatant of recombined CHO cells
2.3 proBMP10 及其突变体的初步纯化及Furin酶切鉴定
经过悬浮驯化筛选出3 株高表达细胞株,分别命名为IE3-proBMP10、IE3-proBMP10-1、IE3-proBMP10-2。 在CD 培养基中流加表达8 d,取发酵上清液进行镍柱纯化,将发酵上清液、流穿液、洗脱液分别进行SDS-PAGE 分析,结果见图6。 结果显示,3 株细胞株的发酵上清液过镍柱后基本实现了纯化。IE3-proBMP10 和IE3-proBMP10-1 的镍柱洗脱液除了在相对分子质量5.8×104处出现了明显条带之外, 在相对分子质量4.5×104处也出现了可见条带,而IE3-proBMP10-2 只在相对分子质量5.8×104处有可见条带。
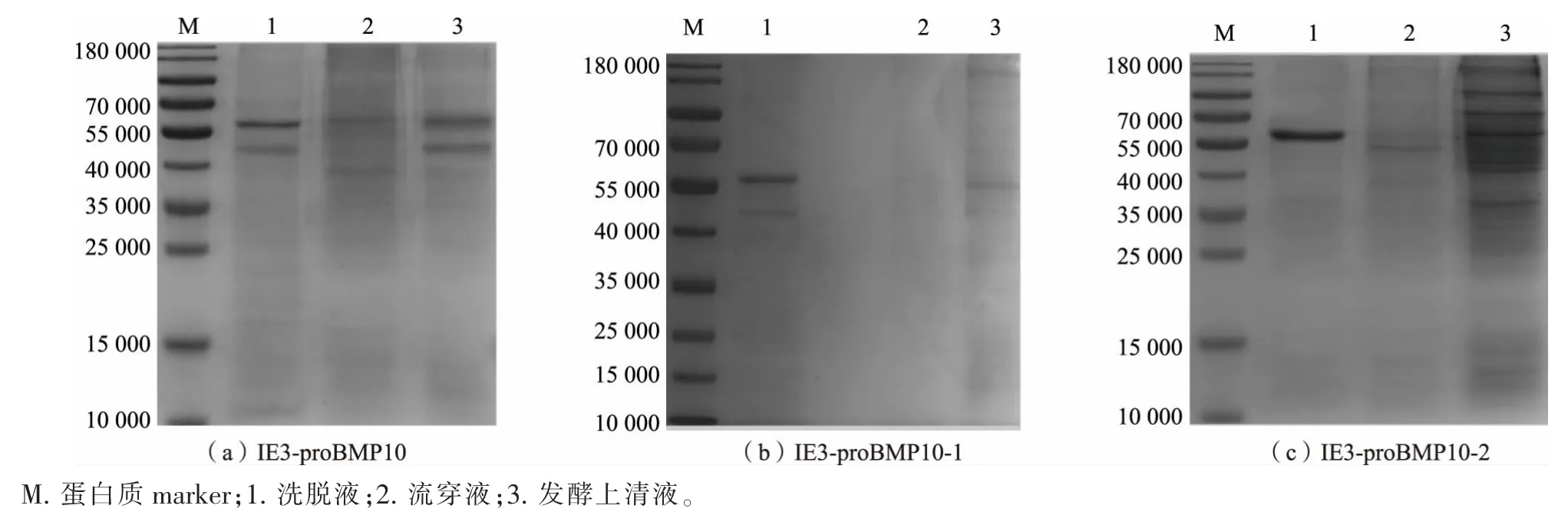
图6 重组细胞流加培养液镍柱纯化的SDS-PAGE 分析Fig. 6 SDS-PAGE analysis of recombinant cells with added culture medium purified by nickel column chromatography
对上述电泳结果同时进行Western blot 鉴定,结果如图7 所示。 可以看出,IE3-proBMP10、IE3-proBMP10-1 目的蛋白质镍柱纯化产物分别在相对分子质量5.8×104和4.5×104处可见2 个条带,而IE3-proBMP10-2 目的蛋白质镍柱纯化产物在相对分子质量5.8×104可见单一条带。 表明IE3-proBMP10 和IE3-proBMP10-1 所表达的目的蛋白质有可能被Furin 酶切,而IE3-proBMP10-2 突变株表达的目的蛋白质则可能不再被Furin 酶切。
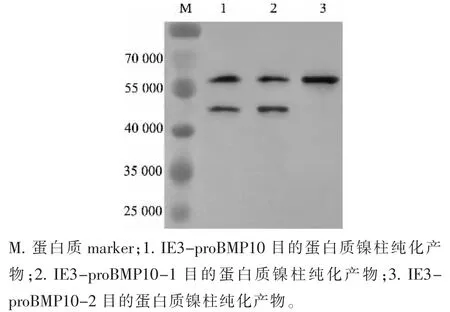
图7 目的蛋白质镍柱纯化产物的Western blot 分析Fig. 7 Western blot analysis of purified target proteins by nickel column
为了进一步验证, 进行了Furin 体外酶切实验, 结果如图8 所示。 Furin 酶切后,anti-BMP10 propeptide 抗体的杂交结果显示,proBMP10 和proBMP10-1 在相对分子质量5.8×104的条带基本消失, 而在相对分子质量4.5×104处的条带得到了加强。 表明proBMP10-1 的确和proBMP10 一样,仍可以被Furin 酶切,proBMP10 分子上313 位的精氨酸不是Furin 酶切必需的, 将其替代为赖氨酸并不能阻止切割的发生。 而proBMP10-2 仍在相对分子质量5.8×104处出现单一条带, 未在相对分子质量4.5×104处出现Furin 切割典型条带, 表明proBMP10-2 突变体不再被Furin 识别和切割,proBMP10 分子上316 位的精氨酸是Furin 酶切必需的。

图8 目的蛋白质酶切后的Western blot 分析Fig. 8 Western blot analysis of target proteins after digestion
2.4 目的蛋白质的活性
为了验证不能被Furin 酶切的proBMP10-2 突变体是否仍具有生物活性,采用qPCR 检测Smad 6相对表达量,结果如图9 所示。结果表明,proBMP10-2经肠激酶酶切前后, 都具有一定的活性,Smad 6表达量分别为阴性对照的6.3 倍和6.2 倍, 与相同浓度下的rhBMP10 标准品活性相当。 表明proBMP10-2具有生物活性,且his-tag-DDDDK 标签的存在对其活性无明显影响。
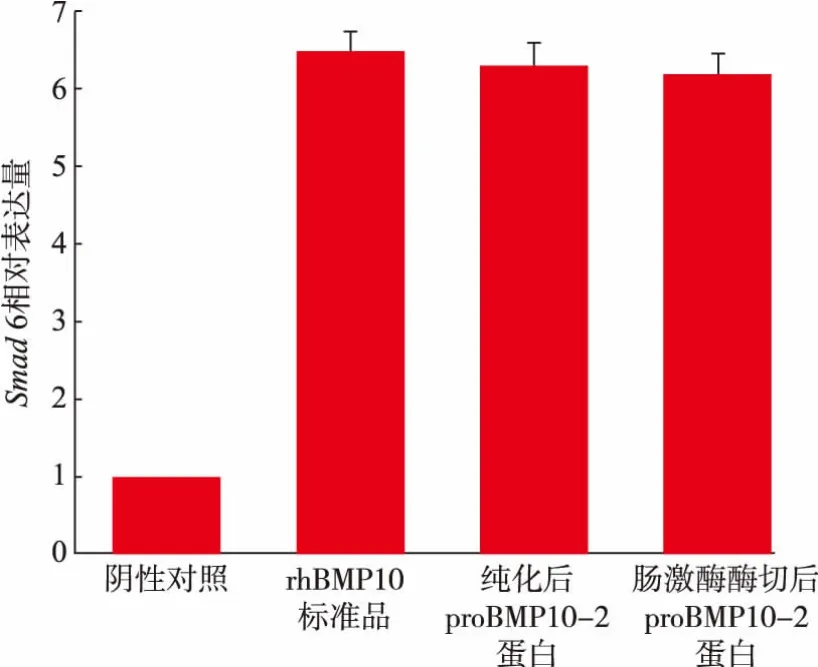
图9 proBMP10-2 的活性检测Fig. 9 Determination of activity of proBMP10-2
3 结 语
本研究中构建了proBMP10 Furin 酶切位点的突变体proBMP10-1(R313K)和proBMP10-2(R316K)。 实验结果表明,将proBMP10 分子中313位精氨酸突变为赖氨酸并不能阻止Furin 对proBMP10 的酶切,而将proBMP10 分子中316 位精氨酸突变为赖氨酸则可以阻止Furin 对proBMP10的酶切。 活性测定结果表明,改造后的proBMP10-2仍具有生物活性, 这有效避免了proBMP10 表达产物不均一的问题,为其成药提供了一条新思路。
应用作者所在研究团队建立的CHO 定点整合表达体系,在抗凋亡的IE3 细胞株(CHO-K1-BAK-/BAX-双敲除细胞)中,筛选得到了目的蛋白质的稳定表达细胞株IE3-BMP10、IE3-BMP10-1 和IE3-BMP10-2,缩短了重组细胞株的构建流程,验证了作者所在研究团队建立的定点整合体系的有效性。

