脂肪酶固定化技术的研究进展
梅玲,李道明
(陕西科技大学食品科学与工程学院,陕西西安 710021)
目前,绿色化学是大多数化工行业发展的最终目标[1]。与此同时,人们对环境保护和绿色生产的关注日益增加。在这种背景下,酶作为一种高效、绿色的生物催化剂被广泛使用。脂肪酶作为重要的工业用酶广泛应用于食品加工、油脂改性、生物柴油制备、手性化合物拆分等方面[2]。虽然脂肪酶在工业上有着巨大的应用潜能,但大多数游离脂肪酶获取成本高、操作稳定性低,且在有机相中不溶解,反应过程中容易结块,大大降低了酶的利用率,酶回收和再利用困难[3],导致脂肪酶的应用成本高。而脂肪酶固定化形态在多种性质上均优于游离态。酶经固定化后,其具有稳定性高、易回收、可反复使用、成本低等优点[4]。因此,酶固定化技术应运而生并不断发展。图1 为游离酶和固定化酶应用于催化反应时的示意图。
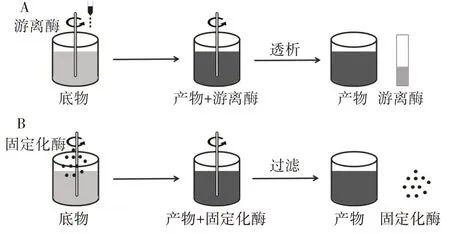
图1 游离酶和固定化酶反应示意图Fig.1 Schematic diagram of reaction of free enzyme and immobilized enzyme
酶的固定化技术是指将游离酶束缚在一定空间或完全附着在一定的载体上,从而限制游离酶自由流动,使其长时间发挥催化作用并可回收利用的生物技术[5]。它是一种常用、有效、便捷的生物酶修饰手段,对酶的催化活性和操作稳定性具有极大的改善和提升作用[5]。
我国对酶的固定化技术研究始于20世纪60年代,20世纪80年代以后固定化脂肪酶在食品加工、生物能源、生物医药等方面的应用也越来越广泛[6]。传统的脂肪酶固定化技术经过几十年的发展,在改善酶的催化特性上取得了一些成果,但仍受到适用范围小、成本较高、产品分离困难等因素的限制。因此,在较为成熟的传统固定化技术基础上,研究者们对新型固定化技术进行了大量的研究与创新,形成了以固定化载体和固定化方式为核心的新型固定化技术。
本文围绕脂肪酶的传统及新型固定化方法以及固定化对酶性质的影响等方面进行概述,对其进行了总结与展望,以期为推动脂肪酶固定化技术的进一步发展提供参考。
1 脂肪酶来源
自然界中的脂肪酶普遍存在于动植物的各种组织及多种微生物中[7]。自1834年关于兔胰脂肪酶的报道至今,有关脂肪酶的研究已有近200年的历史[8]。植物中的脂肪酶主要存在于油脂丰富的油料作物种子中(如油菜籽、花生、大豆)[9];动物体内含脂肪酶较多的是高等动物的胰脏和脂肪组织等[10];在微生物中,脂肪酶的含量更为丰富。20世纪初研究人员首次发现了微生物脂肪酶[11]。据统计,产脂肪酶的微生物属包括细菌28 个属、放线菌4 个属、酵母菌10 个属以及真菌23 个属[12]。微生物脂肪酶具有比动植物脂肪酶更为广泛的作用pH 值、温度以及作用底物范围[13]。因此,微生物脂肪酶是工业脂肪酶的重要来源之一。
2 传统脂肪酶固定化方法
根据酶与载体材料之间的作用方式不同,传统的固定化方法可分为物理方法和化学方法,物理方法包括吸附法和包埋法,化学方法包括共价结合法和交联法[9]。在物理方法中,酶和载体之间是通过较弱的键(如氢键、范德华力等)产生相互作用,因此酶与载体之间的结合是可逆的。而化学方法形成的共价键使得酶与载体之间相互作用更强,因此这个过程是不可逆的。图2 为传统的脂肪酶固定化技术分类。
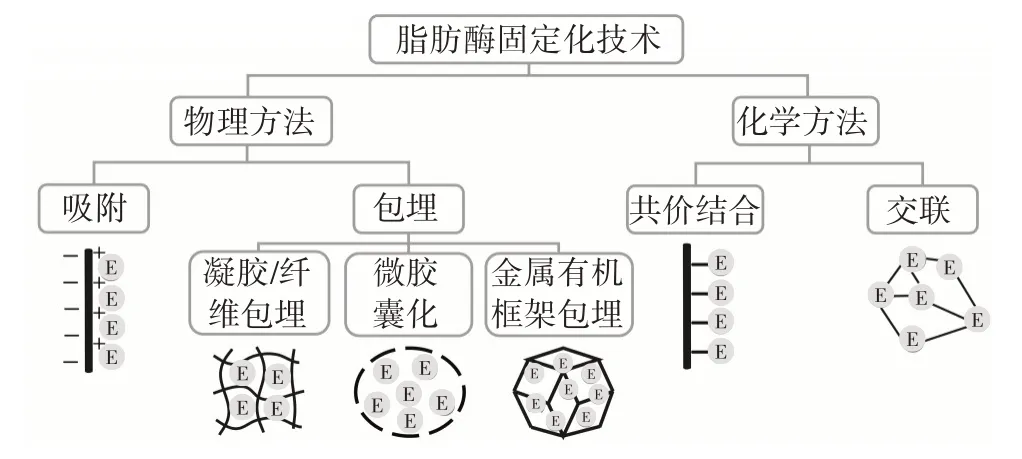
图2 传统的脂肪酶固定化技术Fig.2 Conventional lipase immobilization
吸附法也称为非共价法[14],是最早应用的酶固定化方法之一。它通过载体和酶分子自身结构之间产生的非特异性的物理吸附、离子吸附、生物特异性吸附等,将酶分子固定在载体周围从而形成固定化酶。该方法最常用的载体是阳离子和阴离子交换树脂、活性炭、硅胶、陶瓷、纤维素和琼脂糖等天然材料,以及一些工业残留物。Ulker 等[15]通过物理吸附将南极假丝酵母脂肪酶B(Candidaantarcticlipase B,CALB)固定在表面修饰稻壳灰上,从而获得了具有良好的储存稳定性、热稳定性、酸碱稳定性和回收再利用稳定性的固定化脂肪酶制剂。通过吸附法可以使脂肪酶的各种特性得到提升,但酶与载体之间的作用力较弱,在催化使用中脂肪酶容易脱离载体。
包埋法是一种能保持酶原有构象,并带来良好的机械和储存稳定性的方法[16]。在包埋固定化过程中,酶被保留在聚合物结构中,其孔隙允许底物和产物通过。Nobakht 等[17]研究了两种载体包埋猪胰脂肪酶的应用,与游离脂肪酶相比,包埋固定化脂肪酶具有更高的热稳定性、酸碱稳定性和可重复使用性。在肉桂酸苄酯的合成过程中,固定化酶在连续5 次催化循环后,仍保持了90.4%的初始活性,循环使用8 次后,肉桂酸苄酯产率仍能达到80.0%。但经过大量的实际应用发现,使用包埋法制备的固定化酶易出现扩散限制、载体难以回收等问题。
共价结合法是将酶分子表面的官能团与载体材料的活性基团通过共价键连接的一种方法[18]。Zhou等[19]在2019年通过引入聚赖氨酸将CALB 直接共价固定化在氧化亚麻粉上,在最佳条件下,固定化CALB的活性回收率为(98.9±3.8)%。与游离脂肪酶相比,固定化CALB 具有良好的热稳定性,在55 ℃下保持了(58.4±2.8)%的活性,而游离CALB 的初始活性仅为(21.2±2.2)%。共价键使得酶与载体之间结合牢固,从而使该方法制备的固定化酶具有很强的稳定性,但在共价结合过程中,酶分子的构象容易发生变化,导致酶的活性降低。
交联法是一种不需要载体的固定化酶的方法,固定化过程使用交联剂进行。这种试剂有两个末端能与可溶性酶表面的特定氨基酸基团形成分子内和分子间的交联,从而形成交联酶。交联剂的主要功能是保护酶免受外部环境的影响[20]。这种无载体固定化系统的主要优点是催化酶活性高、稳定性高,由于排除了固定化载体,生产成本降低。Guajardo 等[21]研究发现,CALB 经过交联形成的聚集体(cross-linking aggregates,CLEA)在低共熔溶剂(deep eutectic soivents,DES)中的固定化稳定性显著,其采用CLEA-CALB 衍生物催化苯甲酸和甘油酯化生产单苯甲酸甘油酯,与商业生物催化剂Novozym 435 相比,获得了多出约30%的产品。固定化衍生物可以重复使用至少6 个周期,而不损失任何活性。但是这种传统的交联法也存在一些缺陷,比如在固定化过程中酶活力损失较大、固定化酶回收率不高、交联剂价格昂贵等。
表1 总结了各类传统固定化方法的优缺点。

表1 传统的脂肪酶固定化方法的比较Table 1 Comparison of conventional methods for lipase immobilization
3 新型脂肪酶固定化技术
目前,新型脂肪酶固定化技术的研究主要集中在以下两个方面。一是新型固定化材料的开发及传统材料的改造,如纳米材料、磁性材料、金属有机骨架材料等固定载体的开发与应用[5,22];二是固定化新技术的开发,如微波辐射辅助固定化技术、膜固定化技术等的开发与应用[23]。
3.1 基于新型固定化载体的固定化酶技术
新兴的技术为酶载体创造了新的材料,以生产更坚固、更环保、更便宜的生物催化剂。固定化过程中使用的载体在提高生物催化剂的性能方面起着重要的作用。研究表明,多种新型材料被用作脂肪酶固定化的载体,如纳米材料、磁性材料、金属有机骨架材料及改性后的传统载体材料[23]。
3.1.1 改性传统载体
改性载体是对传统载体材料进行化学修饰改造,从而显著提高所制备固定化酶的性能[24]。一些应用广泛的传统载体材料(如介孔材料、金属氧化物及盐类、大孔树脂、天然多糖等),经过不断的研究已被证实在脂肪酶固定化方面具有很大的应用潜力,但因其仍具有部分缺陷,如回收再利用困难、容易使酶的活性受损等,通过有目的地修饰与改造,克服其应用缺陷,制备出新型的载体材料以推动固定化酶的工业化应用,成为当前固定化领域内的研究热点之一[5]。
介孔二氧化硅材料由于具有较高的比表面积、有序的结构和较大的孔隙体积,成为各种化合物固定化的优良载体。然而在实际应用过程中发现,经介孔二氧化硅固定的催化剂机械强度不够,且酶容易从载体材料上脱落。因此,对这种介孔材料进行改性成为当前的研究热点之一。Wang 等[25]将CALB 固定在卤素和卤代烷烃改性的SBA-15 介孔二氧化硅上。使用卤素和卤代烷烃对SBA-15 进行硅烷化改性,经过改性,得到功能化的SBA-15,命名为SBA-15-R(R 为卤素或卤代烷烃),并比较SBA-15 和改性的SBA-15 介孔材料作为不同脂肪酶的载体时催化活性的差异。结果表明,功能化的SBA-15 不仅具有良好的催化活性,而且可以防止酶脱落。因此,改良的SBA-15 是脂肪酶固定化的良好载体。
脂肪酶固定化载体SBA-15 结构示意图见图3[26]。
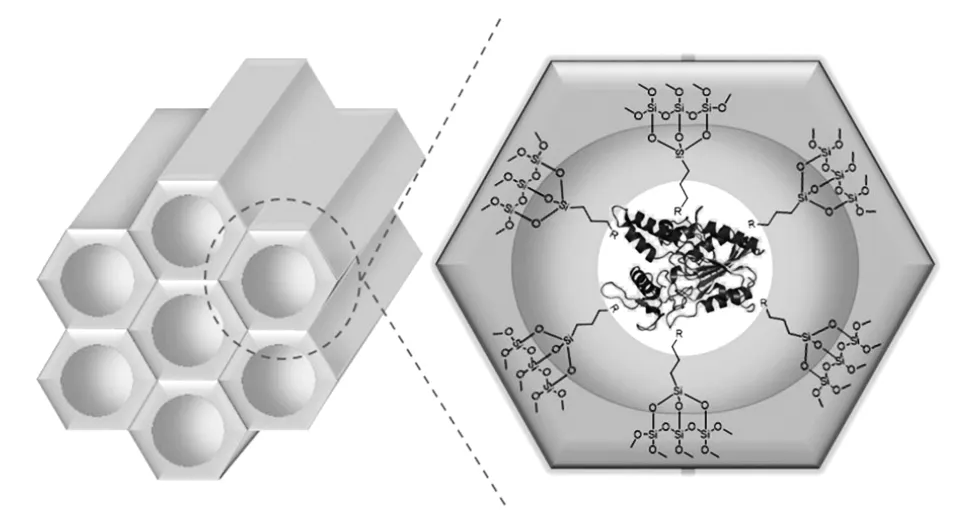
图3 脂肪酶固定化载体SBA-15 结构示意图Fig.3 Structure of SBA-15 as a lipase immobilization carrier
琼脂糖是一种天然多糖,在脂肪酶的固定化方面具有巨大的应用潜能。李冉[27]通过对琼脂糖凝胶进行了环氧、氨基和羧基化改性,成功制备了一种N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)修饰的琼脂糖凝胶,然后筛选出了安全性高和固定化效果好的改性载体和偶联方法,分别固定化L-天冬酰胺酶和T1脂肪酶,并在模拟应用体系中探究其应用性能。结果表明,固定化T1 脂肪酶在经过6 次循环使用后,仍能保持77.58% 的活力,固定化后虽然最适温度略有下降,但固定化T1 酶的可操作性和稳定性明显增加,展现出了良好的应用潜力。
大孔树脂是一类不含交换基团且有大孔结构的高分子吸附树脂,在树脂内部具有三维空间立体孔结构,具有物理化学稳定性高、比表面积大、吸附容量大、选择性好、吸附速度快、再生处理方便等诸多优点。然而,作为固定化载体,大孔树脂的可重用性较差,在使用过程中酶容易脱离载体。李雪玉等[28]分别以经多巴胺修饰的大孔树脂NKA(交联-聚苯乙烯树脂)和以对苯醌修饰活化的大孔树脂HA(交联-聚苯乙烯氨基树脂)固定化褶皱假丝酵母脂肪酶(Candidarugosalipase,CRL),将其用于催化合成L-薄荷醇酯。在最优条件下,油酸薄荷醇酯酯化率分别达到91%(NKA)和89.8%(HA)。研究表明多巴胺和对苯醌对大孔树脂的修饰均能明显提升固定化脂肪酶的催化性能。
3.1.2 纳米载体
近年来,纳米技术的最新进展为酶的固定化提供了高性能的纳米材料,由于纳米颗粒具有高的比表面积、良好的机械强度和低质量传递限制等优越的性能,研究者逐渐将其应用到包括生物技术和医学在内的各个领域,成为酶固定化的潜在载体。在脂肪酶的固定化中,酶与纳米载体结合形成的纳米生物催化剂,表现出较高的稳定性和较好的催化性能,提高了酶的可重用性以及酶与底物的亲和性[29]。常用于脂肪酶固定化的纳米材料主要包括多孔纳米金颗粒、纳米管、石墨烯等。Zhong 等[30]将CALB 共价固定在溶胶-凝胶沉淀合成的羧基功能化中空介孔硅纳米颗粒上,与游离CALB 相比,固定化CALB 对反应pH 值和温度变化的抗性更强。此外,固定化CALB 在重复使用8 次后保持了60%的残留活性,表现出较好的热稳定性和储存稳定性,具有广阔的工业应用前景。
3.1.3 磁性载体
自20世纪70年代以来,磁性颗粒越来越多地用于生物和医学领域。此后,超顺磁性纳米颗粒被用作酶固定的有效载体。磁性材料的引入解决了酶的分离问题,固定化酶可以很容易地通过施加外部磁场进行分离和恢复,从而快速终止酶促反应并回收酶以供其继续使用。单一的磁性颗粒一般不直接用于酶的固定化,通常与其他有机高分子聚合物或多孔无机材料联合使用,以获得较高的固定化效率[5]。磁性纳米颗粒(magnetic nanoparticles,MNPs)结合了纳米材料和磁性材料的优势,既具有大的比表面积和良好的机械强度又易于分离,在作为固定化酶的多功能载体方面具有独特的地位[31]。Ren 等[32]利用聚多巴胺包裹的磁性纳米颗粒(PD-MNPs),建立了一种简单的脂肪酶固定化方法。图4 为两步合成PD-MNPs 固定化脂肪酶的示意图。首先将Fe2+和Fe3+碱性共沉淀制备的Fe3O4MNPs在碱性多巴胺溶液中浸泡数小时,使MNPs 表面形成黏附的聚多巴胺膜,然后将PD-MNPs 置于含有脂肪酶的溶液中,合成PD-MNPs 固定化脂肪酶。在最佳条件下,脂肪酶的有效固定化率为73.9%,脂肪酶装载量高达429 mg/g。酶分析结果显示,与游离脂肪酶相比,固定在PD-MNPs 上的脂肪酶表现出更高的pH 值和热稳定性。此外,经过循环反应21 次和磁分离后,固定化酶仍保持了70%以上的初始活性。
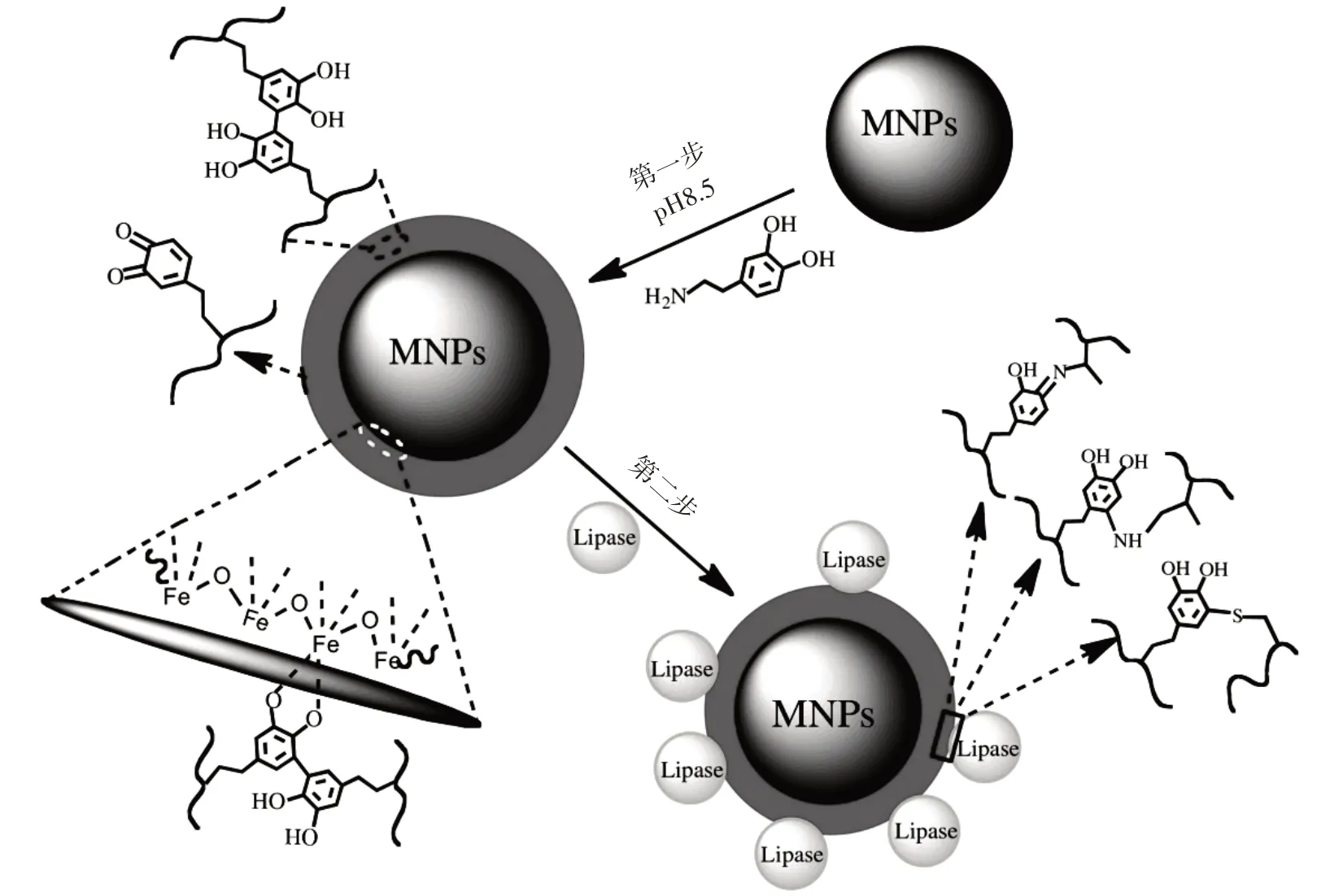
图4 两步合成PD-MNPs 固定化脂肪酶Fig.4 Two-step lipase immobilization by poly(dopamine)magnetic nanoparticles(PD-MNPs)
3.1.4 金属有机骨架材料载体
金属有机骨架(metal-organic framework,MOF)是具有高度有序微孔晶体结构的多孔混合聚合物,由特定的金属离子如过渡金属、碱金属和有机黏合剂(羧酸盐、硝酸盐和磷酸盐)组成[33]。MOF 作为固定化酶的载体材料,最大的优点在于具有可调节的孔隙率、大的比表面积、高的热稳定性和化学稳定性[34]。沸石咪唑酯骨架(zeolitic imidazolate frameworks,ZIFs)是一种在酶固定化方面具有广阔前景的MOF,ZIFs 可以在温和的条件下形成,解决了原位MOF 合成所需相对苛刻的条件问题[35]。Wang 等[36]将CALB 与硝酸锌水溶液混合,直接包埋在沸石咪唑酸盐框架ZIF-8 中,固定化酶表现出较高的活性、稳定性和可重用性。表2 总结了脂肪酶固定化的新型载体存在的优缺点。

表2 脂肪酶固定化的新型载体比较Table 2 Comparison of novel carriers for lipase immobilization
3.2 新型固定化酶制备技术
3.2.1 微波辐射辅助固定化技术
近年来,微波辐射在有机化学中得到了广泛的应用,可控微波辐射已被证实可以显著加速化学反应,并减少固定化所需的反应时间。由于微波具有“致热效应”和“非热效应”,使得作用物体分子间的摩擦以及能量转换增加,从而诱导极性分子发生旋转,最终起到改善酶活性中心与底物的诱导契合作用、增强酶催化的专一性、缩短反应时间、提高转化率的作用[37]。
Du 等[38]采用微波辐照技术在低温下将脂肪酶共价固定化在介孔硅质泡沫上,以提高酶的性能。该研究使用智能微波反应器共价固定CALB,并配有RPT-300+温度控制传感器,在冰水系统中温度控制在0~4 ℃,研究微波辐照对酶性能的影响。研究发现,最佳微波辐照功率和时间分别为400 W 和120 s。微波照射下固定化脂肪酶的比活力为114.4 U/mg,是传统无微波照射方法的1.23 倍。
微波辐照通过增加外传质系数和有效的粒子内扩散系数来加速酶的运转,从而提高了载体对酶的负载。此外,加速酶的运转可以抑制酶蛋白的自溶,增强酶分布的均匀性,从而降低了酶的聚集,提高了底物对酶活性位点的吸附性。这些因素可能是导致微波照射下固定化酶活性增强的主要原因。此外,微波辐射还可以增强蛋白质折叠的动力学[39],适当的微波照射也可以调节酶的结构,提高其活性[40]。
3.2.2 膜固定化技术
酶膜生物反应器(enzyme membrane bioreactor,EMR)将酶固定化和膜技术相结合,将高效的酶促反应与可选择的膜分离技术相结合,表现出较高的催化活性和分离能力,能够减少产物抑制、提高酶的稳定性、增加反应循环次数,并可持续地从溶液中分离产物。EMR 的性能主要依赖于酶的负载量和活性,它们分别与支撑膜的微结构和微环境有着密切的联系[41]。
实际上,绝大多数的EMR 都是将酶固定在细胞膜上的反应器(reactor with enzyme immobilized on membranes,REIMs)。酶的活性、稳定性和膜通量是评价REIM 系统的关键参数。固定化膜通常具有高酶载能力、高稳定性和低传质阻力,但也经常导致酶活性的损失和膜通量的降低[41]。一般来说,在REIM 中,酶可以在溶液中游离、固定在附加载体上或者直接固定在膜的多孔结构上,其中酶直接固定在膜上的系统是一种相对简单并且应用最广泛的方法。
Guo 等[42]在细胞流体镶嵌模型的基础上,开发了一种结合仿生界面和固定化的简便方法来构建一种性能增强的EMR。通过表面终端过滤,将脂肪酶固定化在卵磷脂修饰的聚砜中空纤维膜上,制备了固定化脂肪酶膜生物反应器,以三乙酸甘油水解为模型反应,研究其性能、膜通量、底物浓度和温度等操作变量,确定了最佳的试验条件。结果表明,制备的EMR 具有良好的催化性能,比空白材料的酶活性提高了42%,催化效率提高了78%。此外,在5 个循环后的剩余活性约为首次使用的88%,这表明EMR 具有良好的耐久性。此外,EMR 可用于连续的过程以提高生产率,并可用于进行多相反应。酶膜生物反应器具有协同催化分离性能,已越来越多地应用于实际应用。
3.2.3 毛细管柱固定化技术
微型生物分析系统正越来越多地应用于生化研究领域。研究人员已经建立了毛细管电泳中的固定化酶微反应器(immobilized enzyme microreactors in electrophoresis,IMERs),并将其用于小型生物分析系统。目前正在使用的两种常用的IMER 包括微芯片和微毛细管[43]。在形成微型生物反应器的过程中,酶可以两种形式固定在毛细管上,一种是在毛细管的内壁上;另一种是直接附着在毛细管的整体柱上[44],所得反应器命名为开管柱固定酶微反应器和整体柱固定酶微反应器。
Li 等[45]采用一种简便、高效的共价固定化方法,将CALB 作为一种新型的手性固定相固定在毛细管内壁上。由于共价键合方法的有效性和CALB 的固有稳定性,制备的CALB 固定化毛细管柱具有良好的稳定性和可重复性。图5 为CALB@毛细管柱的制备流程示意图。
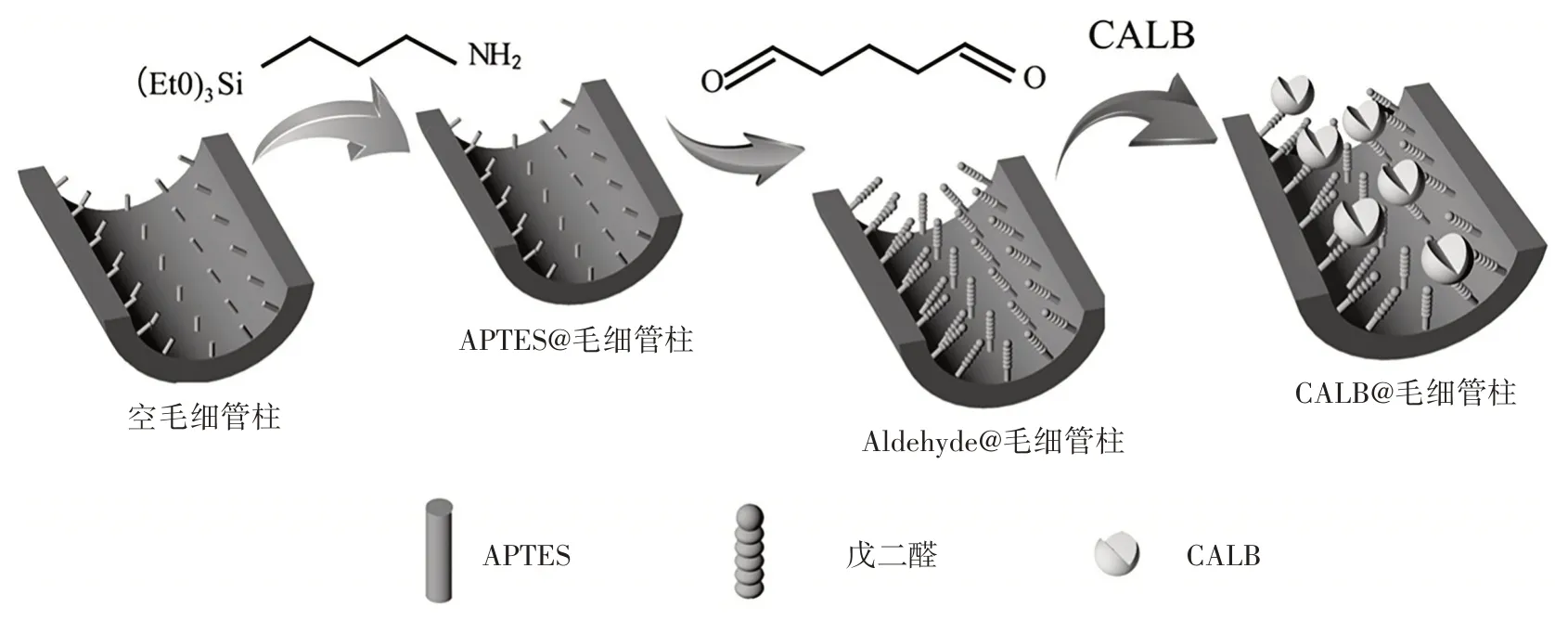
图5 CALB@毛细管柱的制备流程示意图Fig.5 Schematic diagram of preparation flow of CALB@capillary column
通过将酶的高选择性与微结构流式反应器的高效流体相结合,IMERs 在生物分析方面表现出显著的优势,它结合了酶固定化的优点(能够提高稳定性和重复使用),以及毛细管电泳的优势(即样品消耗量少、分析时间短和高效的分析)[46]。IMERs 将酶固定在微通道中进行生物催化,是小型化分析的重要工具,在连续流生物制造中具有良好的应用前景[47]。此外,将开管柱固定酶微反应器与毛细管电泳、纳米高效液相色谱、质谱和表面等离子体共振等先进的分析技术直接相结合也具有较好的前景[48]。
表3 总结了基于新技术的新型脂肪酶固定化技术的优缺点,并指出了未来的发展方向。

表3 新型脂肪酶固定化技术的优缺点及未来的发展方向Table 3 Advantages,disadvantages,and development direction of novel methods for lipase immobilization
4 固定化技术对脂肪酶性质的影响
4.1 对脂肪酶催化活性的影响
在大多数情况下,固定化脂肪酶的催化活性会比游离脂肪酶低,这是由于在固定化过程中,根据固定化方法的不同,酶分子的空间构象和活性中心都有可能发生变化,内扩散阻力也会使底物分子与活性中心的接近受阻,从而导致固定化后的酶活力下降。
然而,在某些情况下,固定化脂肪酶会表现出超活化现象。脂肪酶作为一种界面酶,具有能在油滴/介质界面中移动的多肽链的灵活构象,称为“盖子”[49]。脂肪酶作用机制的一个特点就是界面激活机制:脂肪酶可能以两种不同的构象存在,一种是开放的活性构象,另一种是封闭的非活性构象[50]。在均匀的水介质中,这些构象处于平衡状态向封闭构象移动。在底物疏水液滴的存在下,脂肪酶会吸附在这些液滴的界面上,构象平衡向脂肪酶的开放形式转移。超活化现象的发生可能是由于当脂肪酶被固定在疏水载体上时,它们的“盖子”保持打开,活性位点完全暴露,从而促进底物输入,因此该酶的活性显著增强。
4.2 对脂肪酶稳定性的影响
稳定性是指固定化酶能否长期稳定操作和反复回收使用。从已有的研究报道来看,通常情况下,固定化技术可以显著提高脂肪酶的稳定性,包括热稳定性、pH 值稳定性、有机溶剂耐受性、操作稳定性和储存稳定性等[51]。其原因可能是固定化后,酶与载体之间形成了多点连接,刚性增强,从而防止酶分子的伸展变形,酶失去了分子间相互作用的机会,抑制了其自身的降解过程[52]。
从固定化方法看,采用物理吸附法制备的固定化酶,都有可能导致酶的热稳定性降低,因此要提高酶的热稳定性,采用物理吸附法是不合适的,而采用交联法制备的固定化酶,其热稳定性将会得到改善[53]。稳定性的提高使得脂肪酶在反应中的催化作用发挥的更好,反应后也更易从产物中分离出来。操作稳定性的提高,让固定酶的重复利用成为可能,这也在一定程度上降低了催化反应的成本[54]。
4.3 对脂肪酶最适条件的影响
固定化后大多数酶的热稳定性提高,所以最适温度也随之提高。酶固定化后对底物作用的最适pH 值常常会发生偏移。带负电荷的载体固定化酶的最适pH 值向碱性偏移,带正电荷的载体固定化酶的最适pH 值向酸性偏移[55]。这是因为多聚阴离子载体会吸引溶液中阳离子,包括H+,使其附着于载体表面,结果使固定化酶扩散层H+浓度比周围的外部溶液高,即偏酸,这样外部溶液中的pH 值必须向碱性偏移,才能抵消微环境作用,使其表现出酶的最大活力。反之,使用带正电荷的载体其最适pH值向酸性偏移。
4.4 对脂肪酶特异性的影响
脂肪酶的底物特异性是指在一定反应条件下,对具有不同底物分子的催化速率存在差异[56]。酶底物特异性取决于酶分子的结构,特别是酶活性中心的结构,因此,酶结构的差异使酶的底物特异性也有所不同。而脂肪酶的特异性可以简要分为位置或区域选择性、立体选择性和脂肪酸选择性。
一般来说,通过化学方法制备的固定化酶,其空间结构容易发生变化,导致固定化酶与游离酶的底物特异性存在差异。这种差异与底物相对分子质量的大小有一定关系。对于那些作用于低分子底物的酶,固定化前后的底物特异性没有明显变化。而对于那些可作用于大分子底物、又可作用于小分子底物的酶而言,固定化酶的底物特异性往往会发生变化[55]。
Kahveci 等[57]通过生物印迹和固定化技术提高CRL 和南极假丝酵母脂肪酶A(candidaantarcticlipase A,CALA)的活性和选择性,并对所有改性脂肪酶进行了鱼油选择性乙醇解以浓缩omega-3 多不饱和脂肪酸的测试。结果表明,除固定化的酶外,其他酶均不催化乙醇分解,处理后的脂肪酶表现出更高的活性和更好的脂肪酸选择性。
5 总结与展望
在酶的固定化研究中,相比较传统的固定化方法,新型固定化载体和新型固定化技术具备机械强度大、稳定性高、分离效率高等诸多优势和发展潜力。本文主要从脂肪酶固定化的新技术和新载体的角度对脂肪酶固定化技术进行了全面综述,比较分析了各种固定化方法存在的优缺点。结合当前固定化脂肪酶的发展趋势,在未来的脂肪酶固定化技术研究中,还需要在以下几个方面做出努力:1)着力于开发过程简单、易于操作、具有普适性的新方法;2)寻找廉价易得、易分离、使用寿命长、机械强度好的新载体;3)通过批次反应、放大试验,实现固定化脂肪酶稳定、连续、规模化生产。利用固定化技术提高脂肪酶的稳定性、酶活力、选择性以及重复利用率等性能可以使脂肪酶更好地应用于食品加工领域,具有十分广阔的前景。

