间接竞争ELISA检测杏仁过敏原Amandin
刘俊伟,吴雨晴,李明新,陆旸,任光达
(1.天津国际生物医药联合研究院,天津 300457;2.天津科技大学天津市食品质量与健康重点实验室,食品营养与安全国家重点实验室,食品科学与工程学院,天津 300457;3.华芯领创(天津)生物科技有限公司,天津 300451)
食物过敏是食品中的抗原物质刺激人体免疫系统所产生的不良反应,其中由免疫球蛋白(immunoglobulin E,IgE)介导的食物过敏反应最为常见[1-2]。而食品中能够诱导机体产生IgE 并使抗体进一步诱导效应细胞释放介质从而引起速发型过敏反应的物质被称为食品过敏原[3]。目前已知的食物过敏反应主要是由花生、坚果、大豆、小麦、蛋类、奶类、鱼类和甲壳类水产等引起[4]。在美国,多达600 万儿童和2 600 万成年人有食品过敏的情况[5-6]。研究表明,在我国的部分地区包括杏仁在内的坚果类食物已成为引发过敏性鼻炎和哮喘的危险因素之一[7-8]。杏仁作为世界范围最受欢迎的坚果类之一,其过敏反应已经引起了人们的关注[9-11]。对于如何在食品加工过程中降低或者消除过敏原,相关机构已开展了一系列研究[12-13]。
Amandin 是杏仁的主要贮藏蛋白,是一种水溶性蛋白质,属于11S 球蛋白家族[14]。它含有人血清IgE 识别的主要反应多肽,是杏仁的主要过敏原[15]。有研究表明,Amandin 的主要成分为prunin-1(Pru1)蛋白[16]。Pru1 单体由40 kDa 或42 kDa 酸性α 链和20 kDa 碱性β 链组成。这两条链由不同的基因表达,其翻译产物通过修饰后,将两个肽链通过二硫键连接。有研究显示,Amandin 具有较高的热稳定性,其结构中的二硫键对稳定性发挥着重要作用[17-18]。
目前,基于先进的质谱检测技术可以对杏仁过敏原进行准确检测,但其步骤繁琐,耗时费力[19-20]。新兴的多重连接探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)无法满足快速检测的需要,距商业化应用还有一定距离[21]。而对于较为成熟的酶联免疫吸附测定方法(enzyme-linked immunosorbent assay,ELISA)来说,我国对杏仁过敏原Amandin 蛋白的检测研究不多,尤其是市面上的商品化检测试剂盒主要为国外的产品。因此,本研究在获得抗Amandin 蛋白多克隆抗体的基础上,建立相关食物中杏仁过敏原的酶联免疫吸附测定方法,以期为国产杏仁过敏原检测试剂盒的开发提供参考。
1 材料与方法
1.1 材料与试剂
杏仁:产自河北承德;二甲基亚砜(dimethyl sulfoxide,DMSO,99%):德国Merck 公司;脱脂乳粉:美国BD 公司;牛血清白蛋白(bovine serum albumin,BSA,98%)、弗氏完全佐剂、弗氏不完全佐剂、辣根过氧化物酶(horseradish Peroxidase,HRP)-羊抗兔二抗(免疫亲和纯化):美国Sigma 公司;单组份四甲基联苯胺(tetramethylbenzidine,TMB)显色液:湖州英创生物科技有限公司;酶标板:丹麦Nunc 公司;吐温-20(tween-20,99%)、曲拉通X-100(Triton X-100,99%):上海生工生物工程有限公司;氯化钠、磷酸氢二钠、磷酸二氢钠、碳酸钠(均为分析纯):天津渤化化学试剂有限公司;食品样品:市售;花生全蛋白、芝麻全蛋白、核桃JugR1、β-乳球蛋白、酪蛋白、溶菌酶(2000 U/mg2):天津科技大学食品安全研究室提供;大耳白兔:天津市百农实验动物繁育科技有限公司。
1.2 仪器与设备
超纯水系统(Milli-Q):美国Millipore 公司;蛋白纯化仪(AKTA Purifier):美国GE 公司;酶标仪(Infinite M1000 PRO):美国Tecan 公司;离心机(SL16R):美国Thermo 公司;微量可调移液器:美国eppendorf 公司;分析天平(BL610):德国Sartorius 公司;磁力搅拌器(C-MAG):德国IKA 公司;pH 计(PB-10):德国Sartorious公司;电泳仪(JY200C):北京君意东方电泳设备有限公司;凝胶成像系统(QuickGel 6200):北京普迈精医科技有限公司。
1.3 方法
1.3.1 Amandin 蛋白的提取
1.3.1.1 脱脂杏仁粉的制备
采用有机溶剂正己烷去除脂肪[15],取适量杏仁去皮并充分研磨,以料液比1∶10(g/mL)加入正己烷,恒温磁力搅拌脱脂3 h,抽滤弃去有机溶剂,重复脱脂直至有机层澄清透亮。将沉淀置于通风橱过夜,得到脱脂杏仁粉,经过充分研磨后置于-20 ℃保存待用。
1.3.1.2 Amandin 蛋白的提取
Amandin 结合文献[22-23]的方法,通过水提方式获得目标蛋白。取100 g 脱脂杏仁粉加入3 L 蒸馏水,室温下通过磁力搅拌提取蛋白1 h。将混合物低温离心(4 ℃,12 000 r/min,20 min),取上清液。重复1 次上述提取方法,合并2 次离心后的上清溶液,用0.45 μm纤维素膜过滤得到澄清的淡黄色液体,4 ℃放置过夜后低温离心(4 ℃,10 000 r/min,30 min)得到乳白色沉淀。将沉淀溶解于pH7.4 的磷酸盐缓冲液(phosphate buffer saline,PBS)中,蒸馏水室温透析9 h 后得到目标蛋白,分装后-20 ℃保存。
1.3.1.3 Amandin 蛋白的鉴定
采用十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDSPAGE)电泳试验。配制12%分离胶和5%浓缩胶,Amandin 蛋白与上样缓冲液、β-巯基乙醇的体积比为5∶4∶1。将蛋白样品100 ℃沸水浴5 min 后,4 ℃10 000 r/min离心5 min,每孔样品上样量为10 μL,预染Marker 为5 μL。电泳仪设定恒压80 V 跑完浓缩胶后,调整电压至120 V 直至电泳结束。凝胶染色2 h,脱色1 h 后观察凝胶成像结果。
1.3.2 抗Amandin 抗体的制备与纯化
将弗氏佐剂与Amandin 混合后免疫大耳白兔。免疫3 次后耳缘静脉取血测定抗体效价。若效价超过1∶1×105后,取全血并分离血清。将兔子抗血清通过Protein A-Sepharose 4B 亲和层析柱纯化得到多克隆抗体。
1.3.3 间接竞争ELISA检测方法的优化
1.3.3.1 抗原包被浓度和抗体稀释倍数的优化
将Amandin 蛋白分别以浓度为1.000、0.500、0.125 μg/mL 的溶液包被到酶标板上。用1% BSA 封闭后,分别加入稀释1 000、3 000、9 000、27 000、81 000倍的抗体溶液。室温孵育1 h 后,加入HRP-羊抗兔二抗。加入底物显色后,通过吸光值A450选择较为合适的抗原包被浓度和抗体稀释倍数。
1.3.3.2 缓冲液pH 值的优化
将PBS 缓冲液的pH 值分别调到5.7、7.4 和9.5,并用其分别稀释蛋白样品,形成浓度梯度。通过间接竞争ELISA 的方法测定抑制率曲线的IC50值,并据此选取合适的缓冲液pH 值。
1.3.3.3 竞争孵育时间的优化
Amandin 将竞争孵育时间分别限定为30、45、60 min,优化结果通过抑制率曲线的IC50值的大小进行判断。
1.3.3.4 交叉反应测定
选取部分食品过敏原及蛋白进行抗体交叉反应的测定,包括花生全蛋白、芝麻全蛋白、核桃JugR1、β-乳球蛋白、酪蛋白、溶菌酶。通过间接竞争ELISA 方法分别测定6 种蛋白的IC50值,记为a,并与Amandin 蛋白抑制率曲线的IC50值(b)相比,该方法与其他蛋白的交叉反应率(X,%)计算公式如下。
X=b/a× 100
1.3.4 样品处理与基质影响消除
选择不含有杏仁成分的饼干、面包和冰淇淋作为样品。其中饼干和面包分别称取1.0 g 样品,粉碎后加入20 mL 含0.5% 明胶的Triton X-100/PBS 溶液,旋涡振荡2 min 后过滤,滤液可直接用于检测。称取1.0 g 冰淇淋样品,加入19 mL 含0.5%明胶的Tritonx-100/PBS溶液,旋涡振荡2 min,4 ℃、10 000 r/min 离心5 min,取上清液用于检测。
1.3.5 添加回收试验
分别向饼干、面包和冰淇淋样品中加入一定量的Amandin 蛋白,使样品分别含有10、20、40 μg/g Amandin 蛋白。采用1.3.4 的方法处理样品后进行测定,并计算回收率,并以此判断检测方法的准确性。
1.3.6 Amandin 蛋白稳定性测定
将Amandin 蛋白分别置于4 ℃和37 ℃环境中保存。在保存1、3、5 d 和7 d 后,分别取出进行ELISA检测,通过吸光值A450的变化判断蛋白活性是否稳定。
1.4 数据处理
每个样品至少重复测定3 次,取平均值,采用SPSS 16.0 对数据进行处理和分析。
2 结果与分析
2.1 Amandin 蛋白的提取与鉴定
通过SDS-PAGE 电泳对目的蛋白进行鉴定,结果见图1。
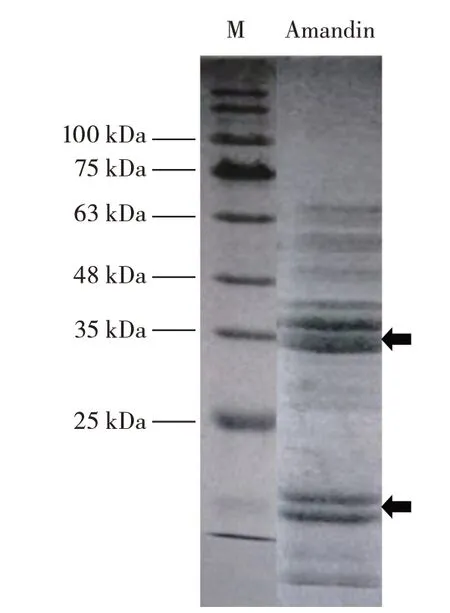
图1 纯化后Amandin 的聚丙烯酰胺凝胶电泳结果Fig.1 SDS-PAGE of purified Amandin
由图1 可知,在40 kDa 和20 kDa 附近有比较深的条带,与文献[12]报道的Amandin 蛋白的酸性α 链和碱性β 链的分子量一致,说明本试验有效地提取出了目的蛋白。同时,其他蛋白条带较浅,说明纯化后还有其他杂蛋白,但目的蛋白含量较高,可以满足后续试验。
2.2 抗原包被浓度和抗体稀释倍数的优化
本研究通过棋盘滴定的方式,选取ELISA 显色结果中吸光值A450为1.0~1.5 所对应抗原包被浓度和抗体稀释倍数为最适参数,如表1所示。

表1 包被抗原浓度和抗体稀释倍数优化结果Table 1 Optimization of coating antigen concentration and antibody dilution fold
由表1 可知,有3 组参数符合要求:包被原浓度为1.000 μg/mL,抗体稀释81 000 倍;包被原浓度为0.500 μg/mL,抗体稀释81 000 倍;包被原浓度为0.125 μg/mL,抗体稀释27 000 倍。在此基础上,本研究选择了IC50值较低的试验组(包被原浓度为0.500 μg/mL,抗体稀释81 000 倍)进行后续试验。
2.3 缓冲液pH 值的优化
试验体系中pH 值的高低将直接关系抗体活性,从而影响检测灵敏度。本研究将缓冲液的pH 值分别调整为5.7、7.4 和9.5。通过间接竞争ELISA 试验,根据抑制率曲线中IC50值大小,选取较为合适的pH 值,结果如图2所示。
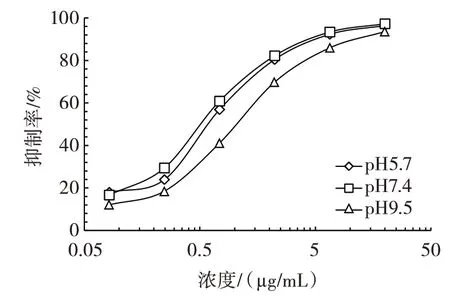
图2 缓冲液pH 值的优化Fig.2 Optimization of buffer pH
由图2 可知,该检测方法在中性(pH7.4)条件下的IC50值最低,弱酸性(pH5.7)与中性接近,这表明该体系对于弱酸环境有一定耐受能力,而碱性(pH9.5)条件对检测灵敏度有一定影响。因此,该方法确定pH 值为7.4。
2.4 竞争孵育时间的优化
不同的竞争孵育时间得到的不同抑制率曲线如图3所示。
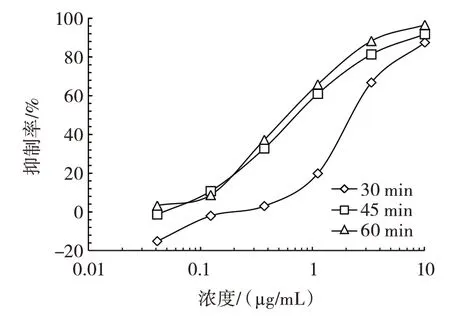
图3 竞争孵育时间的优化Fig.3 Optimization of competitive incubation time
由图3 可知,孵育60 min 的抑制率曲线中,IC50值为0.61 μg/mL,低于孵育45 min 和30 min 抑制率曲线的IC50值。因此,该研究确定的竞争孵育时间为60 min。
2.5 交叉反应率的结果分析
本研究选取6 种食品过敏原及相关蛋白对抗体的交叉反应率进行测定,结果如表2所示。

表2 交叉反应率测定结果Table 2 Cross reaction rate
由表2 可知,6 种蛋白与制备的抗Amandin 抗体交叉反应率均低于0.1%,这表明抗体有较好的特异性,建立的检测方法具有较好的专一性。
2.6 样品基质影响的消除
标准曲线与不同样品的基质曲线对比结果如图4所示。
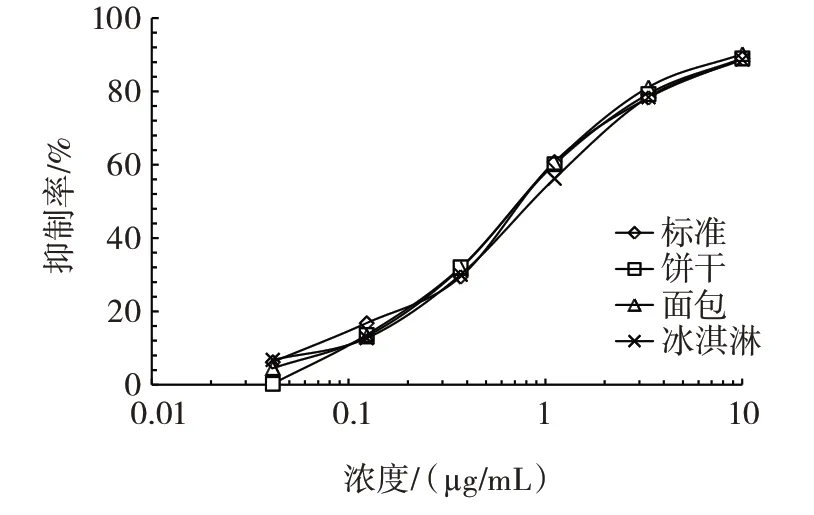
图4 标准曲线与不同样品的基质曲线对比Fig.4 Comparison between standard curve and matrix curves of different samples
在上述试验的基础上,建立了检测Amandin 的间接竞争ELISA 标准曲线,该方法的灵敏度(IC50)为(0.66±0.04)μg/mL,检出限为(0.08±0.04)μg/mL。由图4可知,以0.5% 明胶的triton X-100/PBS 溶液为样品稀释液得到的标准曲线和3 种样品基质曲线的重合性较好,可有效消除样品的基质效应。
2.7 添加回收试验结果分析
检测方法的准确度通过回收率进行评估。通过向不含有Amandin 蛋白的样品中添加一定浓度的目标蛋白,利用已建立的间接竞争ELISA 方法对样品进行处理和检测,根据测定值和理论值之比计算回收率。样品回收率测定结果如表3所示。
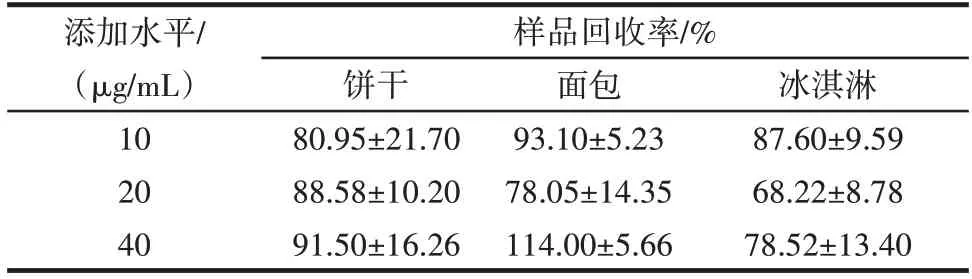
表3 样品回收率测定结果Table 3 Recoveries of samples
由表3 可知,该检测方法的回收率为68.22%~114.00%。
2.8 蛋白稳定性分析
本研究使用的Amandin 蛋白为自行从杏仁样品中提取,其能否长期保存并用于检测,需要通过稳定性测定进行评估,试验结果如图5所示。
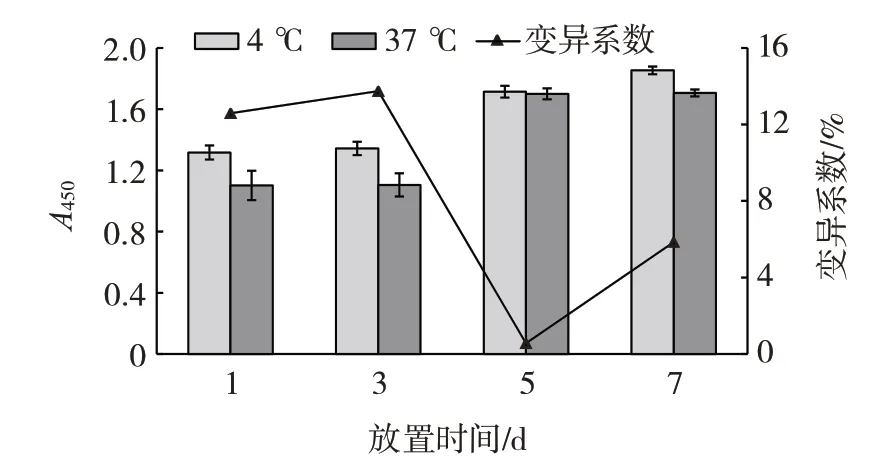
图5 Amandin 蛋白稳定性试验结果Fig.5 Stability of Amandin
由图5 可知,37 ℃和4 ℃分别保存一周后的蛋白性质相差不大,其变异系数均不超过14%,这表明通过提取方法得到的Amandin 蛋白的降解速率较低、热稳定性较好。这对于开发Amandin 检测试剂盒将发挥重要作用,有助于延长试剂盒的货架期。
3 结论
本研究分离纯化了杏仁过敏原Amandin 蛋白,制备了抗Amandin 蛋白多克隆抗体,建立了间接竞争ELISA检测Amandin 蛋白的方法,其灵敏度(IC50)为(0.66±0.04)μg/mL,检出限为(0.08±0.04)μg/mL。该方法对饼干、面包和冰淇淋3 种食品的添加回收率为68.22%~114.00%。本研究为杏仁过敏原Amandin 蛋白的快速检测、开发商业化Amandin 检测试剂盒提供参考。

