高温高压降解制备低分子量水溶性酵母葡聚糖
王寒梅,刘垚,何启煜,赵雪
(中国海洋大学食品科学与工程学院,山东青岛 266003)
酵母是一种单细胞真菌,被广泛应用于发酵产业如生产面包和啤酒等。我国酵母产量较大且其具有丰富的营养[1],目前已经开发出许多新型相关产品如面膜、调味品以及药品等,但大部分仍被作为饲料使用。酵母细胞壁是一种复杂的多层结构,甘露聚糖位于细胞壁外层,葡聚糖位于细胞壁内层[2],酵母葡聚糖的主链是β-(1,3),支链是β-(1,6),其高级结构为三股螺旋的三聚体形式,这种特殊的高级结构使得酵母细胞壁中的葡聚糖是不溶性的[3]。
酵母葡聚糖具有丰富的生物活性,如增强机体免疫能力[4-5]、抗肿瘤[6-7]和抗病毒以及降血压降血脂等生理活性[8-10],β-葡聚糖能增强巨噬细胞的吞噬能力,增加细胞因子的分泌,从而调节全身细胞免疫和体液免疫,发挥抗肿瘤作用[11]。酵母葡聚糖的生物活性与其溶解性密切相关[12-13],酵母葡聚糖的不溶性极大地限制了其在医药、美容等领域的开发应用[14]。水溶性β-葡聚糖通过与Dectin-1 结合从而激活先天免疫和获得免疫[15],且低分子量葡聚糖比高分子量葡聚糖具有更强的增强免疫[16]、抗肿瘤[17]的活性,因此制备水溶性酵母葡聚糖可增加酵母葡聚糖的开发利用范围。目前主要的降解方法有超声降解法[18]、酸降解[19]、酶解法[20]、高压微流态化法[21]等。而化学法多采用强酸强碱或者化学修饰等方法,不仅会破坏酵母葡聚糖原本的结构,且容易对环境造成污染[13,19,22]。Ishimoto 等[23]通过135 ℃热降解葡聚糖制备出大分子量可溶性葡聚糖,但高温加热使得葡聚糖出现严重褐变现象。高温高压降解法操作简便、重复性好,且回收率高,是一种绿色环保的降解方法[24]。但该方法会引起褐变,需要进一步优化,如何探究出通过控制pH 值来制备低分子量水溶性酵母葡聚糖和葡寡糖的最优制备条件目前尚不明确。本研究以啤酒酵母粉为原料,研究高温高压降解制备低分子量水溶性酵母葡聚糖和葡寡糖的工艺,探究温度、pH 值和时间对水溶性酵母葡聚糖得率和分子量的影响,并通过傅里叶变换红外光谱和核磁共振波谱技术(nuclear magnetic resonance spectroscopy,NMR)对其结构变化进行研究,以期为制备低分子量水溶性酵母葡聚糖和葡寡糖提供理论支持。
1 材料与方法
1.1 材料与试剂
啤酒酵母粉:青岛啤酒有限公司。
葡聚糖标准品(重均分子量分别为5 220、11 600、48 600、147 600、273 600 Da):美国Sigma 公司;乙酸、氢氧化钠、无水乙醇、无水溴化钾(均为分析纯):国药集团化学试剂有限公司;D2O(纯度99.9%,25 g):上海麦克林生化科技有限公司);木瓜蛋白酶(80×104U/g)、中性蛋白酶(5×104U/g):北京索莱宝科技有限公司;0.22 μm 滤膜:杉羽科技发展有限公司。
1.2 仪器与设备
1260 型高效液相色谱仪器:美国安捷伦科技公司;Ohpak SB-804HQ(8 mm×300 mm)、TSKgel G3000SWxl(7.8 mm×300 mm):日本Shodex 公司;SX-700 高压灭菌锅:北京天美科技有限公司;PHS-3C 型pH 计:上海仪电科技仪器股份有限公司;DD5 台式大容量离心机:湖南赫西仪器装备有限公司;SCIENTZ 超声波细胞粉碎机:迅特尔科学仪器有限公司;JEOL JNM-ECP 600M 超导核磁共振波谱仪:日本电子公司;NICOLET Is10 傅里叶变换红外光谱仪:美国Thermo Fisher Scientific 公司;ZX11-UV-1000 紫外分光光度计:北京东方化玻科技有限公司。
1.3 试验方法
1.3.1 不溶性酵母葡聚糖的制备
将粗酵母粉用蒸馏水低速离心(3 000×g,10 min)清洗5 次,加蒸馏水配制0.25 g/mL 悬浮液通过超声波细胞粉碎机破碎酵母细胞,程序设定为超声5 s、停5 s,功率450 W。超声结束后加入0.36% 和6.4% 的木瓜蛋白酶和中性蛋白酶水解蛋白质,55 ℃、pH6 条件下水解10 h 后灭活,离心(3 000×g,10 min)取沉淀,用0.5 mol/L NaOH 处理沉淀,80 ℃搅拌2 h,乙酸调节至中性,用蒸馏水洗涤沉淀3 次,无水乙醇洗涤沉淀3 次,空气吹干至恒重,研磨过500 目纱得到不溶性酵母葡聚糖[18]。
1.3.2 高温高压法制备水溶性酵母葡聚糖
用蒸馏水配制5 mg/mL 不溶性酵母葡聚糖悬浮液,放置12 h 使不溶性酵母葡聚糖吸水膨胀,用30%乙酸分别调节pH3、4、5,放入高温高压灭菌锅中,分别在120、135 ℃高温高压降解0.5、1.0、1.5、2.0、4.0、6.0 h,降解产物离心(5 000×g,10 min)取上清液,即为水溶性酵母葡聚糖。
1.3.3 硫酸苯酚法测定多糖含量
1.3.3.1 标准曲线的制作
取一定量的葡萄糖105 ℃烘干至恒重,配制葡萄糖标准液100 μg/mL,取18 支洁净的试管,设置6个浓度梯度,每个浓度做3 个重复,向试管中依次加入0、0.2、0.4、0.6、0.8、1.0 mL 的葡萄糖标准溶液,加水补足至1 mL,然后向每支试管中加入1 mL 6% 苯酚和5 mL 浓硫酸,振荡均匀,沸水浴20 min 后冷却至室温,在紫外分光光度计上480 nm 处测定吸光度[25]。
1.3.3.2 不溶性酵母葡聚糖的多糖含量的测定
精密称取10 mg 酵母样品,加入3 mL 12 mol/L 的硫酸中,振荡混匀,室温下水解3 h,然后,向试管中加入15 mL 的去离子水,使水解的硫酸的浓度为2 mol/L,混匀后,在烘箱100 ℃水解4 h,冷却至室温后,将试管中的样品溶液定容至250 mL,配成待测液。按照标准曲线的方法,在试管中依次加入待测液、去离子水、6%的苯酚各1 mL,加入5 mL 的浓硫酸后,沸水浴20 min,冷却至室温后测定其吸光度(OD480)。
1.3.3.3 水溶性酵母葡聚糖多糖含量的测定
取1 mL 上清液加入6%苯酚1 mL、5 mL 浓硫酸。沸水浴20 min 后,测定吸光度(OD480)。
1.3.4 蛋白质含量的测定
参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中凯氏定氮法测定蛋白质含量。
1.3.5 高效分子排阻凝胶色谱分析降解产物的分子量测定
不溶性酵母葡聚糖降解产物用0.1 mol/L Na2SO4溶解成5 mg/mL 溶液,过0.22 μm 滤膜后,采用高效分子排阻凝胶色谱(high performance size exclusion chromatography,HPSEC)进行分子量分析[26]。高效液相色谱仪为 Agilent 1260,分析柱为 Ohpak SB - 804HQ(8.0 mm×300 mm)和色谱柱 TSKgel G3000SWxl(7.8 mm×300 mm),流动相为0.1 mol/L Na2SO4,流速为0.5 mL/min,柱温为30 ℃,进样量为20 μL,示差检测器检测。使用分子量为5 220、11 600、48 600、147 600、273 600、273 600 Da 的葡聚糖作为标准品,以葡聚糖标准品分子量的对数(lgM)为Y轴和保留时间(tR)为X轴作图,得到回归曲线方程为Y=-0.329 5X+10.349(R2=0.998 1)。根据标准曲线计算样品分子量。
1.3.6 酵母葡聚糖的红外光谱分析
将0.5 mg 酵母葡聚糖与150 mg 无水溴化钾混合,并在干燥条件下压制成片。使用傅里叶变换红外光谱仪,以2 cm-1的数据采集速率记录多糖的傅里叶变换红外光谱(Fourier transform infrared spectrum,FTIR),范围为4 000~400 cm-1。
1.3.7 NMR 分析水溶性酵母葡聚糖结构
将不同条件下降解的水溶性酵母葡聚糖透析后冻干,取15 mg 样品用500 μL D2O 反复冻融3 次后,用500 μL D2O 溶解,于25 ℃下测试其1H NMR、13C NMR。
1.3.8 水溶性酵母葡聚糖得率和产率计算
水溶性酵母葡聚糖得率(M,%)计算公式如下。
式中:ω1为不溶性酵母葡聚糖含量,%;ω2为水溶性酵母葡聚糖含量,%。
水溶性酵母葡聚糖产率(C,%)计算公式如下。
C=a/b× 100
式中:a为纯化葡聚糖质量,g;b为酵母粉质量,g。
1.4 统计分析
试验数据结果均以平均值±标准差形式表示。根据多糖出峰时间及峰面积,利用Origin 2018 计算多糖分子量及相对含量,根据多糖的氢谱和碳谱,通过MestReNova 软件标定多糖化学位移,并计算各峰面积。
2 结果与分析
2.1 酵母葡聚糖的提取纯化
酵母葡聚糖分离过程中各组分的产率和组成见表1。

表1 葡聚糖分离过程中各组分的产率和组成Table 1 Yields and compositions of components of glucan during separation%
由表1所示,该酵母粉中多糖含量占43.67%,蛋白质含量占42.08%。经过酶水解处理后,获得的葡聚糖中多糖含量为72.72%,蛋白质含量为19.45%;经过0.5 mol/L NaOH 弱碱处理后,葡聚糖纯度得到明显提升,多糖含量可达95.43%,蛋白质含量下降至4.60%。颜色为灰白色,产率为14.75%。说明通过酶解处理和弱碱处理可以明显提高不溶性酵母葡聚糖的纯度。
2.2 0.1 MPa 高温降解条件对水溶性酵母葡聚糖得率的影响
将不溶性酵母葡聚糖5 mg/mL 浓度悬浮在水中,在120、135 ℃下降解后,采用硫酸苯酚法测得水溶性酵母葡聚糖得率。不同温度、pH 值和时间条件下降解葡聚糖获得的水溶性酵母葡聚糖得率见表2。

表2 不同温度、pH 值和时间对水溶性酵母葡聚糖得率的影响Table 2 Effects of different temperature,pH,and time on yield of water-soluble glucan
由表2 可知,在120 ℃,pH3、4、5 条件下降解0.5、1.0、1.5 h,随着pH 值降低、降解时间延长,水溶性酵母葡聚糖得率逐渐提高,但是在pH3、1.5 h 条件下,得率依然低于20%,说明120 ℃条件下不溶性酵母葡聚糖降解率很低。而在135 ℃时,在同样的温度和时间条件下,水溶性酵母葡聚糖得率超过20%。说明水溶性葡聚糖降解需要135 ℃高温降解。在135 ℃条件下,水溶性酵母葡聚糖得率随着pH 值的降低而增加,pH5和pH4 条件下水溶性酵母葡聚糖得率低于pH3。pH3时,降解2.0 h 时水溶性酵母葡聚糖得率上升到71.25%,再延长降解时间到6.0 h,水溶性葡聚糖得率仅仅上升到79.89%。在pH5 时,4.0 h 之内水溶性葡聚糖的得率不足50%,但是时间延长到6.0 h,水溶性葡聚糖的得率升高到77.83%。说明在pH4 和pH5时,延长降解时间,也可以提高水溶性葡聚糖得率。
2.3 高温高压降解条件对水溶性酵母葡聚糖分子量分布的影响
HPSEC 法仅能分析获得水溶性酵母葡聚糖的分子量,根据水溶性酵母葡聚糖的吸收峰面积,还可以比较出水溶性酵母葡聚糖的含量差异。图1 为135 ℃不同pH 值和时间条件下获得的水溶性酵母葡聚糖分子量,表2 为135 ℃不同pH 值和时间条件下的降解产物分子量分布。
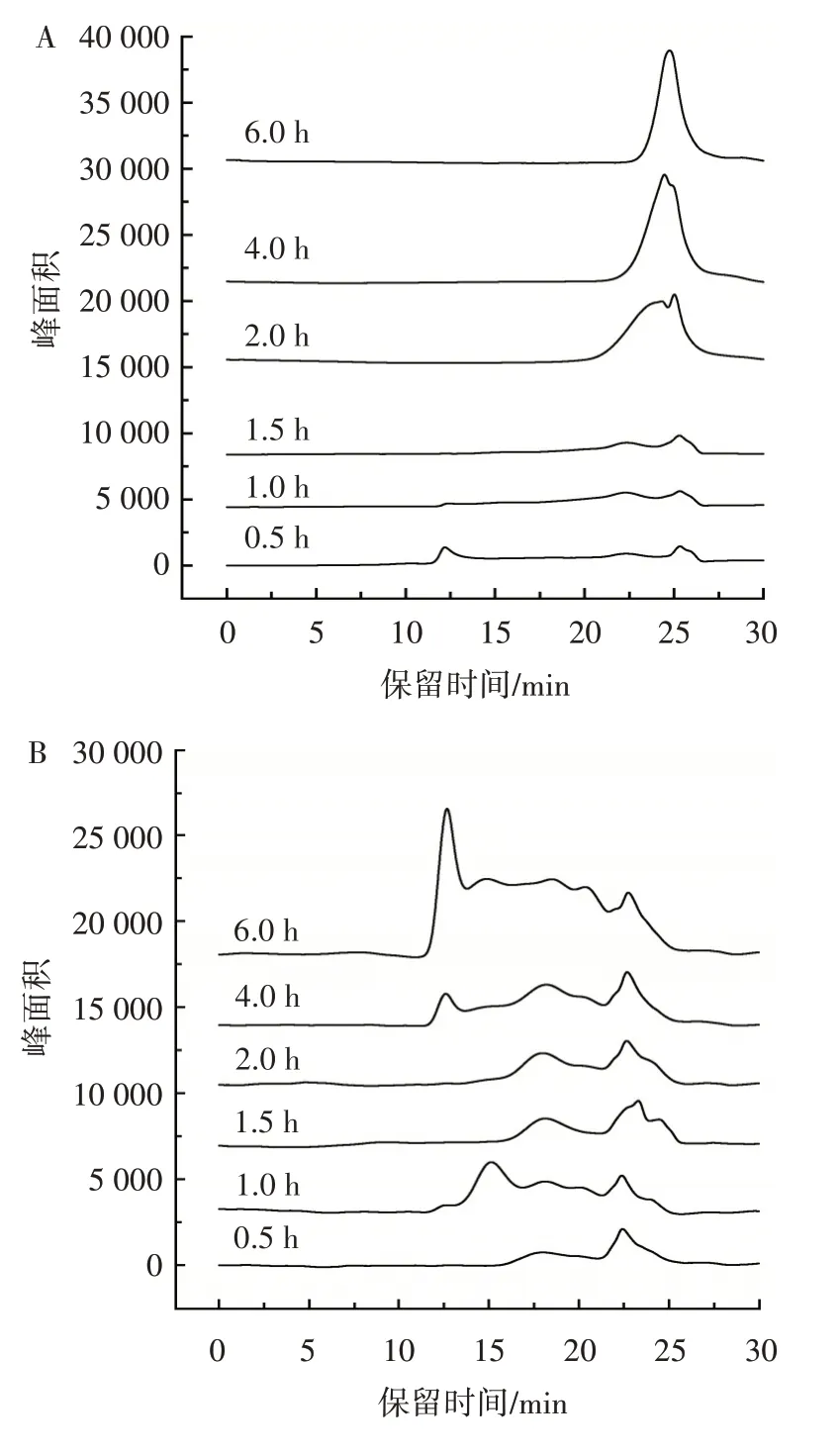
图1 HPSEC 分析135 ℃不同pH 值和时间对水溶性酵母葡聚糖分子量的影响Fig.1 HPSEC analysis of the effect of different pH and time on molecular weight of water-soluble glucan at 135 ℃
由表3 可知,在135 ℃条件下,随着降解时间的延长,峰面积逐渐增大,说明上清液的多糖含量逐渐提高,这一结果与硫酸苯酚法测定得率结果相符。

表4 不同降解条件下β-(1,3)和β-(1,6)的比例积分Table 4 Proportional integrals of β-(1,3)and β-(1,6)under different degradation conditions
在pH5 条件下降解0.5~4.0 h 时,仅有少量分子量大于30 kDa 和小于1 kDa 的水溶性酵母葡聚糖溶出。当时间延长至6.0 h 后,从0.2~2 000 kDa 水溶性酵母葡聚糖大量产生,水溶性酵母葡聚糖的得率显著增加,且分子量分布较广。在pH4 条件下,降解1.0 h 时就有0.6~300 kDa 的多糖溶出,降解4.0~6.0 h 已经有0.2~2 000 kDa 的水溶性酵母葡聚糖大量产生,葡聚糖分子量分布比较广。6.0 h 时葡聚糖产率最高。pH 3 条件下降解1.5 h 之后,5 kDa 以下水溶性酵母葡聚糖产生,继续降解至4.0 h 和6.0 h,无高分子量葡聚糖产生,只有分子量2~4 kDa 的低分子量水溶性酵母葡聚糖产生,说明pH3 条件剧烈,导致大分子葡聚糖发生降解,使得在pH3 条件下获得的水溶性酵母葡聚糖分子量较小,因此135 ℃、pH3 时是获得分子量小于5 kDa 葡寡糖的最佳条件。Ishimoto等[23]通过加热至135 ℃降解不溶性酵母葡聚糖,但是所需时间长,仅能获得大分子量水溶性酵母葡聚糖,且易发生褐变,而本研究通过高温高压控制pH 值的方法可以得到纯白的低分子量葡聚糖和葡寡糖。因此,综合水溶性酵母葡聚糖得率与分子量的结果,选择135 ℃、pH3条件下降解0.5 h 和2.0 h、pH4 条件下降解2.0 h 和6.0 h、pH5 条件下降解2.0 h 和6.0 h 这6 个条件进行葡聚糖的结构表征,以探究高温高压降解对其结构的影响。
2.4 水溶性酵母葡聚糖的红外结果分析
傅里叶变换红外光谱是检测生物大分子结构变化的有效方法,对高温高压降解前后的葡聚糖样品进行红外光谱分析,红外光谱结果如图2所示。

图2 降解前后酵母葡聚糖的红外光谱Fig.2 Infrared spectra of yeast glucan before and after degradation
由图2 可知,3 389 cm-1处为多糖的羟基伸缩振动,2 983 cm-1处为糖类的特征峰C—H 伸缩振动,1 646 cm-1处为C—O 伸缩振动,降解产物与不溶性酵母葡聚糖相比,该峰吸收强度大幅度减小,可以看出高温高压降解是通过断裂其糖苷从而减小酵母葡聚糖分子量。1 373 cm-1处为C—H 的变角振动,是糖类的特征吸收峰,1 160、1 078、1 036 cm-1处吸收峰为C—O—C 非对称伸缩振动、C—OH 伸缩振动和C—O、C—C伸缩振动[27]。892 cm-1处的吸收峰证明其为β-葡聚糖[28]。不同降解条件下样品和水溶性酵母葡聚糖的红外光谱结果十分相似,表明葡聚糖虽然经过降解后分子量发生了改变,但未影响其主要官能团。
2.5 水溶性酵母葡聚糖NMR 分析
对不同条件下降解的水溶性酵母葡聚糖进行1H NMR 和13C NMR 分析见图3 和表3。
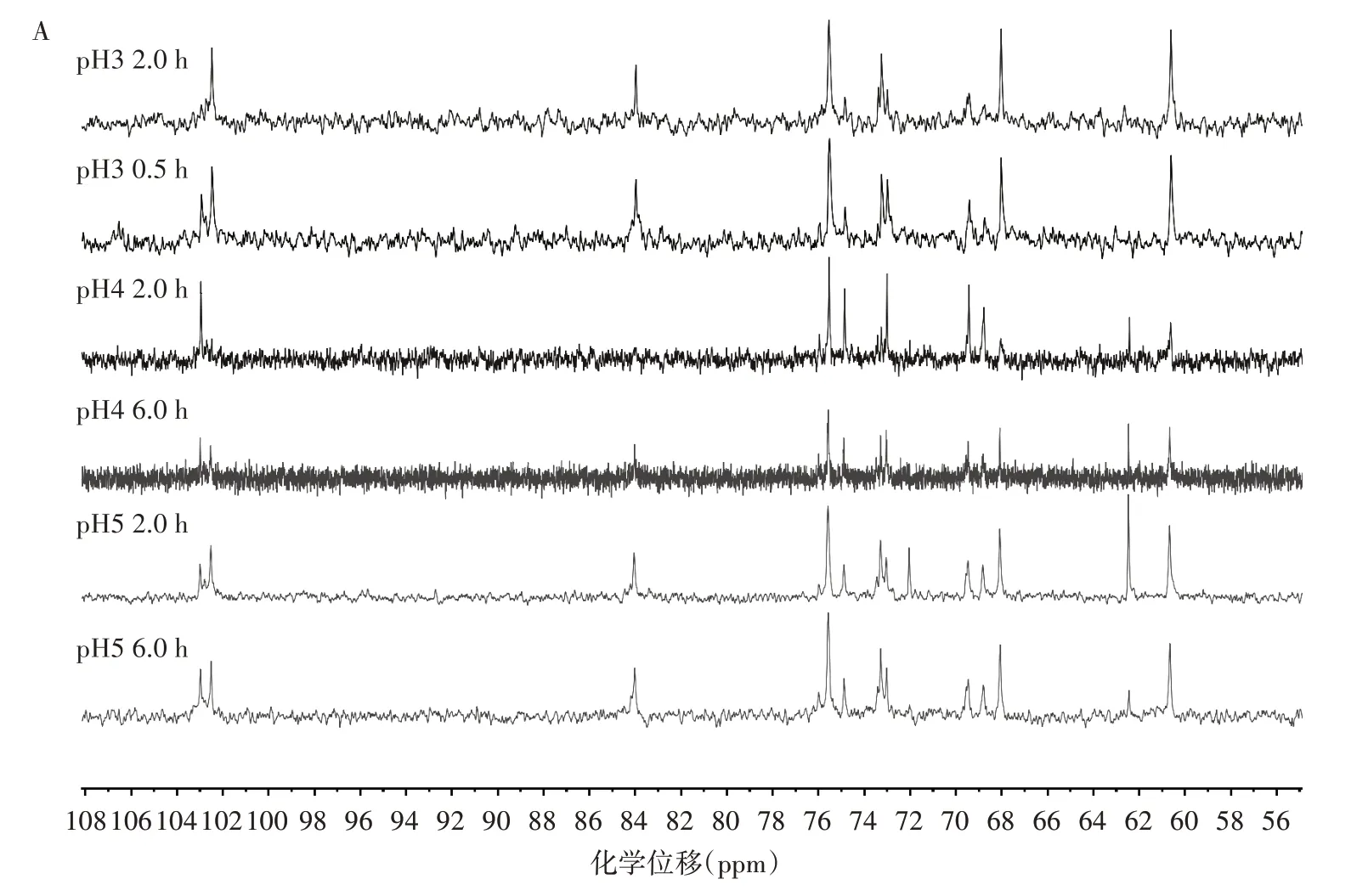
图3 酵母葡聚糖的NMR 谱图Fig.3 NMR spectra of yeast glucan
如图3A所示,C-1 峰化学位移在102~103,且图3B 中H-1 特征峰化学位移在4.5~4.8,可以判断出葡聚糖的糖苷键构型为β 型[29-30]。在1H 谱中4.2~4.3 归属为侧链β-(1,6)链接的H-1 特征峰[31],可以看出降解前后的葡聚糖主要类型为β-(1,3)链接。根据4.5~4.8 的β-(1,3)链接的H-1 与4.2~4.3 之间的β-(1,6)链接的H-1 峰面积可大致计算出β-(1,6)链接的比例,如表3所示,不同降解条件β-(1,3)和β-(1,6)的比例积分在0.5~1.0 之间,这一结果与Ishimoto 等[23]结论一致。pH 值越低,比值越小,β-(1,6)葡聚糖支链所占比例下降,说明在降解过程中,部分β-(1,6)葡聚糖被降解。pH 值越低,β-(1,6)葡聚糖降解损失越多。对图3A碳谱中的峰进行归属,发生取代的C-3 向低场偏移,特征峰位于83.99 处[32],化学位移73.26、68.04、75.57、60.63 处观察到的化学键分别归属于β-(1,3)-D-葡聚糖的C-2、C-4、C-5 和C-6[33-34]。而68~70 为β-(1,6)-D-葡聚糖链接的单元上的C-6,其中69.54 处为与β-(1,3)主链直接链接的β-(1,6)-D-葡聚糖上的C-6[35]。
3 结论
酵母葡聚糖具有丰富的生物活性,本研究以啤酒酵母粉为原料通过超声辅助酶法结合弱碱处理,制备出纯度高达95.43%、产率14.75% 的灰白色不溶性酵母葡聚糖。探究高温高压降解制备水溶性啤酒酵母葡聚糖和葡寡糖的降解条件,结果表明在120 ℃条件下增溶效果不明显,在135 ℃条件下,pH 值在3~5 之间降解0.5~6.0 h 可以有效地降解不溶性酵母葡聚糖,定向制备水溶性酵母葡聚糖和葡寡糖,高温高压降解在135 ℃,pH3 降解3.0~6.0 h,主要得到葡寡糖,得率可达79.89%。pH5 条件下降解4.0~6.0 h,pH4 降解1.0~6.0 h,有0.2~2000 kDa 的高分子量的水溶性酵母葡聚糖大量产生。傅里叶变换红外光谱和核磁共振波谱结果发现,高温高压热降解后该葡聚糖仍以β-(1,3)为主链、以β-(1,6)为支链,但是pH 值越低,β-(1,6)为支链含量越低。本方法制备出水溶性酵母葡聚糖和葡寡糖,可以获得颜色纯白且纯度较高的水溶性酵母葡聚糖。
研究结果证明,高温高压热降解法绿色环保,操作简单可控,适用于工业化生产,且不会破坏其原本结构,可为酵母葡聚糖的开发利用提供技术参考。

