细胞膜通透性对大黄欧文氏菌异麦芽酮糖产率的影响
李晓亚,吴甜甜,王洪玲,葛文沛,刘娜
(河南工业大学生物工程学院,河南郑州 450001)
近年来,低热量、低糖食品逐渐成为消费趋势。摄入的糖分过高会在体内转化为脂肪,导致发胖,甚至引起高血脂、高血压、糖尿病等疾病。因此,肥胖、糖尿病和龋齿等问题使消费者对蔗糖替代品的需求升高。有研究表明,低糖、低热量的饮食方式不仅能改善高血脂症状,降低机体患糖尿病、心血管疾病的风险[1],还有助于维持长时间的饱腹感和持续的能量释放,从而进一步对身体和精神状况产生积极影响,这使功能性甜味剂得到广泛关注[2]。异麦芽酮糖(6-O-α-D-吡喃葡糖基-D-呋喃果糖)又名帕拉金糖,是蔗糖的一种同分异构体,1957年由威登·哈根和洛伦兹首次发现[3-4],除具有与蔗糖类似的物理性质和口感外,还有低热量、不致龋、不吸湿、耐酸解的特点[5],其甜度约为蔗糖的50%,适合作为蔗糖的替代品[6]。已有国家将异麦芽酮糖认证为公认安全级食品[7],可防止脂肪过量积累[8],食用后不会引起血糖与胰岛素的迅速上升,有助于糖尿病的防治[9-10]。异麦芽酮糖作为功能型甜味剂,越来越广泛地应用于食品与医疗行业。
异麦芽酮糖天然存在于甜菜、糖蜜和糖浆等食物中,但其含量微乎其微,提取困难,无法满足市场的需求[11]。目前,异麦芽酮糖的主要来源是以微生物转化法为主。大黄欧文氏菌(Erwiniarhubarb)DXW-62 中的蔗糖异构酶(α-葡糖基转移酶,sucrose isomerase,简称SIase,EC 5.4.99.11)可以将蔗糖异构为异麦芽酮糖,但该酶为胞内酶[8,12]。改变DXW-62 的细胞膜通透性有利于蔗糖与蔗糖异构酶的接触,从而提高蔗糖异构酶的催化效率。超声波可以提高细胞膜的通透性,经超声波作用后的细胞膜对钾和钙离子的通透性会发生较大的改变[13]。从而增强生物膜的弥散性,促进物质交换,加速代谢,改善组织营养。吐温-80 是一种亲水性的表面活性剂,具有很强的破坏细胞膜的作用,也是一种油/水型乳化剂,可用作稳定剂、扩散剂、抗静电剂、纤维润滑剂等[14]。丙酮和甲苯可使细胞膜的磷脂结构受到破坏,从而改变细胞膜的透过性,再经提取可使膜结合酶或胞内酶等释放到胞外。因此,本研究利用超声波、吐温-80、丙酮和甲苯等处理方法改变大黄欧文氏菌DXW-62 细胞膜通透性,加快蔗糖异构酶的催化效率,进而提高异麦芽酮糖产率,以期为异麦芽酮糖的工业化生产提供参考。
1 材料与方法
1.1 菌种及培养基
大黄欧文氏菌DXW-62:河南工业大学生物工程学院实验室保存。
固体培养基:蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L,琼脂15 g/L。
种子培养基:蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L,蔗糖40 g/L。
液体培养基[15]:蛋白胨5 g/L,牛肉膏3 g/L,磷酸氢二钠3 g/L,蔗糖80 g/L。
以上培养基均在115 ℃,30 min 条件下进行灭菌处理。
1.2 主要试剂
异麦芽酮糖标准品:北京沃凯生物科技有限公司;吐温-80:天津市光复精细化工研究所;乙腈(色谱级)、丙酮、甲苯、磷酸二氢钠、柠檬酸(均为分析纯):天津市科密欧化学试剂有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)、碘化丙啶(100 μg/mL):武汉塞维尔生物科技有限公司;蔗糖、氯化钠(均为分析纯)、蛋白胨(生物试剂)、牛肉膏(生物试剂)、琼脂(生化试剂):北京奥博星生物技术有限责任公司。
1.3 主要仪器与设备
BXM-30R 立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;KYC-100B 恒温培养摇床:上海新苗医疗器械制造有限公司;LC-2030C 高效液相色谱仪(检测器为示差折光检测器):日本岛津公司;HWQ-280 恒温培养箱:宁波市科技园区新江南仪器有限公司;DZKW-S-4 电热恒温水浴锅:北京市永光明医疗仪器有限公司;UV-3100PC 紫外可见分光光度计:上海美普达仪器有限公司;Revolve FL 荧光显微镜:美国Echo Laboratories 公司。
1.4 方法
1.4.1 菌株发酵液中生长曲线的建立
比浊法测菌液OD600:将种子培养基按5%的接种量接于发酵培养基,6.0~16.0 h 定时取样,每次取样取3 个平行。加入10 mL 浓度为70%蔗糖溶液中,混匀并在40 ℃、180 r/min 摇床中反应2.0 h,分别以培养时间为横坐标,OD600和异麦芽酮糖产率为纵坐标,绘制菌株生长曲线[16]。
1.4.2 异麦芽酮糖标准曲线的绘制
将异麦芽酮糖配制成0.25、0.50、0.75、1.00、1.25 mg/mL 的标准液,过0.22 μm 的水系滤膜,通过高效液相色谱(high performance liquid chromatography,HPLC)法测定其峰面积,通过各浓度对应的峰面积绘制标准曲线[17]。检测条件:ZORBAX 碳水化合物分析柱(4.6 mm×250 mm,5 μm);流动相为乙腈∶水=80∶20(体积比),流速1.0 mL/min,柱温30 ℃,进样量10 μL,运行时间20 min。
1.4.3 细胞膜的通透性处理
将大黄欧文氏菌DXW-62 接种到固体培养基中过夜,取DXW-62 接种于种子培养基中,30 ℃,180 r/min中振荡反应10.0 h 至对数期(OD600为0.60±0.05)。按5% 的接种量接入100 mL 液体培养基,反应10.0 h 得到发酵液。
超声波处理:将上述发酵液继续反应2.0 h 后置于冰水浴中进行超声波处理。超声波的作用参数:变幅杆6,频率25 kHz,功率分别为45、90、135、180、225、270 W,时间1 min。取超声波处理后的发酵液于4 ℃、9 000×g条件下离心10 min,收集菌体,用去离子水重悬清洗3 次,加入10 mL 浓度为70% 蔗糖溶液中,混匀并在40 ℃、180 r/min 摇床中反应,每隔0.5 h 取1 mL 发酵液于沸水浴5 min 灭酶以终止反应。反应结束后,以相同条件离心反应混合物,上清液稀释5 倍后经0.22 μm 滤膜过滤,采用HPLC 法测定异麦芽酮糖含量[18],以未经超声波处理的发酵液为空白对照组。
吐温-80 处理:向发酵液中加入体积分数分别为0.5%、1.0%、2.0%、3.0%、4.0%、5.0%和6.0%的灭菌吐温-80 后继续反应2.0 h,后续测定异麦芽酮糖含量的操作同上。
丙酮或甲苯处理:向发酵液中分别加入丙酮和甲苯,丙酮或甲苯在发酵液中的体积比分数分别为0.5%、1.0%、2.0%、3.0% 和4.0%,继续反应2.0 h,后续测定异麦芽酮糖含量的操作同上。
超声波和吐温-80 共同处理:以90 W 超声波和体积分数为5.0% 的吐温-80 共同处理DXW-62,后续测定异麦芽酮糖含量的操作同上。异麦芽酮糖产率(y,%)的计算公式如下。
y=a/b× 100
式中:a为测得的反应体系中异麦芽酮糖含量,g;b为反应体系蔗糖质量,g。
1.4.4 细胞膜通透性的测定
检测细胞膜通透性的方法用碘化丙啶(propidium iodide,PI)染色法[19-20]。取1 mL 菌液,在4 ℃、8 000×g条件下离心10 min 去上清液,用PBS 清洗2 次后放入孔板。将100 μg/mL 的PI 染液用PBS 稀释20 倍,配制成终浓度为5 μg/mL 的PI 染色工作液,向孔板内加入适量PI 染色液覆盖细胞,室温避光孵育10 min。孵育后弃去染色液,加入PBS 覆盖细胞,用荧光显微镜观察细胞是否呈现红色荧光。PI 不能穿透完整细胞膜,死细胞或凋亡晚期细胞的核呈红色荧光。
1.5 数据分析
所有测定均设计3 次平行。使用Origin 2021 软件对数据进行分析作图。
2 结果与分析
2.1 异麦芽酮糖标准曲线
根据0.25、0.50、0.75、1.00、1.25 mg/mL 异麦芽酮糖浓度和所对应的峰面积绘制标准曲线,如图1所示,线性方程为y=14 883x- 5 998.9,R2=0.999 4,相关性良好。

图1 异麦芽酮糖标准曲线Fig.1 Standard curve of isomaltulose
2.2 发酵液的菌体浓度及异麦芽酮糖产率
在6.0~16.0 h 内,定时取样检测菌体浓度和异麦芽酮糖产率,结果见图2。
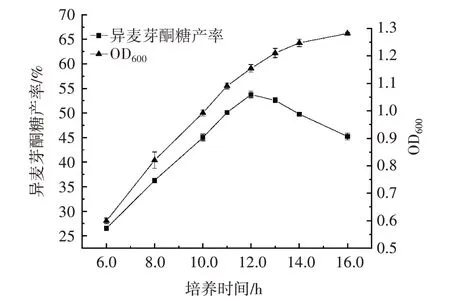
图2 发酵液的菌体浓度及异麦芽酮糖产率Fig.2 Cell concentration and isomaltulose yield of fermentation broth
由图2 可知,在6.0~12.0 h 内,异麦芽酮糖产率和菌体浓度随培养时间的延长而上升,在12.0 h 时异麦芽酮糖产率已达到最高,为53.76%;超过12.0 h 后异麦芽酮糖产率逐渐下降,菌体浓度随着培养时间的延长增加缓慢。这说明随着培养时间的延长,菌株迅速繁殖,异麦芽酮糖产率逐渐上升,但是培养时间过长,培养基内的营养物质被大量消耗,菌体生长繁殖受限[15],异麦芽酮糖产率下降,在培养16.0 h 时异麦芽酮糖产率下降至45.23%。
由于吐温-80、丙酮和甲苯是有机试剂,需要与菌体接触反应2.0 h 才能测定异麦芽酮糖产率。综上所述,在培养12.0 h 时异麦芽酮糖产率最高,使用超声波处理菌体;在培养10.0 h 时,菌株生长速度最快,分别添加吐温-80、丙酮和甲苯到培养基中。
2.3 不同超声功率对异麦芽酮糖产率的影响
不同超声功率对异麦芽酮糖产率的影响见图3。

图3 不同超声功率对异麦芽酮糖产率的影响Fig.3 Effect of ultrasonic waves with different power on isomaltolose yield
由图3 可知,与对照组相比,采用不同功率的超声波处理条件均可提高异麦芽酮糖产率。当时间为2.0 h,对照组的异麦芽酮糖产率为54.47%,同时超声功率为45 W 时,异麦芽酮糖产率为65.03%;超声功率为90 W 时,异麦芽酮糖产率为72.30%。超声功率为270 W 时,异麦芽酮糖产率为61.07%,比对照组高12.12%。这是由于低功率超声波可以使细胞短时局部破裂,改变细胞膜的通透性,使胞内物质释放或胞外物质进入细胞内,从而使异麦芽酮糖产率上升。但是随着超声功率的增大,对细胞破坏程度加大,使胞内物质释放导致细胞失活,戴传云等[21]也验证了低功率超声波可以导致细胞的非热生物效应,使细胞表面瞬间造成微伤,改变细胞膜通透性,从而使代谢产物或营养物质快速通过细胞膜,提高代谢产物的产率。
因此,最佳的处理条件为超声功率90 W,相对于对照组,异麦芽酮糖产率达到80.0% 以上的时间由4.0 h 缩短为3.0 h。
2.4 吐温-80 对异麦芽酮糖产率的影响
不同浓度的吐温-80 对异麦芽酮糖产率的影响见图4。
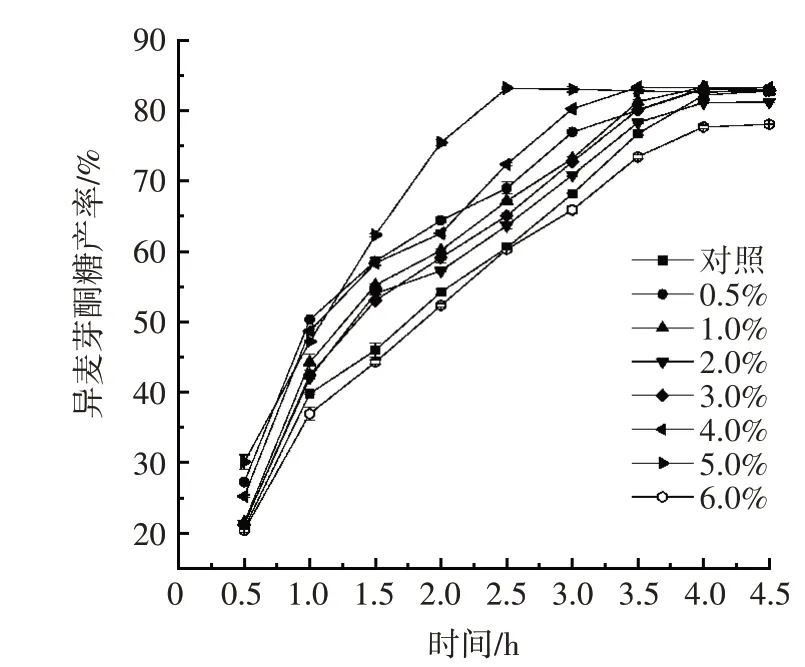
图4 不同浓度的吐温-80 对异麦芽酮糖产率的影响Fig.4 Effect of tween-80 with different concentrations on isomaltolose yield
由图4 可知,只有浓度为6.0%的吐温-80 处理过后,异麦芽酮糖产率低于对照组。当时间为2.5 h 时,对照组的异麦芽酮糖产率为60.53%;浓度为2.0% 的吐温-80 反应2.5 h 时异麦芽酮糖的产率为63.65%,与对照组相比高5.15%;浓度为5.0% 的吐温-80 反应2.5 h 时异麦芽酮糖的产率为83.14%,与对照组相比高37.35%;浓度为6.0%的吐温-80 反应2.5 h 时,异麦芽酮糖产率低于对照组,只有60.29%。可以合理推测低浓度的吐温-80 对细胞产酶有明显的促进作用,浓度过高时对细胞产酶有明显的抑制作用。原因是吐温-80为非离子型表面活性剂,可以将脂类溶解来改变细胞膜通透性[22],能够有效提高异麦芽酮糖产率。综上,选用浓度为5.0%的吐温-80 作为处理条件。
2.5 丙酮对异麦芽酮糖产率的影响
不同浓度的丙酮对异麦芽酮糖产率的影响见图5。
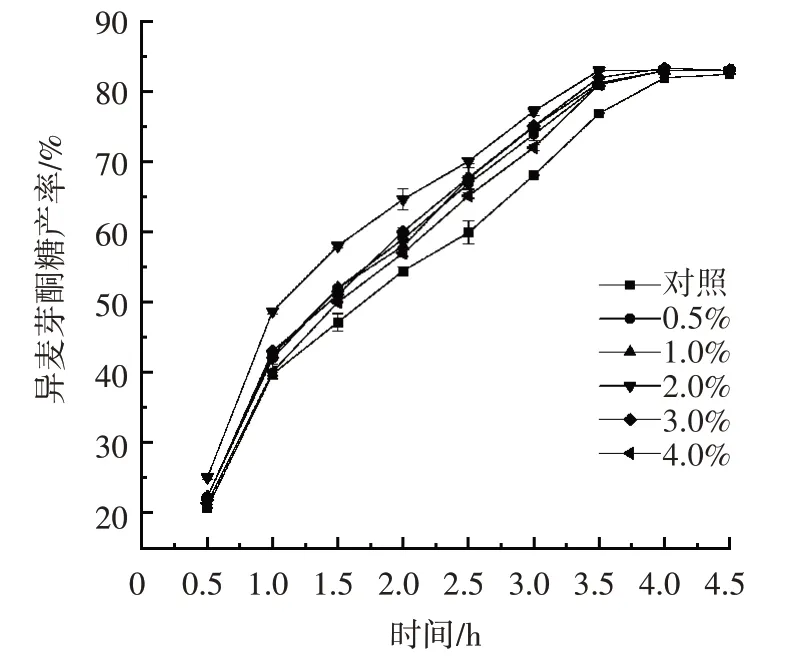
图5 不同浓度的丙酮对异麦芽酮糖产率的影响Fig.5 Effect of acetone with different concentrations on isomaltolose yield
如图5所示,所有浓度的丙酮处理均可使大黄欧文氏菌DXW-62 的异麦芽酮糖产率提高。当时间为3.5 h 时,对照组的异麦芽酮糖产率为76.90%;添加浓度为0.5% 的丙酮反应3.5 h 时异麦芽酮糖产率为81.01%,比对照组高5.34%。添加浓度为2.0%的丙酮反应3.5 h 时异麦芽酮糖产率为83.04%,比对照组高7.98%。添加浓度为4.0%的丙酮反应3.5 h 时异麦芽酮糖产率为81.02%,比对照组高5.36%。这是由于丙酮可以破坏脂质双层结构,使细胞内物质暴露在外部环境中,所以添加少量的丙酮可以增大细胞膜通透性[23],提高异麦芽酮糖产率。但是与功率为90 W 超声波和添加浓度为5.0% 的吐温-80 处理相比,浓度为2.0%的丙酮对异麦芽酮糖产率提高较少。综上,应用浓度为2.0%的丙酮处理大黄欧文氏菌DXW-62。
2.6 甲苯对异麦芽酮糖产率的影响
不同浓度的甲苯对异麦芽酮糖产率的影响见图6。

图6 不同浓度的甲苯对异麦芽酮糖产率的影响Fig.6 Effect of toluene with different concentrations on isomaltulose yield
由图6 可知,不同浓度的甲苯对异麦芽酮糖产率有很大影响。在3.5 h 时对照组的异麦芽酮糖产率为76.90%;添加浓度为0.5% 的甲苯反应3.5 h 时,异麦芽酮糖产率为77.44%;添加浓度为1.0% 的甲苯反应3.5 h 时,异麦芽酮糖产率为77.52%;添加浓度为2.0%的甲苯反应3.5 h 时,异麦芽酮糖产率为72.41%,此时产率已经比对照组低,继续用浓度为3.0%和4.0%甲苯处理,异麦芽酮糖产率相比于对照组越来越低。由此可知低浓度甲苯处理对菌体细胞影响较小,能够小幅度提高异麦芽酮糖产率,而高浓度甲苯能够溶解大黄欧文氏菌DXW-62 细胞膜,导致细胞膜破损使细胞失活,所以异麦芽酮糖产率下降,刘晓艳等[14]的研究也表明了甲苯对细胞膜的损伤较大。综上所述,添加浓度为1.0%的甲苯作为处理条件最佳。
2.7 超声波与吐温-80 共同处理对异麦芽酮糖产率的影响
90 W 功率的超声波和浓度为5.0% 的吐温-80 共同处理大黄欧文氏菌DXW-62,结果如图7所示。
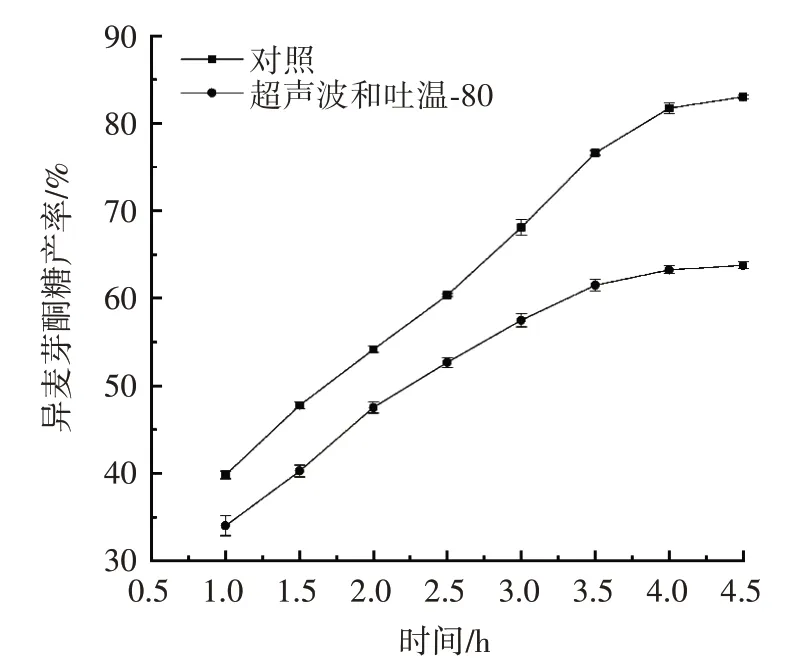
图7 超声波和吐温-80 共同作用对异麦芽酮糖产率的影响Fig.7 Effect of ultrasound wave and tween-80 on isomaltulose yield
图7 结果表明,经过超声波与吐温-80 的共同作用后,并未提高异麦芽酮糖产率,产率最大为63.75%,此时对照组麦芽酮糖产率为82.99%,试验组与对照组相比低23.18%。这是因为采用超声波和吐温-80 共同处理对细胞的破碎程度更大,导致细胞失活。经过超声波和吐温-80 共同处理后的细胞破损程度太大,从而使细胞失活,导致异麦芽酮糖产率降低。
2.8 经PI 染色法后的荧光显微镜观察结果
PI 染色结果如图8所示。

图8 PI 染色法的荧光显微镜观察结果Fig.8 Observation results of fluorescence microscope by PI staining method
由图8 可知,对照组极少细胞被PI 染色;浓度为5.0% 的吐温-80 处理后细胞显红色荧光细胞数量比90 W 功率超声波处理后的数量多;然后吐温-80 和超声波共同作用下,显红色荧光细胞数量明显多于其余单因素处理。
显红色荧光细胞数量越多,细胞膜通透性越强[24]。试验结果表明细胞膜通透性在一定程度上可以提高异麦芽酮糖产率,但是如果细胞膜通透性越大,那么细胞破碎就越多,这样反而会使异麦芽酮糖产率下降。
3 结论
本文通过研究不同的处理方法对大黄欧文氏菌DXW-62 的细胞膜通透性的改变,探究其对异麦芽酮糖产率的影响。结果表明,使用功率为90 W 的超声波处理后,反应2.0 h 时和其他功率的超声波相比,异麦芽酮糖产率最高为72.30%,高于对照组(54.47%);利用浓度为5.0% 的吐温-80 处理,继续反应2.5 h 后异麦芽酮糖产率相比其他浓度的吐温-80 最高,为83.14%;在超声波和吐温-80 共同处理下,比对照组的异麦芽酮糖产率下降了23.18%,通过碘化丙啶染色观察可知显红色荧光细胞数量最多。

