NO处理对苦瓜采后贮藏品质的影响
王红伟,张帆,马丽丽,郑鄢燕,左进华,王清,李玲
(1.天津农学院食品科学与生物工程学院,天津 300392;2.北京市农林科学院农产品加工与食品营养研究所,北京 100097;3.果蔬农产品保鲜与加工北京市重点实验室,北京 100097;4.农业农村部蔬菜采后处理重点实验室,北京 100097)
苦瓜(MomordicacharantiaL.)是一种葫芦科植物,主要产于我国、印度及东南亚地区,由于其特殊的味道而被命名为苦瓜,多用于新鲜食用[1]。苦瓜中含有苦瓜皂苷,其在抗氧化、抗菌、抗炎等方面有显著作用,此外,它还能提高人体的免疫力[2]。苦瓜的成熟衰老过程中往往伴随着果肉组织软化[3]、叶绿素的降解和新色素的生成[4],并产生醛、醇、烯烃、烷烃等挥发性成分。同时,温度对苦瓜果实影响明显。当在室温下存放3~4 d 时,会出现果皮变黄、软化和腐烂现象,从而影响其商品性[5]。苦瓜采后品质保持技术的研究已取得一定进展。低温贮藏[6]、短波紫外线(short-wave ultraviolet-C,UV-C)辐照[7]等物理方法以及1-甲基环丙烯(1-methylcyclopropene,1-MCP)[8]和褪黑素[5]处理等化学方法,可以减轻苦瓜采后贮藏期间品质的劣变现象,但是更有效、更便捷、更经济的保鲜技术还有待研究。
一氧化氮(nitric oxide,NO)是调控果蔬生理和质量的关键信号分子[9]。近年来,NO 在作物贮藏保鲜中作用得到日益关注。试验主要通过NO 气体熏蒸或施用外源NO 供体硝普钠(sodium nitroprusside,SNP)的方法以维持果蔬采后品质[10]。研究表明,NO 能够延缓冬枣[11]、脐橙[12]、黄瓜[13]、芒果[14]等果蔬的成熟软化、增强抗病性等,从而提高果蔬的耐贮藏性、延长货架期。Barman 等[15]研究发现经2 mmol/L SNP 处理后,能够缓解荔枝果皮褐变,并延长其保质期。Qi 等[16]研究发现NO 处理通过维持细胞壁的完整性、抑制原果胶的降解和果胶甲基酯酶的表达来延缓采后水竹笋的软化和木质化。虽然已有对NO 处理保鲜作用的研究,但是关于NO处理对苦瓜采后贮藏品质的研究鲜见报道。
试验前期采用不同浓度的SNP 溶液处理苦瓜,结果发现0.25 mmol/L 的SNP 浸泡处理能够较好地维持苦瓜感官品质。因此,在前期基础上采用0.25 mmol/L的SNP 浸泡处理苦瓜果实,并置于(20±1)℃环境下贮藏,研究其对苦瓜果实贮藏品质的影响,以期为延缓苦瓜采后成熟衰老进程提供参考。
1 材料与方法
1.1 材料与试剂
苦瓜:市售。选取色泽良好、大小一致和成熟度一致、无萎蔫、病虫害和机械伤的苦瓜果实。
0.03 mm 聚乙烯保鲜膜:北京华盾雪花塑料集团有限责任公司;SNP:上海麦克林生化科技有限公司;愈创木酚:天津市科密欧化学试剂有限公司;磷酸二氢钠、磷酸氢二钠:天津市永晟精细化工有限公司;30%过氧化氢溶液、石英砂、硫代巴比妥酸、Trion X-100、交联聚乙烯吡咯烷酮、三氯乙酸:国药集团化学试剂有限公司;丙酮、乙醇、浓盐酸、甲醇:天津市光复科技发展有限公司。所用化学试剂均为分析纯。
1.2 仪器与设备
YP20002 型电子天平:余姚市金诺天平仪器有限公司;GY-2 型硬度计:浙江托普仪器有限公司;PAL-1手持糖度计:北京科创益宏科技有限公司;CR-300 色差计:日本Konica Minolta 公司;7820A 气相色谱仪:美国安捷伦公司;HSS T3 Column/ BEH C8 Column 色谱柱:美国Waters 公司;UV-1800 紫外分光光度计:上海精密科学仪器有限公司;TGL-16G-A 高速冷冻离心机:广州晟龙实验仪器有限公司。
1.3 试验方法
1.3.1 苦瓜果实的处理
将挑拣好的200 根苦瓜果实随机分成两组,每组100 根,分别为CK 组和SNP 组。将两组苦瓜果实分别在去离子水和0.25 mmol/L SNP 溶液中浸泡20 min。将浸泡后的两组苦瓜果实自然晾干2 h,用吸水纸擦干多余水分后分别装入0.03 mm 的聚乙烯保鲜袋,折口置于(20±1)℃贮藏室中贮藏。分别于贮藏的第0、2、4、6、8 天取苦瓜测定感官评分、硬度、可溶性固形物含量、色泽(L*值、a*值、b*值)、乙烯释放量;去掉苦瓜果实两端、种子和瓤,将其切成小块经液氮速冻后,置于-80 ℃超低温冰箱中保存,用于测定过氧化物酶、过氧化氢酶等生理指标。每组每次取出9 根苦瓜,3 根为一组,共3 组重复。
1.3.2 感官品质的评定
参考董华强等[17]的方法评定苦瓜的感官品质。由经过已悉知苦瓜感官评分标准的10 名同学构成评分小组,从CK 组和SNP 组各拿出9 根苦瓜果实分别从硬度、色泽和腐烂面积3 个方面,对其进行感官评价,感官评分的结果取平均值。苦瓜的感官评分标准见表1。

表1 苦瓜果实感官评分标准Table 1 Standards for sensory evaluation of bitter melon
1.3.3 色泽测定
使用色差计测定苦瓜果实的L*值、a*值、b*值,CK组和SNP 组各拿出3 根苦瓜,每根苦瓜重复测定3次,试验结果取平均值。
1.3.4 硬度和可溶性固形物含量的测定
采用硬度计在苦瓜果实表面比较平坦、光滑的中间部位选择3 个位点进行测量,探头(直径0.8 cm)以均匀速度穿透苦瓜果实表皮深度1 cm,并记录硬度计上所记录的最大数值为果实的硬度,硬度的单位为N,测量结果取平均值。
使用手持式的糖度计,取苦瓜中心部分的果肉,对可溶性固形物含量进行测量,对每个果实测量3 次,取平均值。
1.3.5 乙烯释放量的测定
通过赵雅琦等[18]的方法测定乙烯释放量,将完整苦瓜果实在具有抽气孔的密闭容器中放置2 h,从顶空中抽出1 mL 气体,并将其注入到气相色谱仪中,仪器设置:载气压力0.5 MPa,氮气流量30 mL/min;辅助气压力0.4 MPa,氢气流量50 mL/min;空气压力0.4 MPa,流量550 mL/min;进样器温度100 ℃,柱温60 ℃;检测室温度200 ℃,进样方式为不分流进样,1 min 后打开分流阀。每个组固定取出9 根苦瓜,3 根为一组,共3 组重复。最后根据峰面积与浓度线性公式关系分析计算出苦瓜乙烯释放量,单位为μL/(kg·h)。
1.3.6 叶绿素、总酚、类黄酮的测定
叶绿素、总酚和类黄酮参考曹建康等[19]方法测定。每克组织分别以在325、280 nm 波长处的吸光度表示类黄酮和总酚的含量。
1.3.7 相关抗氧化酶活性的测定
采用曹建康等[19]的方法测定苦瓜果实中过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性。以每克苦瓜样品在470 nm 波长处吸光度每分钟变化增加1 时为一个POD 酶活性单位(U);每克苦瓜样品分别在240 nm 和290 nm 波长处吸光度每分钟变化0.01 时为一个CAT 或APX 酶活性单位(U)。
1.4 数据处理
采用Excel 2019 进行数据处理,采用SPSS 26 软件进行数据方差分析,Duncan’s 多重比较进行显著性分析,其中P<0.05 表示差异显著,P<0.01 表示差异极显著;使用Origin 2019 作图。
2 结果与讨论
2.1 SNP 处理对苦瓜感官品质的影响
SNP 处理对苦瓜感官品质的影响见图1。
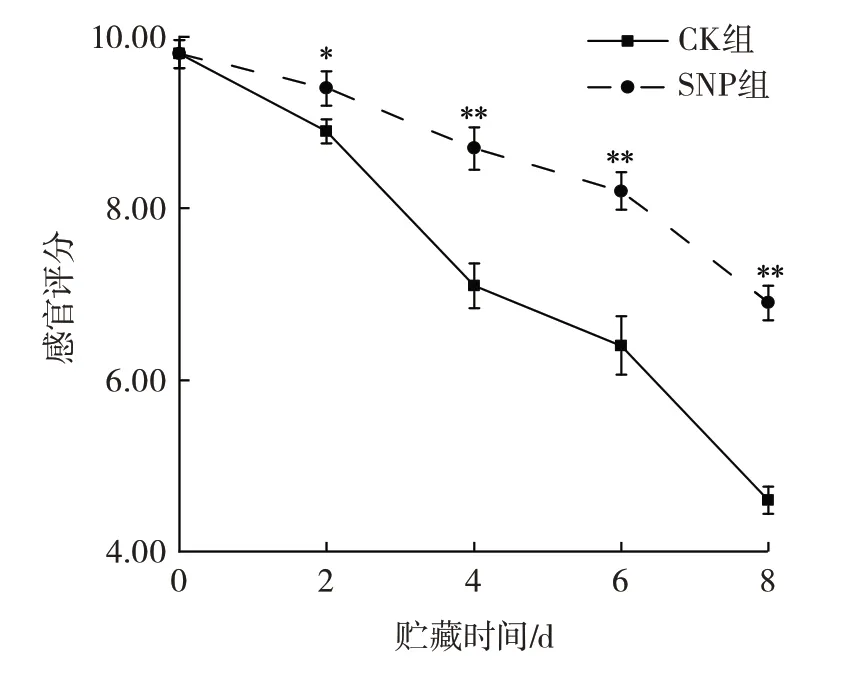
图1 SNP 处理对苦瓜感官品质的影响Fig.1 Effect of SNP treatment on sensory quality of bitter melon
随着贮藏时间的延长,未处理的苦瓜果实出现了明显的黄化现象,第4 天黄化面积达到1/3,并有大面积腐败,苦瓜果实表面无光泽感,苦瓜成熟度过高而炸裂;而SNP 组贮藏第4 天时,苦瓜的表皮只是略微发黄,与CK组相比,黄化程度显著缓解,果实依然有光泽感,无腐烂现象发生。由图1 可知,两组的感官评分随贮藏时间的延长逐渐降低。在整个贮藏期间,SNP 组的苦瓜感官评分均高于CK 组,尤其贮藏2 d 后,两组的感官评分差异极显著(P<0.01)。贮藏至第8 天时,CK 组的感官评分已下降至4.6,而经SNP 处理的苦瓜感官评分为6.9,处于较为新鲜的状态,结果表明SNP 处理能够有效保持苦瓜果实的外观品质,维持其良好的商品性。
2.2 SNP 处理对苦瓜色泽的影响
颜色是苦瓜果实成熟衰老进程中最直观的品质指标[20]。SNP 处理对苦瓜果实色泽的影响见图2。
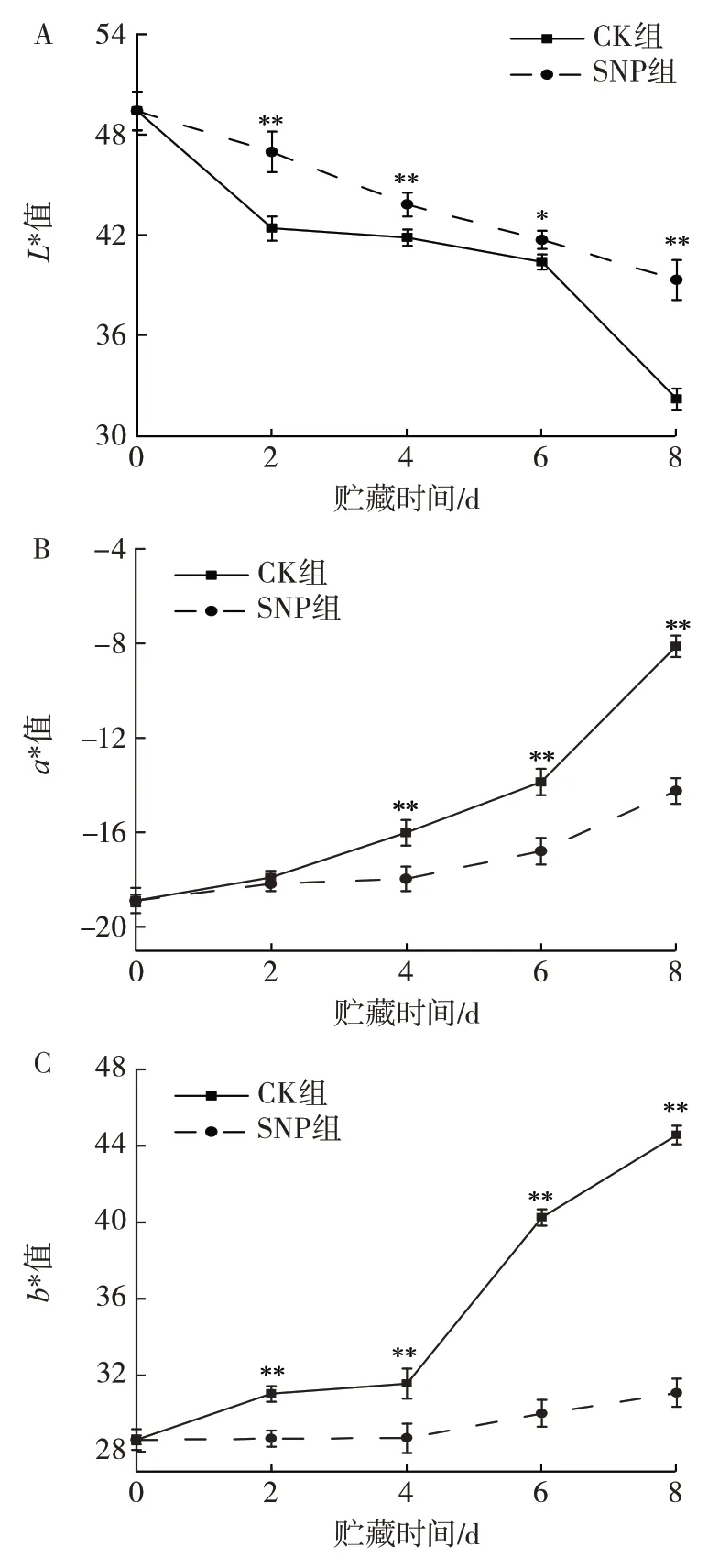
图2 SNP 处理对苦瓜色差L*值、a*值、b*值的影响Fig.2 Effect of SNP treatment on L*,a*and b*of bitter melon
已有研究表明,随着贮藏时间的延长,苦瓜果实的a*值、b*值和L*值迅速发生变化,其中a*值増加表示绿色变淡,红色加强;b*值增大表示黄色变强,蓝色变弱;L*值降低表示亮度减弱[21]。由图2A 可知,在整个贮藏期间,CK 组和SNP 组的L*值均呈下降趋势,但SNP 组比CK 组下降得缓慢,说明SNP 处理能很好地维持苦瓜的亮度。由图2B、2C 可知,a*值在贮藏期间的变化趋势与b*值的变化趋势基本一致。SNP 组苦瓜a*值的上升速率较CK 组平缓,且CK 组明显高于SNP 组,说明SNP 处理可以较好地维持苦瓜的翠绿色,延缓苦瓜的黄化;贮藏4~8 d 时,CK 组苦瓜的b*值迅速上升,且上升速率高于SNP 组,贮藏至第8 天时,CK 组的b*值与SNP 组相比增加了6.5 倍,具有极显著差异(P<0.01)。结果表明,SNP 处理对维持苦瓜的色泽具有良好的效果。
2.3 SNP 处理对苦瓜乙烯释放量、硬度和可溶性固形物含量的影响
SNP 处理对苦瓜乙烯释放量、硬度和可溶性固形物含量的影响见图3。

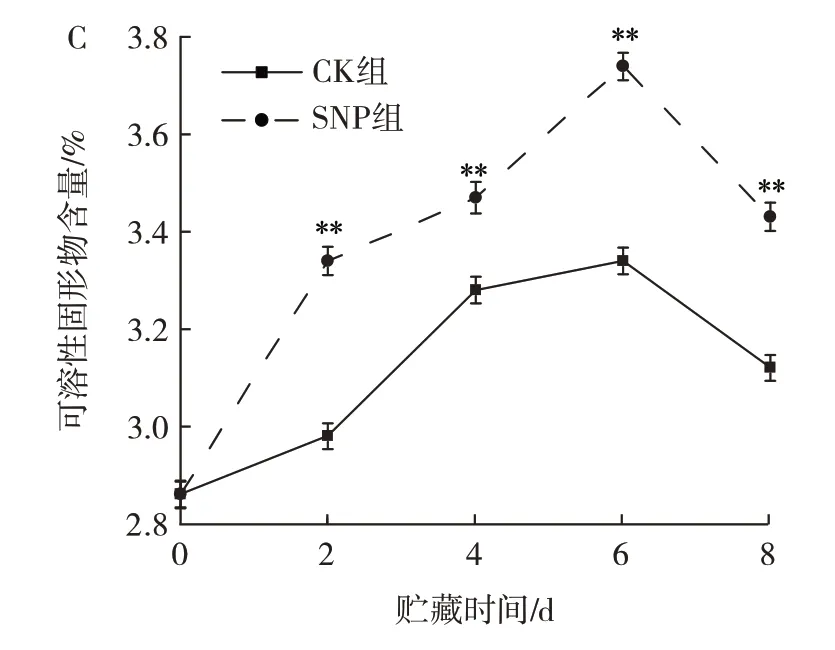
图3 SNP 处理对苦瓜乙烯释放量、硬度、可溶性固形物含量的影响Fig.3 Effect of SNP treatment on ethylene release,hardness and soluble solids of bitter melon
苦瓜为具有呼吸跃变的果实[22],其生理功能受乙烯的影响较大。乙烯是加速果实成熟老化和软化的主要因素,它在果实后熟软化的过程中起到非常关键的作用[22]。由图3A 可知,随着贮藏时间的延长,CK 组和SNP 组的乙烯释放量呈上升趋势。贮藏第0~4 天时,平缓上升,且SNP 组显著低于CK 组(P<0.05)。在第4 天乙烯释放量增长速率上升,贮藏至第6 天时,CK 组和SNP 组的乙烯释放量差异极显著(P<0.01)。贮藏至第8 天,SNP 组的乙烯释放量为0.25 μL/(kg·h),而CK组乙烯释放量为0.50 μL/(kg·h),是SNP 组的两倍。本试验结果表明,SNP 处理降低了乙烯释放量,与Han等[23]用NO 处理桃果实的试验结果一致,由此说明NO处理能有效抑制乙烯释放量、延缓果实采后成熟衰老。
硬度是判断果实是否软化变质的重要生理指标之一[24]。由图3B 可知,CK 组和SNP 组两组的苦瓜硬度随贮藏时间的延长逐渐降低,并且经SNP 处理的苦瓜硬度在贮藏期间均高于CK 组。在贮藏第8 天时,CK 组的苦瓜硬度下降了60.3%,而SNP 处理后的苦瓜下降了42.1%。综上,SNP 处理可能通过抑制乙烯的释放来延缓苦瓜果实的软化,从而维持苦瓜果实较高的硬度。
果蔬在成熟过程中,可溶性固形物含量可以很好地反映果蔬的成熟程度和品质状况。由图3C 可知,两组苦瓜的可溶性固形物含量在整个贮藏期间呈先上升后下降的变化趋势,但两组苦瓜的可溶性固形物含量与采收时相比是增加的,且SNP 组的可溶性固形物含量始终高于CK 组(P<0.01)。贮藏至第8 天,CK 组苦瓜的可溶性固形物含量上升了9.09%,而SNP 组的可溶性固形物含量上升了19.9%。因此,SNP 处理可较好地保持苦瓜果实的可溶性固形物含量,维持苦瓜果实较好的贮藏品质。
2.4 SNP 处理对苦瓜叶绿素、总酚和类黄酮的影响
SNP 处理对苦瓜叶绿素、总酚和类黄酮的影响见图4。
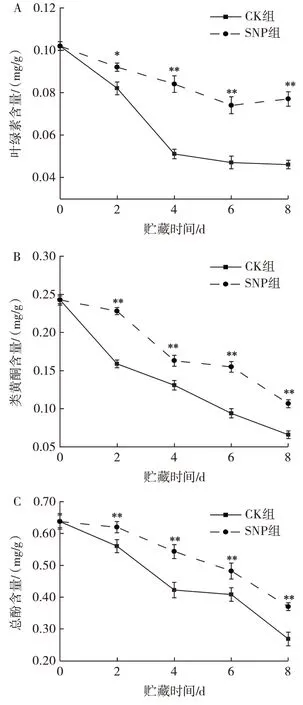
图4 SNP 处理对苦瓜叶绿素含量、类黄酮含量、总酚含量的影响Fig.4 Effect of SNP treatment on chlorophyll,total phenols and flavonoids of bitter melon
果实所呈现的各种颜色均受色素影响,色素由叶绿素、花青素等成分组成,叶绿素主要是叶绿素a 和叶绿素b,呈绿色[25]。由图4A 可知,CK 组和SNP 组苦瓜的叶绿素含量随着贮藏时间的延长均呈下降趋势。在贮藏至第4 天,SNP 组叶绿素含量的下降速率趋势比CK 组下降速率趋势平缓;在贮藏第4~8 天,CK 组变化趋于平缓,且贮藏第8 天的SNP 组叶绿素含量是CK 组的1.67 倍,两组差异极显著(P<0.01),表明SNP处理有效延缓了叶绿素的降解从而延缓苦瓜果实的黄化。
植物中的类黄酮和酚类物质具有较强的抗氧化活性,能延缓果蔬衰老[26]。由图4B、图4C 可知,类黄酮含量和总酚含量在整个贮藏期间的变化与叶绿素含量基本一致。在整个贮藏期间,SNP 组的类黄酮含量一直极显著高于CK 组(P<0.01)。CK 组和SNP 组的类黄酮含量均呈逐渐下降的趋势,但SNP 组在贮藏4 d后的下降速率趋于平缓。至贮藏期结束时,CK 组、SNP 组类黄酮含量分别下降了72.8%和56.1%;而CK组、SNP 组总酚含量分别下降了58.0% 和42.0%。有研究表明,柑橘果实中总酚和类黄酮物质含量在贮藏后期会因果实衰老和失水而减少[27]。而在本试验中经NO 处理后的苦瓜果实中总酚和类黄酮含量显著高于对照组,说明NO 处理能够在苦瓜贮藏过程中通过提高总酚和类黄酮含量来增强抗氧化能力、延缓衰老。
2.5 SNP 处理对苦瓜抗氧化酶活性的影响
SNP 处理对苦瓜抗氧化酶活性的影响见图5。
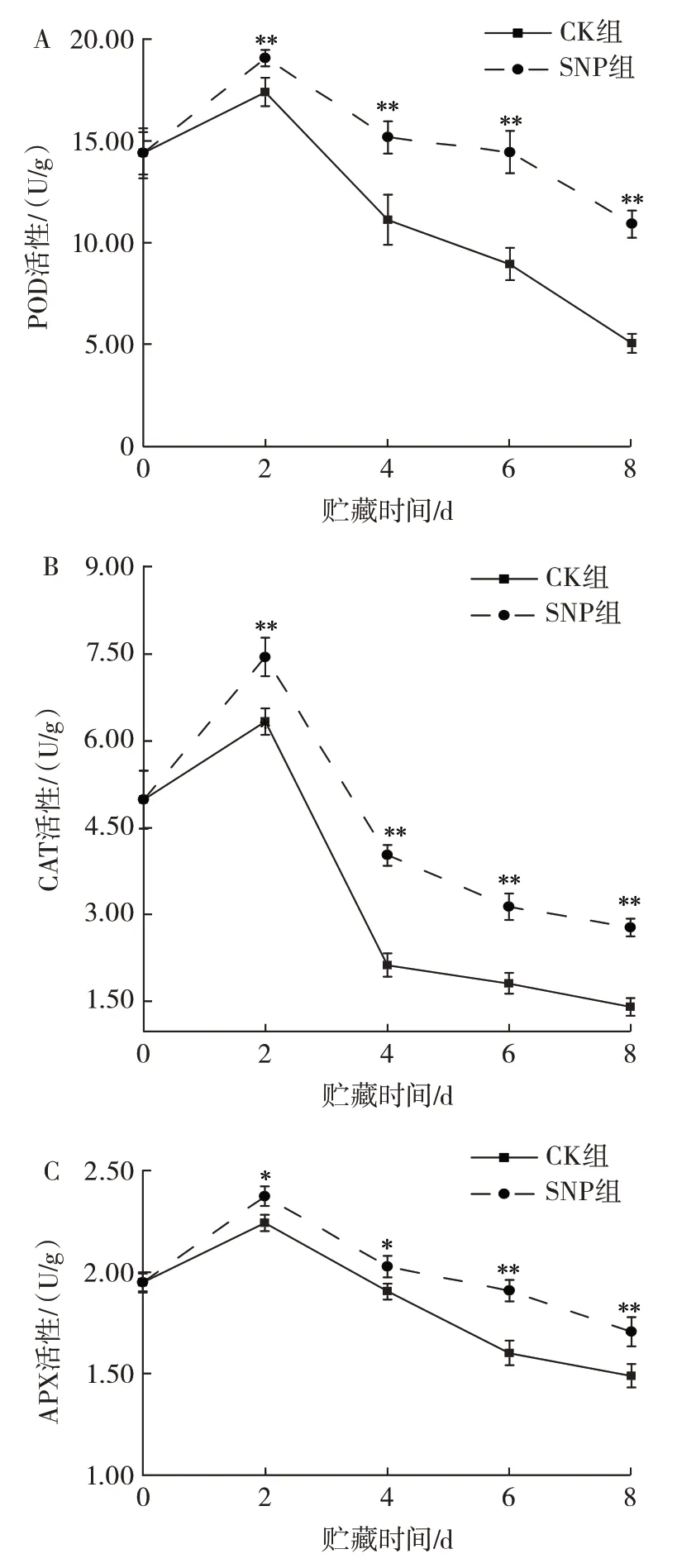
图5 SNP 处理对苦瓜POD、CAT、APX 活性的影响Fig.5 Effect of SNP treatment on POD,CAT and APX activities of bitter melon
POD 是果蔬体内普遍存在的一种重要的氧化还原酶,能够清除细胞体内的活性氧[28]。由图5A 可知,两组苦瓜果实的POD 活性呈先上升后下降的趋势。贮藏第2 天时,两组的POD 活性均达到峰值,且SNP组的POD 活性始终高于CK 组。贮藏2 d 后,CK 组和SNP 组POD 活性快速下降,而SNP 组4 d 后下降趋势较于平缓。与王云香等[13]用外源NO 处理黄瓜POD活性变化趋势相似,结果表明SNP 处理在采后贮藏过程中维持了苦瓜较高的POD 活性。
CAT 是一种能够清除果蔬组织中活性氧的重要抗氧化酶,它可将过氧化氢分解成水和氧气,消除过氧化氢对果蔬组织带来的危害[29]。由图5B 可知,两组苦瓜的CAT 活性随着贮藏时间的延长呈先上升后下降趋势,而且SNP 组的CAT 活性始终高于CK 组(P<0.01);贮藏第2 天时,CAT 活性达到高峰。与第0 天相比,CK 组和SNP 组的CAT 活性分别增加了26.9% 和49.3%。贮藏超过2 d 后,CK 组和SNP组的CAT 活性快速下降,贮藏4 d 后,两组的CAT 活性下降趋势趋于平缓。贮藏第8 天时,CK 组和SNP组的CAT 活性分别为1.40 U/g 和2.78 U/g。因此,SNP 处理能通过维持CAT 活性和苦瓜的抗氧化能力、减轻苦瓜在衰老过程中的损害,以延长苦瓜的货架期。
APX 与CAT 协同作用以减轻过氧化对果蔬的损伤[30]。由图5C 可知,在苦瓜贮藏期间,两组的APX 活性均呈先上升后下降趋势。贮藏第2 天时,CK 组和SNP 组的APX 活性均达到峰值,分别为2.24 U/g 和2.37 U/g;贮藏2~8 d 时,分别迅速下降至1.49 U/g 和1.70 U/g,SNP 组在2~8 d APX 活性下降速率明显低于CK 组。综上所述,SNP 处理可维持苦瓜的APX 活性,从而保持贮藏期间苦瓜果实的抗氧化能力。
在整个贮藏期间,NO 处理苦瓜的POD、CAT、APX活性均高于CK 组,这与Zhao 等[31]的研究结果一致。因此,NO 能有效地降低苦瓜氧化应激反应,有利于保护膜结构,从而延缓其老化过程。
3 结论
研究表明,NO 可在一定程度上维持苦瓜采后生理品质。NO 处理能够有效保持苦瓜果实的外观品质,维持其良好的商品性。NO 处理显著减少苦瓜果实乙烯的生成和叶绿素降解,进而延缓苦瓜果实硬度的下降和黄化。另外,经NO 处理的苦瓜果实其抗氧化物质(总酚、类黄酮)的含量和抗氧化酶活性(POD、APX、CAT)也相对保持较高。该方法应用方便,成本较低,存在应用潜力,更适于苦瓜的贮藏保鲜。因此,NO 处理为延缓苦瓜果实采后衰老研究提供新思路,对苦瓜采后保鲜贮藏具有重要的指导意义。

