逍遥散对胃癌荷瘤共病抑郁小鼠程序性死亡受体1抑制剂治疗的增敏作用及机制探讨
陈军 张兆星 米婧 屈红艳 胡蓉 李静
2022年国家癌症中心发布了最新一期的全国癌症统计数据,2016年新发病例406.4万,其中胃癌占比39.7%,位列第三,且在农村胃癌发病人数最多。总死亡人数241.1万,其中胃癌占比28.9%,也位列第三,不可否认,胃癌已经成为严重威胁人民健康的疾病之一。尽管程序性死亡受体1(programmed cell death protein 1,PD-1)负性检查点免疫治疗的部分数据提示改善了患者晚期生存[1],然而其有效率仍不到30%,其中大约63.2%的有效人群对PD-1抑制剂干预后均会迅速诱发免疫治疗耐药[2]。同时,研究发现在胃癌的免疫治疗失应答群体中,大概率的存在着疲劳、心境低落等抑郁核心症状[3]。抑郁的影响不仅仅局限于情绪和认知,甚至能够导致放疗、铂类、内分泌药物、分子靶向药物等多种治疗耐受[4]。因此,抑郁可能参与了免疫治疗的负反馈调控。在前期的动物实验中,本研究小组也证实慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)可诱导出荷瘤小鼠的抑郁样行为并显著促进肿瘤的增殖[5]。逍遥散是中医治疗“郁证”的代表方剂,疗效确切[6]。本实验通过构建胃癌荷瘤共病抑郁小鼠模型,来探究逍遥散对PD-1抑制剂是否有增敏作用及相关机制,为探寻胃癌的中西医综合治疗提供新的思路和科学依据。
1 材料与方法
1.1 实验动物与细胞株
6周龄BALB/c雄性野生小鼠共70只(其中成功构建胃癌荷瘤小鼠63只,满足60只的分组要求),体质量20~25 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006;饲养于26~27℃、12/12小时光照/黑暗交替的环境中;小鼠MFC胃癌细胞株购自于武汉普诺赛生命科技有限公司,货号:CL-0156。
1.2 主要试剂与仪器
鼠源PD-1抑制剂(MedChemExpress公司,目录号:HY-P99144),小鼠吲哚胺2,3-双加氧酶(indoleamine-2,3-dioxygenase,IDO)ELISA试剂盒(TSZ,德国,货号:LM-IDO-Mu);小鼠犬尿氨酸(kynurenine,Kyn)ELISA检测试剂盒(菲恩生物,中国,货号:EM1862);小鼠芳香烃受体(aryl hydrocarbon receptor,AhR)ELISA检测试剂盒(ZIKER,中国,货号:ZK-M5467)。
逍遥散按《太平惠民和剂局方》的原方抓取,当归30 g、白芍30 g、柴胡30 g、白术30 g、茯苓30 g、甘草15 g、煨生姜10 g、薄荷10 g,其中药比例为3∶3∶3∶3∶3∶1.5∶1∶1,按标准方法制备逍遥散水提物[7],并浓缩至每毫升0.385 g生药,4℃冰箱保存备用。
超声波破碎仪(JY98-IIIDN,新芝,中国);小鼠灌胃针(HL-GWQ,合力科创,中国);高速低温离心机(TGL-20M,湘仪,中国);电子天平(JET1003G,Metter,美国);酶标仪(MK3,Thermo,美国);光学显微镜(BX53M,奥林巴斯,日本)。
1.3 胃癌荷瘤小鼠模型的构建
将小鼠MFC胃癌细胞株液氮中取出,常规复苏,并放在含10%胎牛血清、1%双抗的RPMI 1640培养液中培养,并放于37℃、5%CO2培养箱中培养传代至3~4代,调整细胞浓度至1×107个/mL制成细胞悬液。小鼠常规消毒,仰卧位固定,在小鼠的右腋窝下接种0.2 mL的细胞悬液,并用无菌棉签按压10秒。接种第14天,小鼠皮下肿瘤体积达到50 mm3时,提示荷瘤小鼠造模成功。小鼠皮下肿瘤体积计算公式:体积(mm3)=1/2(长径×短径×短径)。
1.4 分组
接种第15天,将荷瘤成功的小鼠60只,随机分为荷瘤对照组、荷瘤共病抑郁组、PD-1抑制剂组、逍遥散联合PD-1抑制剂组,每组15只,各组采用的干预方式见图1。CUMS具体是以关灯、拥挤、束缚、食物剥夺、频闪、18℃游泳等进行刺激,为了确保实验的不可预测性,所有的压力源都是随机给予。小鼠灌胃以3.85 g/kg为标准[7],小鼠尾静脉注射以3 mg/kg为标准[8]。其中,荷瘤对照组只与荷瘤共病抑郁组进行小鼠行为学比较,以判断胃癌荷瘤共病抑郁小鼠模型是否构建成功。

图1 各组小鼠干预流程示意图
1.5 指标观测
1.5.1 小鼠行为学检测 分组后第57天,荷瘤对照组(存活小鼠6只)与荷瘤共病抑郁组(存活小鼠3只)进行糖水偏好测试、陌生环境摄食实验,分析两组小鼠的行为学变化。
1.5.2 荷瘤小鼠生存曲线 分组后,以第57天为结点,每天观察、记录荷瘤共病抑郁组、PD-1抑制剂组、逍遥散联合PD-1抑制剂组三组小鼠生存情况,采用GraphPad Prism 9软件绘制小鼠生存曲线。
1.5.3 肿瘤增殖测定 分组后第57天,剥离小鼠皮下瘤体获得样本,电子天平称取瘤重,单位(mg);测量瘤体体积,单位(mm3);计算PD-1抑制剂组、逍遥散联合PD-1抑制剂组的抑瘤率[9],抑瘤率(%)=(1-治疗组平均瘤质量/荷瘤共病抑郁组平均瘤质量)×100%。
1.5.4 使用ELISA对肿瘤组织IDO、Kyn、AhR进行检测 肿瘤组织IDO检测:切取肿瘤组织,用超声波破碎仪将标本匀浆,以3 000 r/min离心20分钟,收集上清进行检测;在已包被好的ELISA反应板内,每孔加入100 μL待测样品,将反应板置37℃120分钟,用洗涤液将反应板充分洗涤4~6次,向滤纸上印干,每孔中加入第一抗体工作液50 μL,将反应板充分混匀后置37℃60分钟,每孔加酶标抗体工作液100 μL,将反应板置37℃60分钟,每孔加入底物液100 μL,置37℃暗处反应10分钟,每孔加入50 μL终止液混匀,在450 nm处测吸光值。肿瘤组织Kyn、AhR的ELISA检测按试剂盒说明书进行,实验操作同上。
1.5.5 免疫组化法检测小鼠肿瘤组织叉头样转录因子3(forkhead box P3,Foxp3) 收集小鼠肿瘤组织,使用10%甲醛溶液进行固定,石蜡包埋,将制备好的蜡块切片,厚度为2 μm,二甲苯脱蜡、梯度乙醇水化、抗原修复后,对处理好的切片进行一抗染色,37℃孵育3小时,经梯度乙醇与二甲苯脱水后封片,使用光学显微镜采图,以细胞核或胞浆中出现棕黄色颗粒为染色阳性,并用Image-Pro Pus软件进行定量分析。
1.6 统计学处理
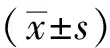
2 结果
2.1 各组小鼠生存率的情况
荷瘤共病抑郁组存活小鼠3只,生存率为20%,PD-1抑制剂组存活小鼠4只,生存率为26.7%,逍遥散联合PD-1抑制剂组存活小鼠6只,生存率为40%。逍遥散联合PD-1抑制剂组生存率高于PD-1抑制剂组(P<0.05),PD-1抑制剂组高于荷瘤共病抑郁组(P<0.05)。见图2。

图2 各组小鼠生存曲线
2.2 各组小鼠行为学的比较
糖水偏好率:与荷瘤对照组比较,荷瘤共病抑郁组显著降低(P<0.01)。摄食潜伏时间:与荷瘤对照组比较,荷瘤共病抑郁组显著延长(P<0.01)。说明胃癌荷瘤共病抑郁小鼠模型构建成功。见表1。
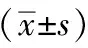
表1 两组小鼠糖水偏好率、摄食潜伏时间的比较
2.3 各组小鼠瘤体体积、重量及抑瘤率的比较
如表2所示,瘤体体积:与荷瘤共病抑郁组比较,PD-1抑制剂组和逍遥散联合PD-1抑制剂组均明显减小(P<0.05,P<0.01);与PD-1抑制剂组比较,逍遥散联合PD-1抑制剂组明显减小(P<0.05)。瘤体重量:与荷瘤共病抑郁组比较,PD-1抑制剂组、逍遥散联合PD-1抑制剂组均显著降低(P<0.01);与PD-1抑制剂组相比,逍遥散联合PD-1抑制剂组显著降低(P<0.01)。剥离各组实体瘤比较见图3。提示逍遥散联合PD-1抑制剂组抑瘤率优于PD-1抑制剂组。
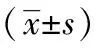
表2 各组小鼠肿瘤体积、重量、抑瘤率比较
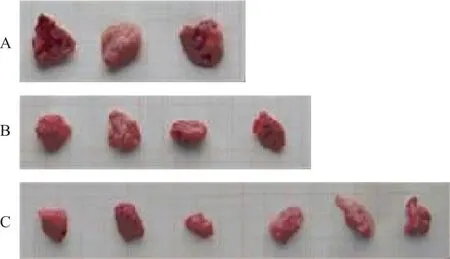
注:A为荷瘤共病抑郁组,B为PD-1抑制剂组,C为逍遥散联合PD-1抑制剂组。
2.4 各组小鼠肿瘤组织IDO、Kyn、AhR的表达
如表3所示,逍遥散联合PD-1抑制剂组IDO水平显著低于荷瘤共病抑郁组、PD-1抑制剂组(P<0.01);PD-1抑制剂组Kyn 水平低于荷瘤共病抑郁组(P<0.05),逍遥散联合PD-1抑制剂组Kyn水平显著低于荷瘤共病抑郁组和PD-1抑制剂组(P<0.01);与荷瘤共病抑郁组、PD-1抑制剂组比较,逍遥散联合PD-1抑制剂组AhR水平显著下降(P<0.01)。

表3 各组小鼠肿瘤组织中IDO、Kyn、AhR水平的比较
2.5 各组小鼠肿瘤组织Foxp3的变化
免疫组化结果如图4、表4,PD-1抑制剂组、逍遥散联合PD-1抑制剂组肿瘤组织中Foxp3表达均低于荷瘤共病抑郁组(P<0.01);逍遥散联合PD-1抑制剂组肿瘤组织中Foxp3表达低于PD-1抑制剂组(P<0.01)。
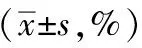
表4 各组小鼠肿瘤组织中Foxp3表达的比较
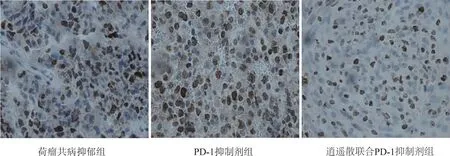
图4 各组肿瘤组织Foxp3蛋白表达情况(×400)
3 讨论
3.1 IDO与抑郁症
色氨酸(tryptophan,Trp)是人体的必需氨基酸,其代谢途径包括参与蛋白质合成;生成5-羟色胺并代谢为褪黑素;在IDO的催化下代谢为Kyn及其衍生物。IDO广泛分布于大脑、免疫器官、肺、肾等,是犬尿氨酸通路的重要限速酶,正常条件下呈低活性,当机体处于炎症或应激状态时,均可引起下丘脑-垂体-肾上腺皮质轴激活、血清皮质醇上调,导致白介素(interleukin,IL)-6释放,促炎细胞因子诱导IDO活性增加,促使Trp代谢为Kyn,导致5-HT、脑源性神经营养因子的合成减少进而诱发抑郁的发生[10]。另一方面,Kyn/Trp比值也是犬尿氨酸通路激活的第一步,研究发现,血浆Kyn/Trp比值与炎症因子有关[11],并且关联于快感缺乏及抑郁严重程度[12]。本课题小组在前期的动物实验中也证明IDO信号通路与抑郁症密切相关[5]。
3.2 IDO与调节性T淋巴细胞(regulatory T cell,Treg)
IDO在健康组织中表达水平极低,但在肿瘤组织中表达显著增强,导致局部Trp耗竭,同时产生毒性代谢产物L-犬尿酸和吡啶甲酸,形成了Trp耗竭和毒性产物堆积的“肿瘤微环境”[13],在这种微环境中,大量Trp在IDO的作用下分解成Kyn,而Kyn可激活AhR,AhR进而诱导Treg细胞的增殖[14]及大量分化,Treg细胞可通过分泌抑制性细胞因子IL-10、转化生长因子等直接抑制效应T细胞及自然杀伤细胞活性;同时,Treg细胞通过穿孔素、颗粒酶等途径介导CD8+T细胞凋亡,导致肿瘤细胞逃逸[15];另外,Treg细胞高表达的CD25可与T细胞竞争性的结合IL-2,而IL-2是促进T细胞活化的重要因子,从而抑制效应T细胞的活化与增值[16]。又能促进CD8+T细胞中PD-1的表达,进而影响CD8+T细胞对肿瘤细胞的杀伤作用[17],最终导致肿瘤免疫逃逸。另一方面,Treg细胞通过细胞膜表面传递抑制信号CTLA-4分子和分泌干扰素-γ等再次刺激树突状细胞上调IDO,自此形成一个恶性循环,即以IDO为核心的,抑郁与肿瘤免疫逃逸共存的一个发病机制[18]。Foxp3是Treg细胞的标志性分子,本实验显示逍遥散联合PD-1抑制剂较单纯PD-1抑制剂能更好的降低小鼠肿瘤组织内的Foxp3水平,抑制Treg细胞的分化与活性,从而有可能打破该恶性循环。
本次研究选用治疗“郁证”的代表方剂逍遥散作为PD-1抑制剂的增敏剂,发现逍遥散联合PD-1抑制剂较单纯使用PD-1抑制剂能更有效提高胃癌荷瘤共病抑郁小鼠的生存率,减少小鼠瘤体体积及重量,其增敏机制应与逍遥散可降低IDO、Kyn、AhR水平从而抑制Treg细胞活性有关。本项目组成员在长期的肿瘤临床治疗工作中,发现许多治疗效果欠佳的患者绝大部分都存在情志问题,从中医七情致病观点出发,肿瘤的发病转归一定参杂诸多情志因素。因此,我们认为肿瘤也属于心身疾病,其情志通过影响肿瘤免疫进而影响病情转归。此研究初步阐明了抑郁与肿瘤之间缠绵的关系,提示人们在临床决策中应重视情志因素,该思路具有潜在和广阔的临床运用前景。

