基于16S核糖体DNA基因测序技术探讨分消走泄法对支气管哮喘大鼠肠道菌群的影响
刘璐佳 杨阳 景伟超 王有鹏
全球哮喘倡议报告将支气管哮喘(简称“哮喘”)描述为一种通常以慢性气道炎症为特征的异质性疾病[1]。本病临床以反复发作的呼吸困难、喘息、胸闷和咳嗽等呼吸道症状为主症[2]。据估计,全世界高达14%的儿童和8.6%的成年人患病[3]。目前,哮喘管理的长期目标是实现症状控制、保护肺功能、降低恶化和死亡的风险,以及尽量减少与药物相关的副作用[4],尤其在新型冠状病毒大流行的背景下,哮喘患者必须在良好控制临床症状的情况下继续进行适当的治疗[5]。因此,对于阐明哮喘发病机制,探寻有效防治药物是当前研究的重点。
人体肠道菌群是一个复杂的生态系统,涉及宿主的新陈代谢、免疫和健康。值得注意的是,新的证据支持肺部疾病通常伴有肠道菌群失调和免疫炎症反应,肠道菌群及其代谢产物直接或间接参与肺病宿主的免疫调节,形成“肺—肠”轴[6]。已有研究表明,肠道菌群失调是导致哮喘和其他呼吸系统疾病的重要因素之一[7-8]。这和中医学上的“肺与大肠相表里”“肺肠相关”理论不谋而合。基于此,笔者所在研究团队首次将分消走泄法引入哮喘的治疗当中,创立了临床有效方剂白果温胆汤治疗哮喘,并于2022年被授予国家发明专利(专利号:ZL202111491708.8)。白果温胆汤以调和为主,分消上下之势,达通利三焦、理气化痰、止咳平喘之效。然目前尚缺乏白果温胆汤干预哮喘作用机制的文献报道,为此本文通过对哮喘模型大鼠肺组织病理形态、粪便肠道菌群进行检测,探讨白果温胆汤的作用机制,为后续进一步研究白果温胆汤提供实验基础。
1 材料与方法
1.1 实验动物
72只SPF级雄性SD大鼠体质量(180±20)g,由辽宁长生生物技术有限公司提供,动物许可证号:SCXK(辽)2020-0001。饲养环境安静,光/暗循环12小时,室内温度(25±1)℃,室内湿度45%~55%,自由获取食物和水。
1.2 实验药物
白果温胆汤:陈皮18 g、清半夏12 g、茯苓18 g、炒枳实12 g、竹茹12 g、白果12 g、炒葶苈子12 g、射干18 g、浙贝母18 g、炒紫苏子18 g、蜜枇杷叶18 g、浮萍24 g、生甘草12 g,煎煮过滤后,用旋转蒸发仪浓缩成药物浓度5 g/mL,置4℃冰箱中保存备用。
地塞米松片:天津天药药业股份有限公司,国药准字:H12020686。
1.3 实验主要试剂和仪器
OVA(货号:#A8040,北京索莱宝科技有限公司)、氢氧化铝凝胶(货号:S30353,上海源叶生物科技有限公司)、苏木精染料(货号:#G3720,北京索莱宝科技有限公司)、伊红(货号:15086-94-9,山东西亚化工科技有限公司)、4%多聚甲醛(货号:BL539A,广州硕谱生物科技有限公司)、磷酸盐缓冲液(phosphate buffer saline,PBS)(货号:BL302A,广州硕谱生物科技有限公司)、RNA 6000 Nano kit(货号:5067-1511,Agilent)、Agilent High Sensitivity DNA Kit(货号:5067-4626,Agilent)、Quant-iT PicoGreen dsDNA Assay Kit(货号:P7589,Invitrogen)、Q5®High-Fidelity DNA Polymerase(货号:M0491L,NEB)、AxyPrep DNAGel Extraction Kit(货号:AP-GX-250,Axygen)。
超声雾化器(型号:402AI,上海鱼跃医疗设备有限公司)、紫外分光光度计(型号:NANO 2000,Thermo)、TBS380 荧光计(型号:E6090,Promega)、电泳仪(型号:DYY-7C,北京六一生物科技有限公司)、PCR扩增仪(型号:2720,ABI)、2100生物分析仪(型号:2100Bioanalyzer,Agilent)、自制雾化箱。
1.4 分组与造模
将72只雄性SD大鼠随机分为六组:空白组、模型组、地塞米松组及白果温胆汤高、中、低剂量组,每组12只,适应性饲养7天后开始实验。根据参考文献制备动物模型,包括致敏和激发两个阶段[9-10]。致敏阶段:模型组和各给药组大鼠第1天和第8天分别腹腔内注射1 mL抗原混悬液(10%卵清蛋白和10%氢氧化铝混合液),空白组给予等量生理盐水替代。激发阶段:第15天起,将模型组和各给药组大鼠逐一置于自制雾化箱内,给予2%卵清蛋白雾化进行激发,空白组给予生理盐水雾化吸入,每天一次,共14天。
1.5 药物干预
从实验的第15天起,各组于雾化前半小时进行药物灌胃。空白组与模型组分别给予生理盐水代替药物灌胃,日1次,持续14天。地塞米松组给予0.5 mg/kg地塞米松灌胃,日1次,持续14天。白果温胆汤高、中、低剂量组(临床用量按动物体表面积比值换算成等效剂量为18 g/kg,高剂量按人体等效剂量2倍,组间剂量比为2∶1),每次分别按36 g/kg、18 g/kg、9 g/kg的剂量给予灌胃给药,给药体积设为1 mL/100 g,日1次,持续14天。各组在灌胃半小时后开始并完成激发阶段(具体方法参照制备动物模型处)。
1.6 取材方法
取材前禁食12小时,末次雾化结束24小时后,用10%水合氯醛3 mL/kg对大鼠进行麻醉,将麻醉成功的大鼠仰卧位固定于操作台,剪毛,用手术剪沿腹中线向上逐层剪开腹腔、胸腔,取右肺中叶将其放入4%多聚甲醛固定液中,于室温固定,备做苏木精—伊红染色(hematoxylin-eosin staining,HE);在盲肠末端剪一个小口,把盲肠内容物挤入灭菌的EP管中,立即用液氮速冻。
1.7 指标检测
1.7.1 行为学观察 实验过程中观察记录各组大鼠的精神状态、食量、饮水量、呼吸及毛发光泽等情况的变化。
1.7.2 肺组织病理学检测 HE染色检测各组大鼠肺组织病理改变:将多聚甲醛固定好的右肺中叶组织,依次完成包埋切片—切片脱蜡至水—苏木精染色—盐酸酒精分化—自来水返蓝—伊红染色—脱水、透明、封片后,利用光学显微镜镜检,采集并分析所得图像。观察各组大鼠肺组织HE染色病理改变结果。
1.7.3 16S核糖体DNA(16S ribo-somal DNA,16S rDNA) Miseq高通量测序观察肠道菌群情况,观察治疗后各组大鼠肠道菌群的多样性和各菌群的丰度。即从每组随机选出5个样本进行粪便DNA的抽取,使用Agilent High Sensitivity DNA Kit遵循制造商的说明。使用紫外分光光度计和琼脂糖凝胶电泳分别测量提取DNA的数量和质量。使用正向引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA基因V3~V4区域进行PCR扩增。PCR扩增子使用Vazyme V AHTSTM DNA Clean Beads进行纯化,并使用Quant-iT PicoGreen dsDNA检测试剂盒进行定量。将扩增子等量合并,使用Illlumina MiSeq平台和MiSeq Reagent Kit v3进行双端测序。
微生物组生物信息学使用QIIME2进行,使用demux插件对原始序列数据进行多路分解,使用cutadapt插件进行引物切割。再使用DADA2插件对序列进行质量过滤、降噪、合并和去除嵌合体,获得非单子扩增子序列变体(amplicon sequence variant,ASV)。Classify-skleaen算法对ASV进行物种注释,再进行Alpha多样性分析和Beta多样性分析。Alpha多样性分析包括观察各组大鼠肠道菌群丰度Chao1指数、Observed_species指数、基于进化的多样性Faith’s PD指数、均匀度Pielou_e指数、菌群多样性Shannon指数等。Beta多样性分析包括对各组大鼠肠道菌群进行Anosim分析等。最后,利用平台得到各组大鼠在科水平上的肠道菌群丰度,比较各组差异。
1.8 数据处理
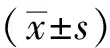
2 结果
2.1 行为学观察结果
空白组:实验过程中大鼠均精神状态良好,活动自如,毛发光亮顺滑,可正常进食及饮水,呼吸如常。生理盐水雾化吸入时,观察到有个别大鼠出现一过性呼吸急促,但很快缓解,后无其它异常反应。
模型组:致敏后大鼠出现烦躁多动,呼吸加深加快,四肢及腹部偶见抽搐动作。进入激发阶段,雾化时大鼠出现明显的呛咳、呼吸频率加快、搔鼻抓脸、烦躁等表现,随着时间的延长,大鼠精神萎靡、反应迟钝、咳嗽、搔鼻等表现渐重。
地塞米松组:致敏后及激发阶段初期与模型组大鼠表现相似,但伴随地塞米松发挥干预作用,大鼠咳嗽、搔鼻抓脸、烦躁等症状均有不同程度的改善,明显轻于模型组。
白果温胆汤高、中、低剂量组:致敏后及激发阶段初期白果温胆汤各组与模型组大鼠表现相似,但伴随白果温胆汤的干预作用,各组大鼠咳嗽、搔鼻抓脸、烦躁等症状均有不同程度的改善。低剂量组大鼠一般状况优于模型组;中剂量组大鼠一般状况优于白果温胆汤低剂量组,与地塞米松组相似;高剂量组大鼠症状改善情况与中剂量组相似,且与地塞米松组相比,大鼠神态安静,毛发更加滑顺光亮。
2.2 肺组织HE染色结果
空白组:肺组织形态结构较正常,肺间隔轻度增厚,可见少量炎性细胞。模型组:肺气管上皮破损,肺间隔增厚,炎性细胞增多。各治疗组与模型组比较,均有一定改善,表现为肺组织结构清晰,肺间隔厚度降低,炎性细胞减少。结果见图1。
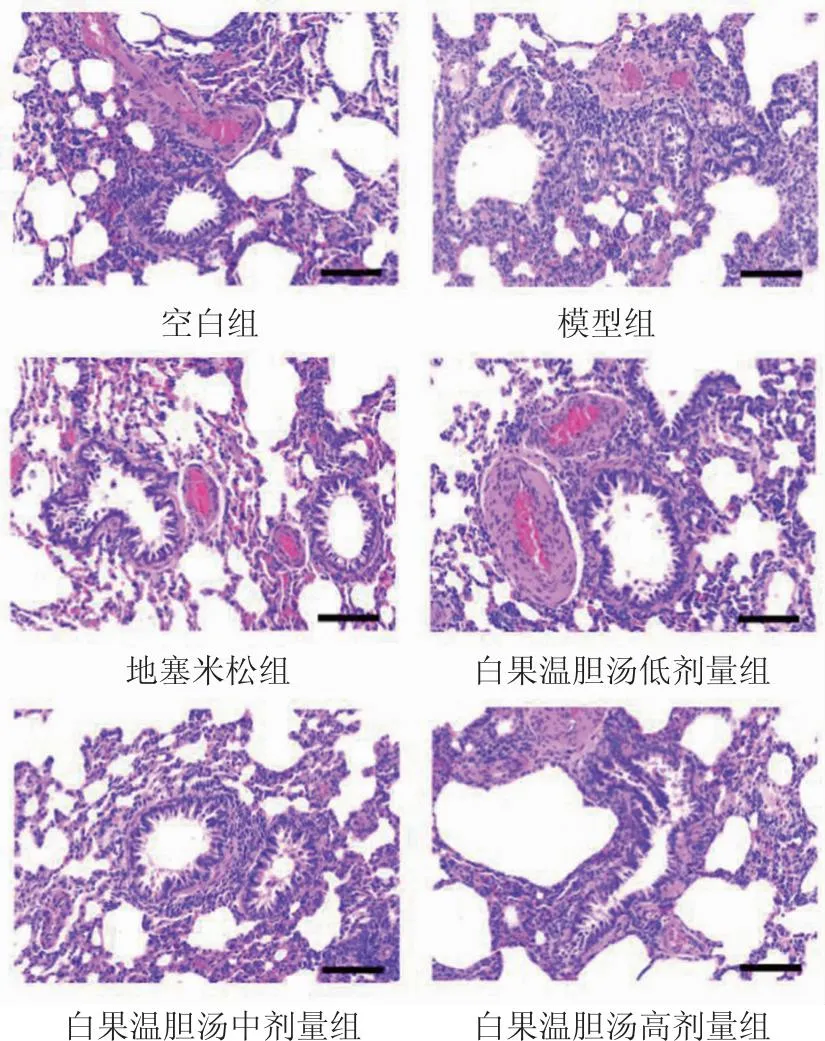
图1 肺组织HE染色镜下观察结果(×200)
2.3 菌群丰度情况
本实验共30个样本,得到1990364条序列,各样本平均读长数目66345个,序列长度分布范围为50~433 bp。结果见图2。获得六组大鼠粪便样本在不同分类水平的ASVs的数目,样本中测得所有ASVs均可被识别,并在各分类等级均有体现,分布也较为广泛,采用韦恩图分析各组间菌群运算的分类单元数量及其种类交叉情况。结果见图3。
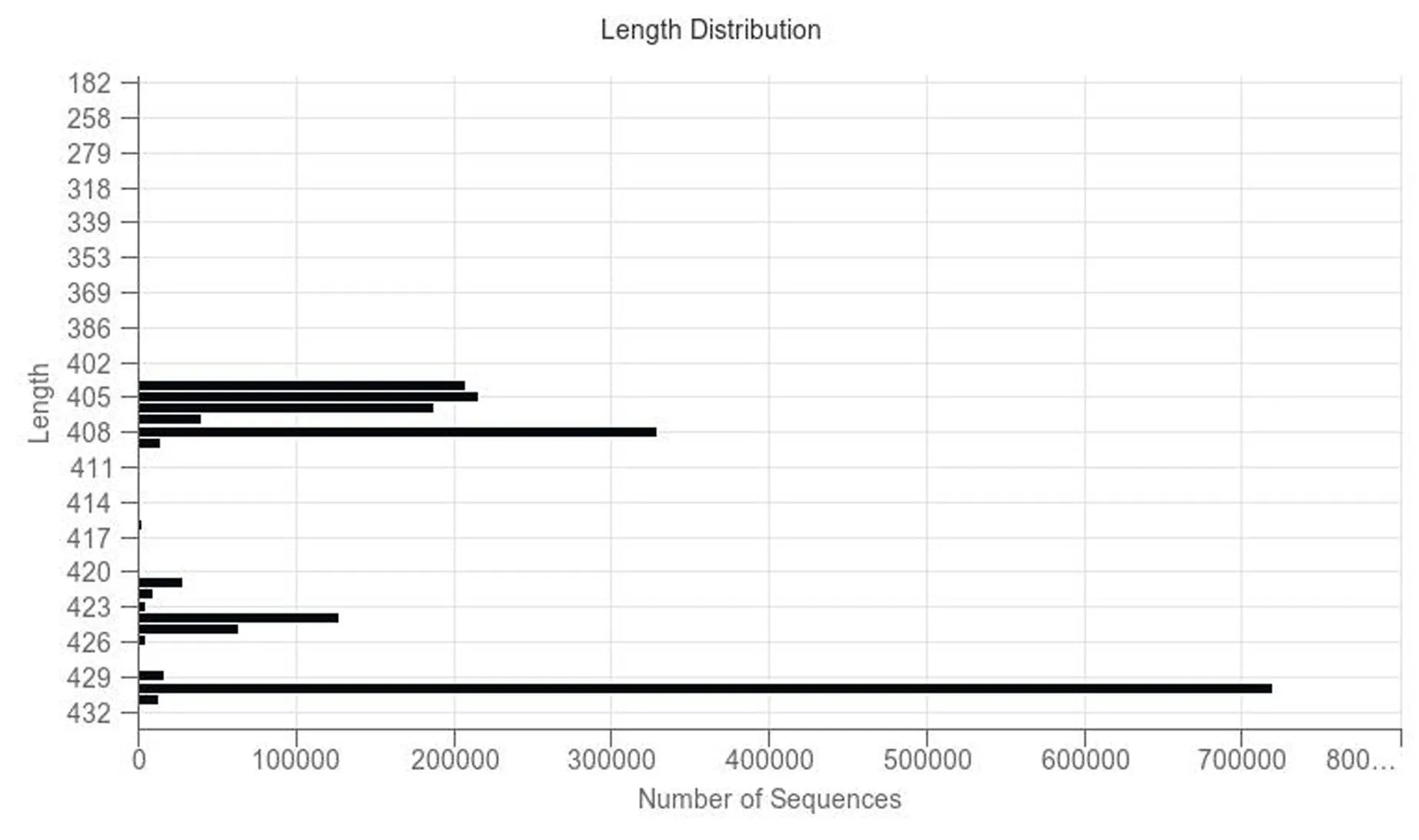
图2 序列长度分布

图3 各组大鼠肠道菌群ASVs分布韦恩图
2.4 Alpha多样性分析
2.4.1 物种累计曲线 随着样本量的增加,曲线逐渐趋于平缓,表明测序深度已经基本覆盖到样品中所有的物种,测序数据量合理,测序深度足够大。结果见图4。
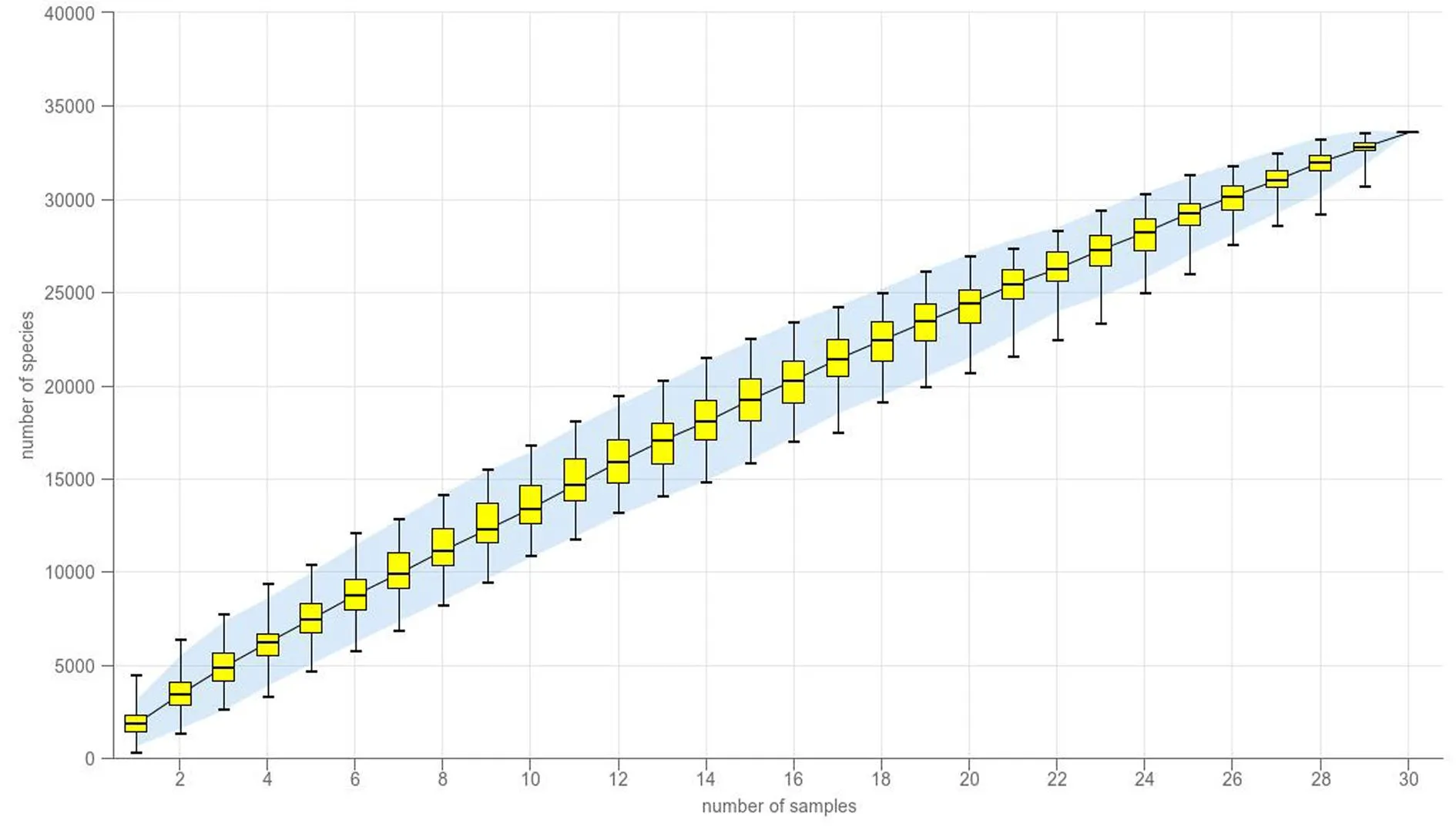
图4 物种累积曲线
2.4.2 菌群Alpha多样性分析 各组大鼠肠道菌群的稀释曲线均急剧上升后呈平缓趋势,结果见图5,表明测序深度可以覆盖本样本中的物种组成情况。
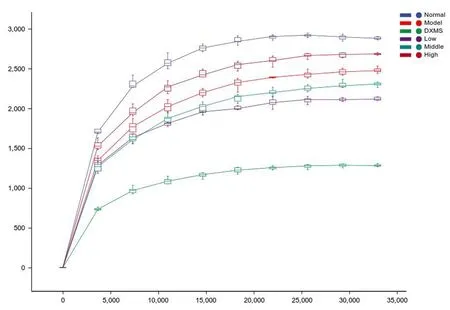
图5 物种的稀疏曲线
与空白组比较,模型组大鼠肠道菌群丰度Chao1指数及Observed_species指数、基于进化的多样性Faith’s PD指数、均匀度Pielou_e指数、菌群多样性Shannon指数均有下降趋势,但差异均无统计学意义(P>0.05);地塞米松组大鼠肠道菌群Chao1指数、Observed_species指数、Faith’s PD指数、Pielou_e指数、Shannon指数均有明显下降,差异均具有统计学意义(P<0.05)。见表1。

表1 各组大鼠肠道微生物菌群丰富度和多样性比较鼠只=5)
与模型组比较,地塞米松组大鼠肠道菌群Chao1指数、Pielou_e指数、Shannon指数均有明显下降,差异均具有统计学意义(P<0.05);白果温胆汤低剂量组Faith’s PD指数有明显下降,差异具有统计学意义(P<0.05),白果温胆汤各剂量组其余指数随浓度升高逐渐增高,但差异均无统计学意义(P>0.05)。见表1。
与地塞米松组比较,白果温胆汤低、中剂量组Pielou_e指数、Shannon指数均有明显上升,差异均具有统计学意义(P<0.05),白果温胆汤高剂量组Chao1指数、Observed_species指数、Faith’s PD指数、Shannon指数均有明显上升,差异均具有统计学意义(P<0.05)。见表1。
与白果温胆汤低剂量比较,白果温胆汤高剂量组Faith’s PD指数有明显上升,差异具有统计学意义(P<0.05)。见表1。
2.5 菌群Beta多样性分析
对六组大鼠肠道菌群进行Anosim分析,获得图6和表2,其中统计量R大于0时表示组间差异大于组内差异。可以看出除白果温胆汤中剂量组与白果温胆汤高剂量组两组组间差异小于组内差异,其余各组两两比较均组间差异大于组内差异;其中空白组与模型组、空白组与地塞米松组、模型组与各治疗组、地塞米松组与白果温胆汤各剂量组、白果温胆汤低剂量组与白果温胆汤中、高剂量组之间均具有差异性(P<0.05)。

表2 大鼠粪便样本的组间差异中的R值(Anosim分析)
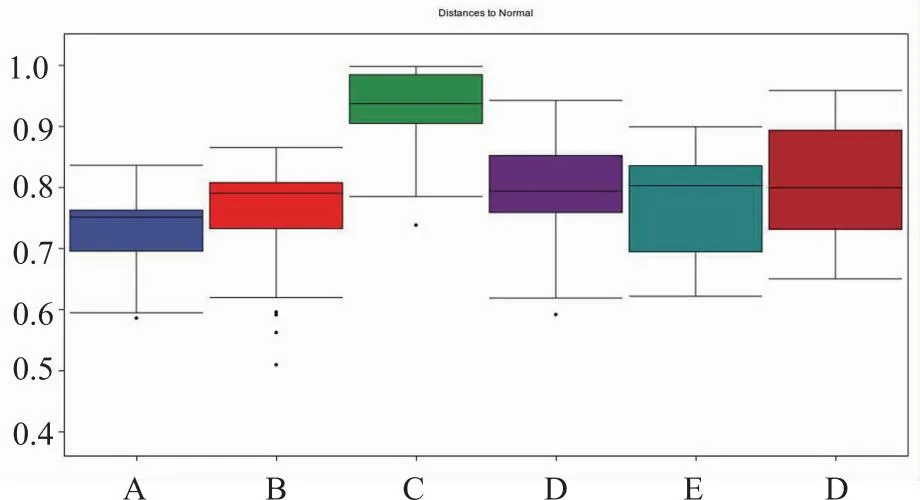
注:A空白组;B模型组;C地塞米松组;D白果温胆汤低剂量组;E白果温胆汤中剂量组;F白果温胆汤高剂量组。
2.6 物种组成分析结果
在科水平如图7所示:与空白组比较,模型组乳杆菌科(Lactobacillaceae)、毛螺菌科(Lachnospiraceae)、副萼苔科(Paraprevotellaceae)、梭菌科(Clostridiaceae)比例升高,瘤胃球菌科(Ruminococcaceae)、消化链球菌科(Peptostreptococcaceae)、拟杆菌门S24-7菌科(S24-7)、脱硫弧菌科(Desulfovibrionaceae)比例降低。与模型组比较,各治疗组中乳杆菌科(Lactobacillaceae)、梭菌科(Clostridiaceae)比例均降低,脱硫弧菌科(Desulfovibrionaceae)比例均升高;地塞米松组、白果温胆汤低剂量组及白果温胆汤中剂量组中瘤胃球菌科(Ruminococcaceae)比例降低,白果温胆汤高剂量组比例升高;地塞米松组Peptostreptococcaceae比例降低,白果温胆汤各治疗组比例升高;地塞米松组和白果温胆汤中剂量组中Lachnospiraceae比例降低,在白果温胆汤低剂量和高剂量组比例升高;在地塞米松组和白果温胆汤低剂量组中S24-7比例降低,在白果温胆汤中剂量组和高剂量组比例升高;在地塞米松组和白果温胆汤低剂量组中Paraprevotellaceae比例降低,在白果温胆汤中剂量组和高剂量组中比例升高。并使用Krona软件进行科水平群落分类学组成的交互展示,以模型组科水平为例,获得图8,可以更清晰看出在科水平,各菌群所占有的比例。
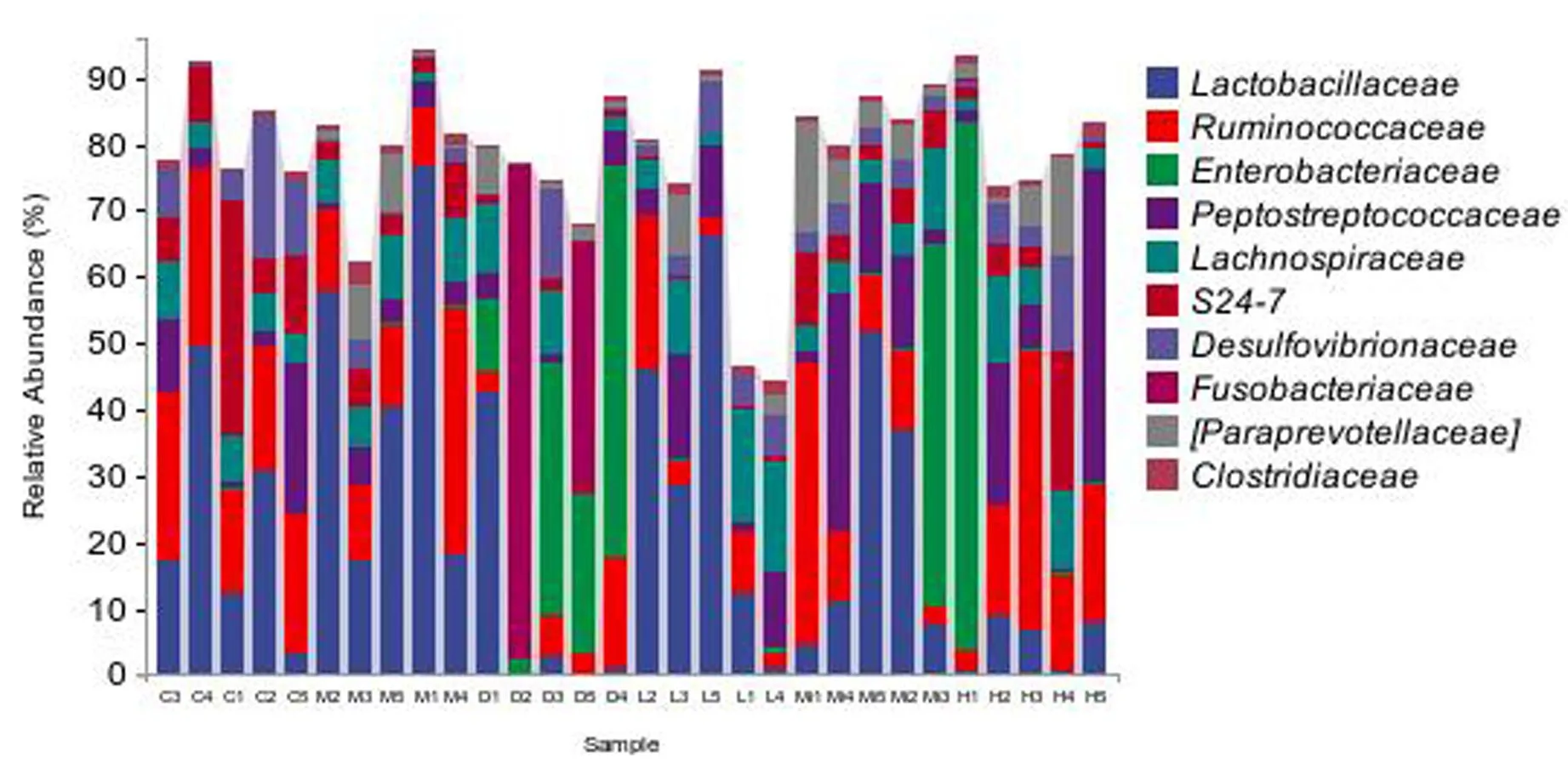
图7 各组大鼠肠道菌群科水平分类学组成分析
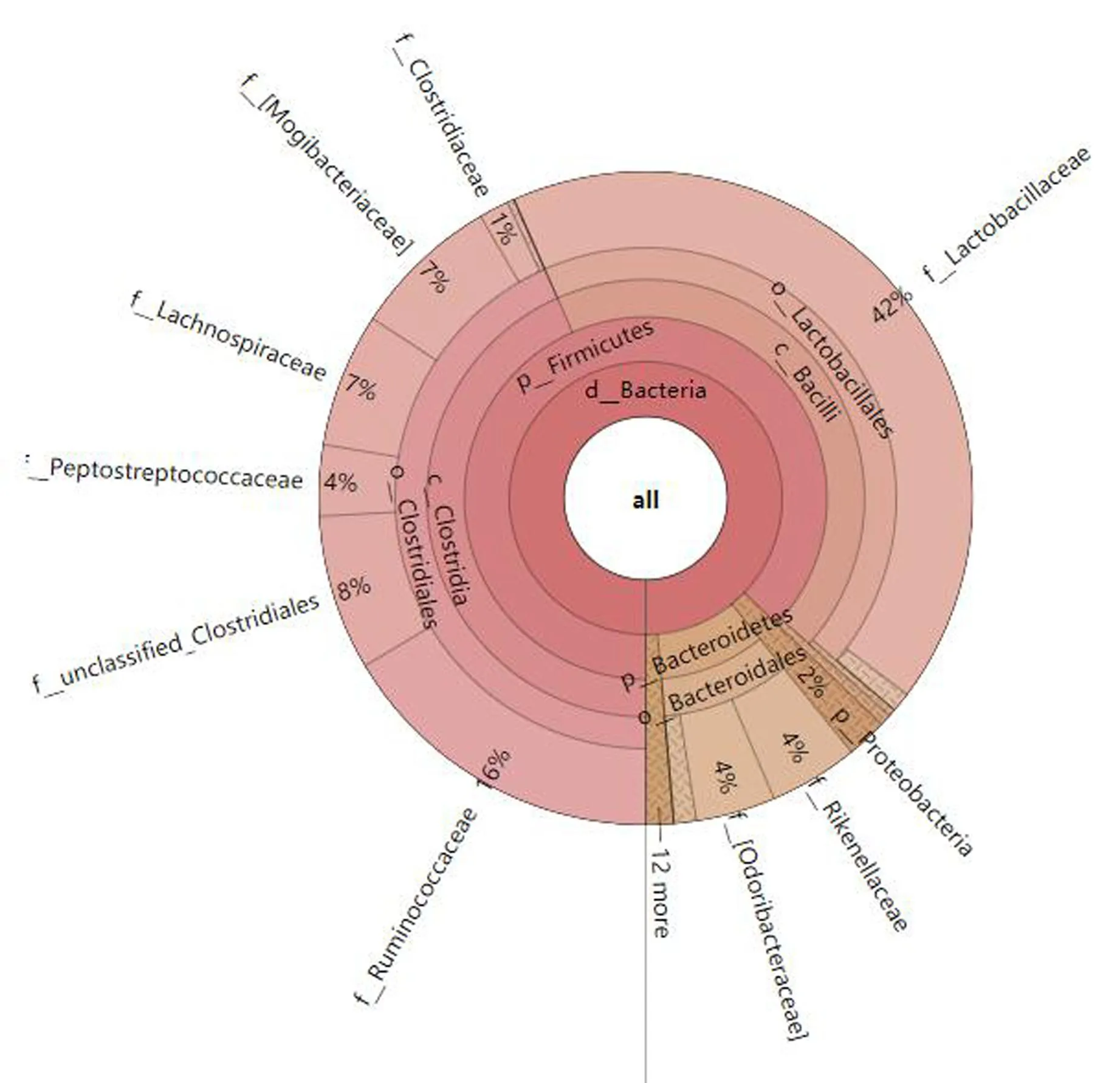
图8 模型组科水平Krona物种组成图
3 讨论
哮喘是一种影响各年龄段的复杂性疾病,是由易感个体对常见“非传染性”环境抗原(过敏原)的异常免疫反应引起,其病因、临床表现和严重程度在个体之间可能存在很大差异[11-12]。在动物实验中,某些肠道微生物菌株已被证明能抑制或减弱与慢性炎症相关的免疫反应,从人类受试者身上研究者发现,改变或不太多样化的肠道微生物群组成与哮喘等疾病相关[13],如急性发作支气管哮喘患儿肠道优势菌数量减少,肠道机会致病菌数量增加[14]。而益生菌可以对未得到最佳控制的哮喘患者产生影响,减少局部和全身炎症状态,控制哮喘,改善患者生活质量[4]。使用双歧杆菌辅助治疗哮喘,能够改善肠道微生态和肺功能,调节免疫功能,减少炎症反应,提高疗效[15]。由此可见,在早期维持正常的肠道微生物群或纠正其紊乱可能是预防和治疗哮喘的一种有效方法[16]。
本实验观察白果温胆汤高、中、低剂量组大鼠致敏后及激发阶段初期,大鼠行为学等一般状况表现与模型组相似,但伴随白果温胆汤高、中、低不同剂量的干预逐渐延长,各剂量组大鼠咳嗽、搔鼻抓脸、烦躁等症状均较模型组有不同程度的改善。这说明白果温胆汤在改善哮喘大鼠行为学等一般状况表现方面具有一定作用。此外,本实验大鼠肺组织HE染色结果显示,与空白组比较,模型组出现一系列病理改变,复制哮喘模型成功,与模型组比较,地塞米松组与白果温胆汤高、中、低剂量组均可改善哮喘大鼠的肺组织结构,降低肺部炎症反应,且随白果温胆汤剂量升高药效越佳。
正常肠道微生物群的失调是考虑哮喘发生发展的重要因素之一[17]。针对肠道菌群多样性进行分析,包括组内菌群的菌群丰度、多样性、均匀度和组间菌群的差异性。Alpha多样性分析显示,与空白组比较,模型组大鼠肠道菌群多样性有下降趋势,可见哮喘会导致大鼠的肠道菌群多样性等发生变化,一定程度破坏大鼠肠道微生态稳态,这与Liu C等[18]研究结果具有一致性,其发现哮喘会破坏肠道菌群的稳定性,降低肠道菌群多样性及丰富度。与模型组比较,地塞米松组大鼠肠道菌群丰度、均匀度、菌群多样性等均有明显下降趋势,白果温胆汤各剂量组随药物浓度增加,肠道菌群的多样性及丰富度等均明显上升,逐渐趋近空白组大鼠的多样性及丰度;可见白果温胆汤在改善哮喘大鼠肠道菌群方面远优于地塞米松,并且随药物浓度升高效果增加,地塞米松会降低肠道菌群多样性与其在机体内一定程度延迟肠道菌群恢复有关[19]。Beta多样性分析结果提示空白组与模型组组间差异较大,说明哮喘大鼠肠道菌群改变较大,分别经过地塞米松和不同剂量的白果温胆汤治疗后,地塞米松组的差异更大,白果温胆汤各剂量组具有不同程度的改善,通过与空白组比较,可见经过白果温胆汤干预后,会使哮喘大鼠肠道菌群改善趋向健康大鼠。有研究表明婴儿早期肠道微生物群的减少和代谢活动的改变与哮喘的发生发展有关[20],且Jia W Q等[21]已证明哮喘患者肠道菌群多样性的变化与哮喘的发病率有关,可见更好的维持肠道菌群多样性对疾病的治疗有较好的效果。
针对科水平,哮喘大鼠乳杆菌科(Lactobacillaceae)比例升高,各治疗组降低,可能其比例改变与哮喘的发生发展有关,Zawistowska-Rojek等[22]研究发现乳酸杆菌科菌株的粘附能力、竞争性粘附、自聚集和共聚集等特性可能会影响胃肠道病原菌的定植和清除,在疾病的发生发展中起到一定的作用。哮喘模型组大鼠梭菌科(Clostridiaceae)比例较空白组升高,各治疗组与模型组比较明显降低,哮喘可能会导致Clostridiaceae比例的升高,从而改变肠道菌群的稳定性,但Huang F等[23]研究认为低水平的梭菌科是哮喘发病的危险因素,这与菌群具有双向调节也可能有关。哮喘大鼠肠道菌群脱硫弧菌科(Desulfovibrionaceae)比例降低,各治疗组比例升高,脱硫弧菌科细菌与肠道炎性疾病和慢性疾病有关[24]。
实验中发现消化链球菌科(Peptostreptococcaceae)模型组比例降低,白果温胆汤干预后比例升高,瘤胃球菌科(Ruminococcaceae)模型组比例降低,白果温胆汤高剂量干预后比例升高,S24-7(拟杆菌门S24-7菌科)模型组比例降低,白果温胆汤中高剂量组治疗后比例升高。可见白果温胆汤可以更好的维持肠道菌群稳定性,尤其是在改善Peptostreptococcaceae、Ruminococcaceae、S24-7比例方面。
综上所述,本研究针对目前哮喘高发的现状,创新性地将中医肺肠相关理论和现代医学的肠道微生态相结合,甄选临床应用多年的基于分消走泄法首创的白果温胆汤为研究药物开展实验研究,药物市场靶向明确。实验结果证实了“肺—肠轴”理论在哮喘中起着重要作用,在一定程度上揭示了哮喘肺肠同病的现代医学内涵,并阐明了白果温胆汤可能通过调节肠道菌群的多样性、丰富度及调节菌群结构改善哮喘。在今后的研究中,笔者将以此为基础,望进一步为中医药调控哮喘提供实验依据和理论基础,探索药物调控机制的新方向,为哮喘的临床治疗和预防提供参考。

