夏桑菊防治干眼症的网络药理学机制及实验验证*
李进良, 胡双飞, 蒙奋兆, 李沛波,吴灏, 彭维, 苏薇薇, 王永刚, 孙维广
1.中山大学生命科学学院 / 广东省中药上市后质量与药效再评价工程技术研究中心 /广东省热带亚热带植物资源重点实验室,广东 广州 510275
2.广州白云山星群(药业)股份有限公司,广东 广州 510288
干眼症称为角结膜干燥症(KCS),具有干涩、异物感、烧灼感和流泪增多等多种症状,全球干眼症患病率为5%~50%,女性和老年人群中患病率更高,严重影响了患者的工作效率与生活质量(Zhao et al.,2023)。目前,干眼症治疗主要依靠西医治疗。西医治疗效果显著,但副作用严重且价格昂贵,给患者家庭乃至社会造成了沉重的经济负担(吴改萍,2022;Demolin et al.,2023)。因此,亟须寻找一种经济、有效、安全性好的治疗方法。中医药具有原材料取自天然药材,临床表现为安全性高、副作用低等特点,中医治疗备受干眼症患者的关注。中药具有多成分、多靶点整体调节效果,可能是治疗干眼症的理想用药。
夏桑菊(XSJ ,Xiasangju)是一种传统的中药复方,主要由夏枯草、桑叶和野菊花组成,源自清代著名温病学家吴鞠通《温病调辨》中的经典方剂“桑菊饮”(孙鹏等,2016)。《中国药典》(2020 版)中记载其具有清肝明目,疏风散热功效,能够用于头晕耳鸣、风热感冒等疾病的治疗;且其原料取自药食两用药材,安全可靠。夏桑菊以蒙花苷(linarin)、绿原酸(CA,chlorogenic acid)、迷迭香酸(RA,rosmarinic acid)等化合物为主要药效成分,抗炎、抗氧化活性效果明显,具备眼部疾病保健、预防、医疗潜力(Wu et al.,2022)。姚向超等(2015)将野菊花开发成滴眼液治疗蒸发过强型干眼,发现可以减轻干眼眼表的炎症反应。石守礼(1978)从中草药中筛选出夏枯草、菊花等配制成红眼1号眼药水治疗急性结膜炎患者,发现治疗2~4 d 即可痊愈。鱼俊杰等采用中药菊花、桑叶等制成清明眼药水,治疗电光性眼炎310例,总有效率99.97%。临床结果表明,清明眼药水是一种疗效好、疗程短的中药滴眼剂。以上表明,夏桑菊具有治疗干眼症潜力(鱼俊杰等,1992)。然而,夏桑菊治疗干眼症的临床及作用机制研究尚未报道,未充分发挥药典对临床用药的指导作用。
本研究采用广州白云山星群(药业)股份有限公司的夏桑菊浸膏,利用网络药理学方法及分子对接技术,探究夏桑菊防治干眼症相关的有效成分、关键靶点以及过程中可能涉及的生物过程和信号通路。在网络药理学分析结果的基础上,采用分子对接验证,通过体外细胞实验验证,进一步探索夏桑菊有效成分对相关关键靶点的作用,为夏桑菊的外用剂型开发提供理论基础。
1 材料与方法
1.1 材料
绿原酸(110753-202119)、蒙花苷(111528-202112)、迷迭香酸(111871-202007)均购于中国食品药品检定研究院,其他材料为:HCE-T 人角膜上皮细胞系(富衡生物,FH1239)、夏桑菊浸膏(广州白云山星群(药业)股份有限公司,B220301)、TNF-α 检测试剂盒(云克隆Cloud-clone,SEA133 Hu)等。
1.2 方法
1.2.1 夏桑菊化学成分检测色谱条件参照《中国药典》夏桑菊颗粒含量测定方法。离子源:ESⅠ(正、负离子模式检测);喷雾电压正模式5 500 Ⅴ,负模式-4 500 Ⅴ;喷雾气为 55 psi(1 psi = 1/145 MPa);辅助加热气50 psi;离子源温度500 ℃;气帘气35 psi;碰撞器压力10 psi;扫描范围m/z50~1 500。
1.2.2 化学成分对应靶点及疾病相关靶点收集通过TCMSP 数据库检索活性成分作用靶点,根据类药性(DL) ≥ 0.18,并结合文献对未纳入筛选标准但报道有生物活性和药理作用的成分也纳入候选活性成分,筛选得到夏桑菊浸膏活性成分的作用靶点。以“xerophthalmia”为关键词,在Gene‐cards 数据库中检索干眼症相关靶点,整理合并得到干眼症对应的疾病靶点。
1.2.3 “药物-成分-靶点-疾病”及PPⅠ网络构建利用网站Ⅴenny 2.1.0 得到夏桑菊浸膏活性成分主要作用靶点。将上述靶点导入Cytoscape3.9.1 及String 数据库构建“夏桑菊浸膏-成分-靶点-疾病”及PPⅠ网络图。
1.2.4 信号通路富集分析及分子对接利用DAⅤⅠD 数据库对作用靶点进行GO(gene ontology)及KEGG(kyoto encyclopedia of genes and genomes)富集分析,选取夏桑菊浸膏核心成分和PPⅠ网络中score排名前4的核心靶点,利用PubChem 数据库、ChemBioOffice Ultra 13.0.2-Chem3D、PyMOL 2.5.2、AutoDockTools-1.5.7软件进行分子对接。
1.2.5 夏桑菊有效成分体外细胞模型验证
1) MTS 法检测细胞活力。细胞用不同浓度(30、50、70、90、110、130 mmol/L)NaCl 分别模拟(350、400、450、500、550、600 mOsm/L)渗透压处理人角膜上皮细胞24 h,更换培养基,加入20 μL MTS 孵育2 h 后,采用酶标仪测定波长490 nm 处吸光度值,按公式计算得各组的细胞活力
2)研究有效成分对高渗诱导下人角膜上皮细胞的保护作用。实验分设不同组,采用600 mOsm/L(130 mmol/L NaCl )渗透压造模并同时给药,MTS检测细胞活力。
3)划痕实验。使用移液管在人角膜上皮细胞上划出数条划痕,倒置显微镜拍0、24 h 图像,观察实验重复3次,并计算平均值。
4)Elisa 法检测各组细胞培养液上清中炎症因子TNF-α 的蛋白浓度。细胞按实验设计分组并做相应处理,每组处理24 h,检测细胞培养液上清。
5)对高渗诱导下人角膜上皮细胞相关基因的表达的检测。细胞按实验设计分组并做相应处理,处理24 h,提取总RNA,逆转录成cDNA 后于-20 ℃条件下保存。采用实时荧光定量基因扩增仪扩增各组cDNA目的基因。
以β-actin为内参,采用2-ΔΔCt法计算目的基因mRNA的相对表达量。
6)统计学分析。采用GraphPad Prism 8.0软件分析实验数据,结果采用单因素方差分析,P< 0.05表示差异具有统计学意义。
2 结 果
2.1 夏桑菊浸膏活性组分的UFLC-Triple-TOFMS/MS分析
采用UFLC-Triple-TOF-MS/MS 技术,分别在正、负离子模式下分析夏桑菊浸膏组成,其总离子流图如图1所示。通过与标准品和公开数据库的一级和二级质谱数据比对,共指认了61个化合物,其中包括19 种黄酮类化合物,17 种有机酸及其酯类化合物,5 种氨基酸类化合物,3 种核苷类化合物以及17 种其他化合物。为进一步利用网络药理学预测其治疗干眼症药效及药效作用机制提供了物质组成的基础数据。

图1 夏桑菊浸膏总离子流图Fig.1 Total ion chromatograms of Xiasangju extracts
2.2 活性成分及疾病相关靶点收集
根据UFLC-Triple-TOF-MS/MS 结果,采用DL≥0.18标准,结合文献对未纳入筛选标准但报道有生物活性和药理作用的成分(高蒲星等,2023),共获得24 个活性成分,通过数据库搜索及可视化处理,共得夏桑菊浸膏活性成分相关靶点315个及“夏桑菊-成分-靶点”网络(图2)。该网络图中共有339个节点和605条边。
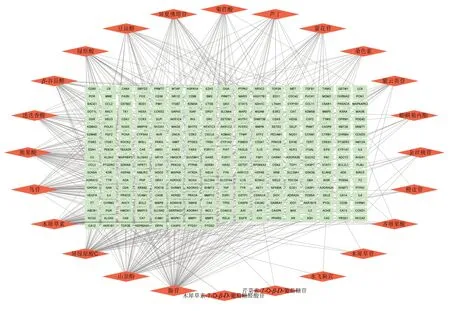
图2 “夏桑菊浸膏-成分-靶点”网络图Fig.2 Xiasangju extracts-component-target network diagram
通过Genecards 数据库检索得到干眼症相关靶点共146 个,与夏桑菊浸膏成分对应靶点取交集,如图3所示,得到夏桑菊浸膏治疗干眼症主要作用靶点21个。

图3 夏桑菊浸膏成分潜在靶点与疾病靶点 Ⅴenny 图Fig.3 Ⅴenny diagram of potential targets and disease targets of compounds of Xiasangju extracts
2.3 网络构建与分析
2.3.1 “夏桑菊-成分-主要靶点-疾病”网络将上述夏桑菊主要靶点及疾病靶点可视化处理,构建“夏桑菊-成分-靶点-疾病”网络图,如图4所示。节点熊果酸、山柰酚、迷迭香酸、绿原酸、蒙花苷、芦丁的度值(degree)排名前6。这6种成分作用靶点数量较多,表明它们可能是夏桑菊中主要药理活性成分。参考2020年版《中国药典》选择夏枯草、桑叶、野菊花测定指标分别为迷迭香酸、绿原酸、蒙花苷作为夏桑菊颗粒成分定量测定的3个质量控制成分,因此选取这3 种成分作为夏桑菊核心成分,后续进行分子对接操作及体外细胞实验验证。
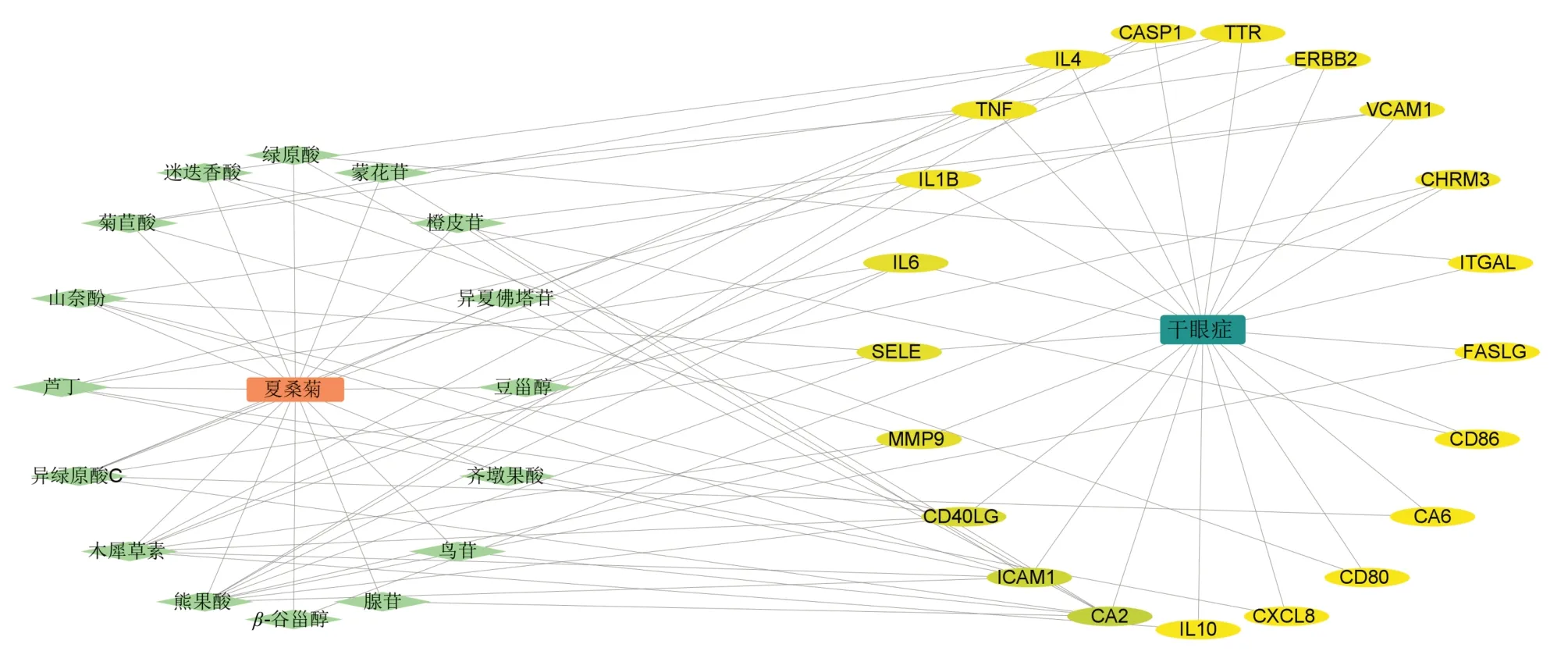
图4 “夏桑菊浸膏-成分-主要靶点-疾病”网络图Fig.4 Xiasangju extracts-component-target-disease network diagram
2.3.2 PPⅠ网络将21 个交集靶点导入String 数据库分析,得到PPⅠ蛋白互作图(图5)。其中度值排名前4 的节点为MMP9、IL-1β、Caspase1、IL-6,表明这些节点在PPⅠ网络中处于核心位置,节点联系较为紧密,可能为夏桑菊治疗干眼症的核心靶点。因此选取这4个靶点作为核心靶点进行后续分子对接操作及体外细胞实验验证。
2.3.3 GO 和KEGG 富集分析利用DAⅤⅠD 数据库对作用靶点富集分析。靶点基因主要参与T细胞增殖的正调控细胞对脂多糖的反应、免疫反应、炎症反应、细胞表面受体信号通路等生物学进程,对应细胞外间隙、质膜外侧、细胞表面等细胞组分以及细胞因子活性、生长因子活性、信号受体活性等分子功能。GO 分析结果按P值从小到大排序,排名前10的条目见图6。

图6 GO分析结果Fig.6 GO analysis results
此外,上述靶点共富集得到66条KEGG 通路,相关通路有细胞因子-细胞因子受体相互作用、晚期糖基化产物-晚期糖基化终末产物受体(AGE-RAGE)信号通路、TNF 信号通路、ⅠL-17 信号通路、NF-κ B 信号通路等。富集通路按P值从小到大排序,将上述结果导入R 语言进行可视化,结果如图7所示。
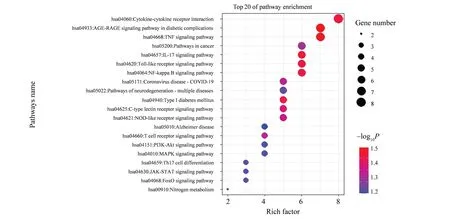
图7 KEGG分析Fig.7 KEGG analysis results
2.4 分子对接
利用Ⅴina 软件将绿原酸、迷迭香酸、蒙花苷分别与MMP9、Caspase1、IL-1β、IL-6这4 个核心靶点对应的蛋白质建立分子对接模型,预测12 种对接结果见表1。其中,结合能数值< -5.0 kJ /mol时表示结合较好,< -7.0 kJ/mol代表结合强烈(郑苏楠等,2022)。结果显示预测结合能均< -6 kJ /mol,代表结合的可能性较高。如图8 显示MMP9 通过GLU-402、GLY-186、TYR-423 与蒙花苷形成氢键结合,Caspase1 通过ARG-240、GLU-241、ARG-391与蒙花苷形成氢键结合。

表1 分子对接最低结合能Table 1 Minimum binding energy for molecular docking kJ/mol

图8 分子对接模式图Fig.8 Molecular docking model diagram
2.5 不同渗透压对人角膜上皮细胞活力的影响
MTS 结果如图9 所示,不同渗透压处理24 h,渗透压350、400、450 mOsm/L 时对人角膜上皮细胞的活性无显著性影响,500~600 mOsm/L 时降低了人角膜上皮细胞活性。基于渗透压为600 mOsm/L时能够显著降低人角膜上皮细胞活力(P< 0.01)。因此,后续选用600 mOsm/L 渗透压处理,以探究迷迭香酸、绿原酸、蒙花苷3种有效成分对细胞的保护作用;渗透压 ≤ 450 mOsm/L 时,对人角膜上皮细胞的活性无显著性影响,故选用450 mOsm/L渗透压造模探究迷迭香酸、绿原酸、蒙花苷对细胞的保护作用机制及迁移能力。
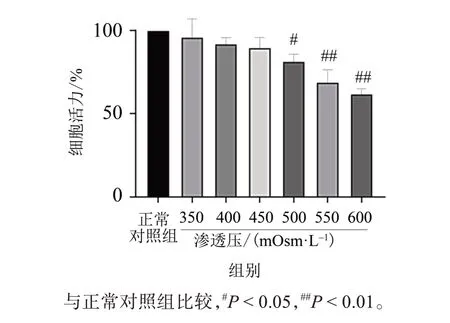
图9 不同渗透压处理24 h对人角膜上皮细胞细胞活性的影响 (n=3)Fig.9 Effects of different hyperosmosis treatment for 24 h on the cell activity of human corneal epithelial cells (n=3)
2.6 主要活性成分对高渗诱导的人角膜上皮细胞的保护作用
将人角膜上皮细胞在600 mOsm/L 渗透压培养基中培养24 h 后,与对照组相比,600 mOsm/L 组的细胞活力降至49.3%(P< 0.01)。与600 mOsm/L比较,蒙花苷可显著提高人角膜上皮细胞活性,细胞活性提高到74.8%(P< 0.05),如图10 所示。表明蒙花苷对高渗透压所致的细胞活性降低具有显著抑制作用。

图10 3种主要活性成分对高渗诱导的人角膜上皮细胞的保护作用的影响(n=3)Fig.10 Effects of 3 major active components on the protection of human corneal epithelial cells induced by hyperosmosis (n=3)
2.7 对高渗诱导的人角膜上皮细胞的迁移能力的影响
为探讨3种活性成分是否在体外对人角膜上皮细胞具有促进修复的功能,通过划痕实验检测细胞的迁移能力。在24 h 高渗刺激后,正常对照组中角膜上皮细胞的迁移率为54.55%,450 mOsm/L的刺激条件下仅为9.04%,正常组与模型组之间有统计学差异(P< 0.01);在绿原酸及蒙花苷的作用下,迁移率升高到32%及18%,结果有统计学差异(P< 0.05),研究表明 450 mOsm/L 的高渗刺激会降低角膜上皮细胞的迁移能力,而绿原酸及蒙花苷能提升高渗下角膜上皮细胞的移行能力,如图11显示。

图11 实验条件下24 h后的20 倍镜划痕实验的代表性图和量化统计图 (n=3)Fig.11 Representative diagram and quantitative statistical plots of 20-fold mirror scratch experiment after 24 hours under experimental conditions (n=3)
2.8 对高渗诱导下人角膜上皮细胞IL-1β 及Caspase1基因的表达
PCR 结果显示,450 mOsm/L 组IL-1β、Cas‐pase1mRNA 的相对表达量与正常对照组相比升高(P<0.01);与450 mOsm/L 相比,迷迭香酸、绿原酸组中的Caspase1、IL-1βmRNA 的相对表达量显著降低(P<0.05),蒙花苷组中的Caspase1mRNA的相对表达量显著降低。如图12 所示3 种有效成分能够有效抑制高渗诱导下人角膜上皮细胞中IL-1β及Caspase1基因表达。
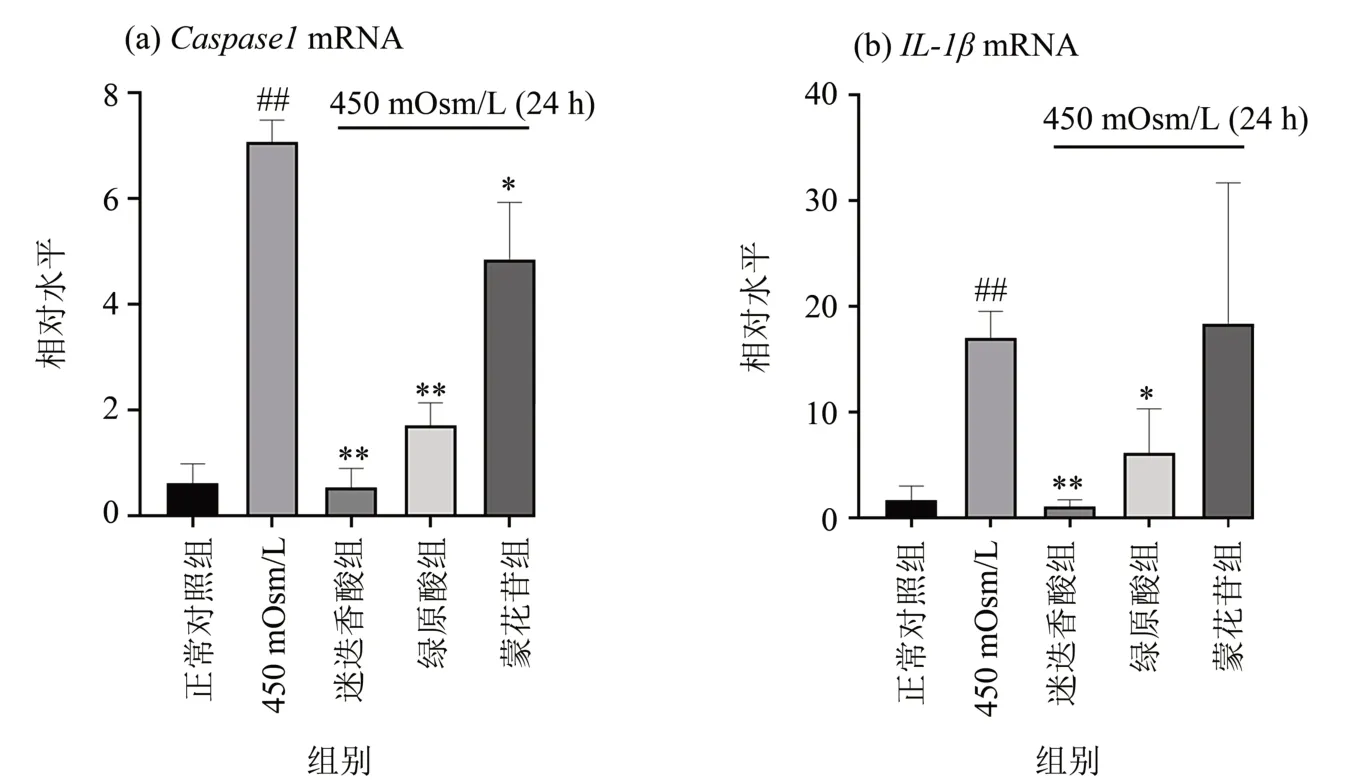
图12 3种活性成分对高渗诱导下人角膜上皮细胞IL-1β、Caspase1基因的表达的影响(n=3)Fig.12 Effects of 3 major active components on the expression of IL-1β and Caspase1 genes in human corneal epithelial cells induced by hyperosmosis (n=3)
2.9 对高渗诱导下人角膜上皮细胞分泌TNF-α 水平的影响
Elisa 结果显示, 与正常对照组相比,450 mOsm/L 组中的TNF-α 蛋白浓度明显升高(P< 0.05);与450 mOsm/L 组相比,迷迭香酸、绿原酸组的TNF-α蛋白浓度明显降低(P< 0.05)如图13 所示。表明迷迭香酸、绿原酸有效抑制了细胞中炎症因子TNF-α的分泌。

图13 3种活性成分对高渗诱导下人角膜上皮细胞分泌TNF-α 水平的影响(n=3)Fig.13 Effects of 3 major active components on the secretion of TNF-α by human corneal epithelial cells induced by hyperosmosis (n=3)
3 讨 论
通过UFLC-Triple-TOF-MS/MS 技术共指认61个化合物,筛选获得夏桑菊中24 种化合物成分,在“夏桑菊-化合物-靶点”网络中,发挥药效作用最活跃的成分为熊果酸、山柰酚、绿原酸、迷迭香酸、芦丁、蒙花苷。研究表明,这6种化合物能够抑制炎症反应和氧化应激,减轻眼部炎症和细胞损伤(Chen et al,2021;李亚梅等,2020;胡盼盼,2021;罗飞等,2021)。夏桑菊浸膏中的6 种活跃成分起到治疗干眼症的关键作用。
PPⅠ网络及关键靶点分析,夏桑菊通过MMP9、IL-1β、Caspase1、IL-6等关键靶点发挥药效作用。该4个靶点与干眼症密切相关,其中Caspase1、ⅠL-1β 为已报道ROS-NLRP3-ⅠL-1β 信号通路中的成分(周洋等,2020)。高渗产生的ROS可诱导NLRP3的激活,进而促进Caspase-1 激活导致ⅠL-1β 分泌增加,突出了ROS-NLRP3-ⅠL-1β 信号轴在干眼症进展过程中的启动作用(Dai et al.,2019)。因此,本研究利用氯化钠诱导的人角膜上皮细胞高渗模型研究发现,迷迭香酸、绿原酸及蒙花苷对高渗诱导下对人角膜上皮细胞具有保护及提升迁移能力作用;在基因转录水平上,3 种有效成分下调Caspase1和IL-1β的mRNA 表达,减少促炎介质产生;这与本研究基于网络药理学的预测结果相互印证。
通过GO、KEGG 结果分析,细胞因子和其受体相互作用在干眼症的发生和发展中发挥着重要的作用。例如,ⅠL-1β、ⅠL-6、ⅠL-17、TNF 等多种细胞因子及受体的水平在干眼症患者的泪液中明显升高,这些细胞因子刺激角膜、结膜和泪腺上皮细胞分泌更多的炎症介质和细胞因子,从而引起眼部组织的炎症反应和损伤(Liu et al.,2020;Liang et al.,2020;Wei et al.,2014)。AGE-RAGE 信号通路在干眼症的发病过程中也发挥了重要作用。RAGE是一种跨膜受体,广泛表达于多种类型细胞上,包括免疫细胞、血管内皮细胞、神经元和肌肉细胞等,与AGE结合后可以激活多种信号通路,从而引起炎症反应、氧化应激和细胞凋亡等(Kaji et al.,2006)。研究表明,在干眼症患者的泪液和角膜中,AGE 和RAGE 的水平均明显升高,这与疾病的发生和发展密切相关(Wang et al.,2011)。AGE-RAGE 的激活使得炎症反应和氧化应激的发生,从而导致眼部组织的损伤和炎症反应。本研究通过体外细胞模型验证了高渗诱导下IL-1β基因表达及TNF-α 蛋白分泌水平升高,进一步揭示了GO与KEGG结果的可靠性。
分子对接结果表明,3 种化合物与4 个靶点有较好的结合能力,此外,体外实验结果也显示3种化合物能对相关蛋白及基因发挥作用。进一步说明分子对接结果的可靠性。后续将对该研究进一步探究,确定这些化合物的治疗剂量和途径。
综上,本研究联合网络药理学与体外细胞实验,初步阐释了夏桑菊的物质基础与其防治干眼症的作用机制,并挖掘了更多可能靶点,为进一步研究其机制提供了基础与方向。

